2. 遵义医科大学附属医院感染管理科, 贵州 遵义 563003
2. Department of Healthcare-associated Infection Management, Affiliated Hospital of Zunyi Medical University, Zunyi 563003, China
肺炎克雷伯菌(Klebsiella pneumoniae, KPN)是革兰阴性(G-)杆菌,需氧或兼性厌氧,属于机会性病原体,广泛分布于医院的各种环境中,可引起患者多种组织器官的感染,常见的有血液系统、呼吸系统、泌尿系统等。β-内酰胺类抗生素中,抗菌活性最强、抗菌谱最广的是碳青霉烯类抗生素,因其只对细菌有杀伤作用,故对宿主毒性小,对头孢菌素酶(AmpC酶)及超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)作用效果稳固,是治疗大多数革兰阳性(G+)菌、G-菌及耐药菌感染的极佳药物。但近年来,耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)的检出率逐步攀升,并已在全球多个国家散发和(或)流行[1-2]。CRKP的耐药机制极其复杂,结合各个国家和地区的研究报道[3-4],主要包括以下四个方面:(1)产碳青霉烯酶;(2)高产AmpC酶或ESBLs,且外膜孔蛋白(outer membrane porin, OMP)缺失或者OMP表达量减少;(3)青霉素结合位点缺失;(4)外排泵系统作用等,其中以产碳青霉烯酶最常见和重要。本研究收集2017年1—12月某大型三甲医院分离自临床各科室的CRKP,检测碳青霉烯酶基因,并进行同源性分析,发现该院2017年存在ST11型和ST875型CRKP的克隆流行,现报告如下。
1 材料与方法 1.1 菌株来源收集某三甲医院2017年1—12月临床各科室分离的CRKP 22株。菌株入选标准:(1)为CRKP;(2)少数患者住院期间多次培养出CRKP,则纳入该患者首次培养的CRKP;(3)CRKP感染患者住院资料完整。质控菌株为大肠杆菌ATCC 25922(购于大连宝公司),阳性对照菌为该院2016年发现的并经测序确证的产KPC-2型CRKP和产NDM-1型CRKP。
1.2 主要仪器和试剂VITEK 2 Compact分析系统(生物梅里埃公司),高速离心机(德国Sigma公司),PCR扩增仪、PowerPac Basic电泳仪、GelDocXR凝胶成像系统均为美国伯乐Bio-Rad公司产品,厄他培南(ETP)、亚胺培南(IPM)及美罗培南(MEM)三种10 μg/片的药敏纸片均为Oxoid公司产品,IPM粉剂及ETP粉剂购自杭州默沙东公司,MEM粉剂购自深圳市海滨公司,细菌蛋白提取试剂盒、M-H培养基、酚红、EDTA、琼脂糖Agarose、硼酸、Tris碱、GoldView Ⅰ型核酸染色剂均为北京索来宝产品,ZnSO4·7H2O(上海拜力公司),引物合成(上海生工),2×Taq PCR Master Mix(北京派拓公司),DNA Marker(2 000 bp)(宝日医公司)等。
1.3 试验方法 1.3.1 药敏试验试验结果判断参照2018版美国临床实验室标准化协会标准(Clinical and Laboratory Standard Institute, CLSI) [5]。
1.3.1.1 药敏纸片扩散法(K-B法)采用K-B法测定菌株对IPM、MEM及ETP三种药敏纸片的抑菌圈直径。
1.3.1.2 微量肉汤稀释法通过微量肉汤稀释法测定菌株对IPM、MEM和ETP的最低抑菌浓度(minimal inhibitory concentration, MIC)。
1.3.2 碳青霉烯酶检测 1.3.2.1 改良Hodge试验(modified Hodge testing, MHT)取适量大肠埃希菌ATCC 25922的菌落置于生理盐水中,用比浊仪配制为0.5麦氏单位,1 :10稀释后分别均匀涂布于3个M-H琼脂平板,干燥3~10 min后,3个平板中央分别贴IPM、MEM及ETP药敏纸片,从平板边缘向纸片边缘依次划线接种待测菌株、阳性对照及阴性对照菌,直线至少长20~25 mm,需氧(35±2)℃培养16~20 h后观察结果。判断标准:待测菌株若产生碳青霉烯酶(MHT阳性),则大肠埃希菌ATCC 25922的抑菌环周边和待测菌株接种线交汇处有菌株增强生长的情况,呈苹果蒂现象。
1.3.2.2 Carba NP试验Carba NP A液为取2 mL 0.5%的酚红溶液加入到16.6 mL的实验室试剂用水中,再加入180 μL 10 mmol/L的ZnSO4溶液,使每毫升的5 g/L酚红中含0.1 mmol/L的ZnSO4, 使将A液pH值调至7.8±0.1,Carba NP B液为A液+6 mg/mL亚胺培南,A、B液的颜色均为红色或橘红色。分别在2支离心管(a管、b管)中加入100 μL细菌蛋白提取试剂,2支管中分别加入1~2个菌落的待测菌(空白对照组只含细菌蛋白提取试剂,不含待测菌),涡旋振摇5 s后在a管中加入100 μL A液,b管中加入100 μL B液,将a管和b管均置入(35±2)℃的恒温培养箱中培养2 h,每30 min观察一次溶液颜色是否变化。判断结果参照2018版CLSI标准[5]。
1.3.3 PCR扩增耐药基因运用煮沸法提取菌株DNA模板,PCR扩增以下耐药基因:KPC、SME、IMI、NDM-1、IMP、SIM、VIM、OXA-48,引物序列参照相关文献[6-8],由上海生工公司合成。扩增体系为25 μL体积,包括2×PCR Master Mix 12.5 μL、DNA模板2 μL、100 μmol/L上游引物0.1 μL、100 μmol/L下游引物0.1 μL、加PCR超纯水至25 μL。PCR扩增条件:94℃ 3 min预变性,94℃ 30 s变性,退火温度(KPC、SME、IMI、NDM -1、IMP、SIM、VIM、OXA-48 59、45、47、58、50、53、54、56℃) 30 s退火,72℃ 1 min延伸,35个循环,72℃ 10 min再延伸。取5 μL的PCR产物加入1.2%的琼脂糖凝胶孔中,在0.5×TBE电泳液中电泳,在凝胶成像系统中观察结果。将PCR扩增阳性的产物送上海生工纯化并测序,测序结果用MegAlign软件与基因库中的序列进行比对。
1.3.4 同源性分析 1.3.4.1 多位点序列分型(multilocus sequence typing, MLST)参照MLST官方网站(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html)上提供的KPN的7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)序列合成引物,扩增体系同1.3.3,扩增条件为94℃ 5 min预变性,94℃ 50 s变性,50℃ 30 s退火,72℃ 50 s延伸,30个循环,72℃ 10 min再延伸。PCR产物送上海生工公司测序,将测序结果与MLST数据库比对,得到等位基因编码,将所得编码按照gapA、infB、mdh、pgi、phoE、rpoB、tonB管家基因顺序组合,在MLST数据库中对比查找完全符合的ST型。
1.3.4.2 肠杆菌科基因间一致重复序列PCR(enterobacterial repetitive intergenic consensus-PCR, ERIC-PCR)基因引物序列为:ERIC-1: 5’-ATGTAAGCTCCTGGGGATTCAC-3’;ERIC-2: 5’-AAGTAAGTGACTGGGGTGAGCG-3’。扩增体系同1.3.3,扩增条件为94℃ 3 min预变性,94℃ 30 s变性,55℃ 30 s退火,72℃ 1 min延伸,35个循环,72℃ 10 min再延伸。PCR产物电泳结果判断标准为:如果菌株属于同一类型,则电泳条带的数量和位置相同[9]。
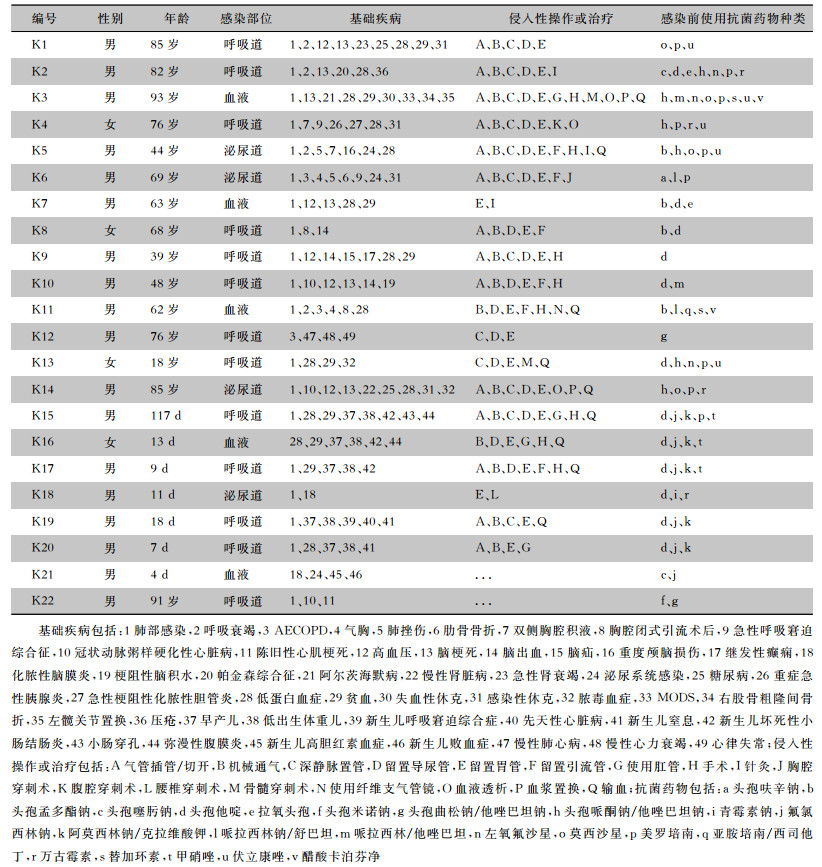
2 结果 2.1 菌株资料22株CRKP主要分离自新生儿科及ICU,分别占31.81%、27.27%,其余为脑血管科(18.18%)、其他科室(呼吸内科、胸外科、全科病房、血液内科、肾内科各占4.55%)。22例CRKP感染患者中,11例年龄≥60岁,6例年龄<28 d;呼吸道感染者13例;所有患者均患2种或以上基础疾病;20例患者住院期间有过≥2项的侵入性操作或治疗;20例患者住院期间使用抗菌药物种类≥2种。见表 1。
| 表 1 22例CRKP感染患者的基本资料 Table 1 Basic data of 22 patients with CRKP infection |
|
22株CRKP对ETP、IPM和MEM耐药率均为100%,对临床其他常见抗菌药物也保持高度耐药,对氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢曲松、头孢他啶、头孢哌酮/舒巴坦、氨曲南100%耐药,对头孢吡肟、呋喃妥因、头孢替坦、环丙沙星、左氧氟沙星耐药率>60%,对复方磺胺甲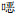
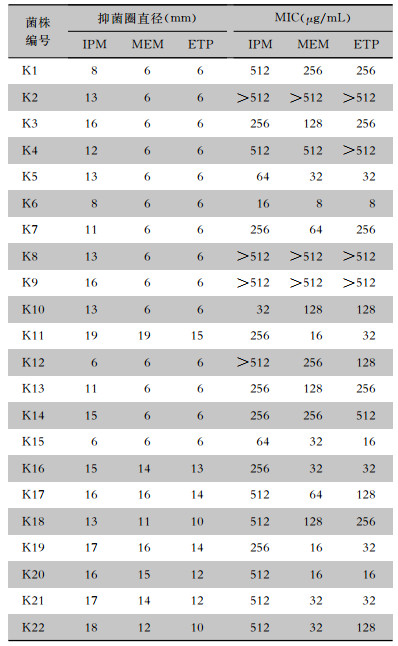
K-B法和微量肉汤稀释法结果显示,22株CRKP对IPM、MEM及ETP均耐药。抑菌圈直径和MIC值见表 2。
| 表 2 K-B法和微量稀释法对22株CRKP药敏检测结果 Table 2 Antimicrobial susceptibility testing results of 22 strains of CRKP detected by Kirby-Bauer disk diffusion and broth microdilution method |
|
采用MHT和Carba NP试验检测CRKP碳青霉烯酶,结果MHT阳性13株(K1-K9,K11-K14),Carba NP试验阳性14株(K1-K14)。见图 1。
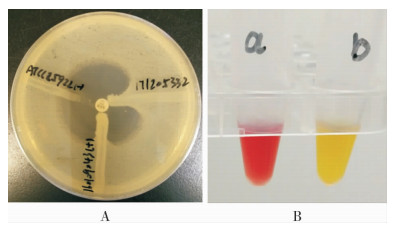 |
| A:MHT阳性结果, ATCC 25922为阴性对照,160109043为阳性对照,171205332为试验结果阳性菌株;B:Carba NP试验阳性结果 图 1 CRKP碳青霉烯酶检测结果 Figure 1 CRKP carbapenemase detection results |
PCR扩增碳青霉烯酶检测阳性菌株,经测序结果显示,14株产酶菌株均携带KPC-2基因,K12菌株同时携带NDM-1基因。PCR扩增产物电泳结果见图 2。所有菌株均未扩增出SME、IMI、IMP、SIM、VIM及OXA-48基因。
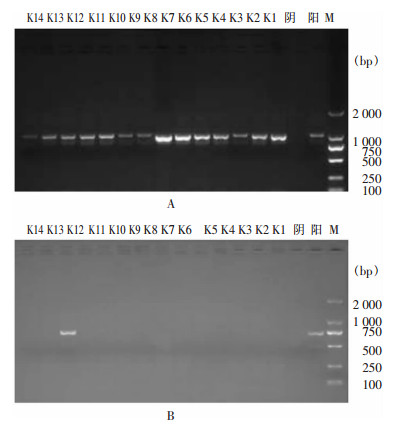 |
| A:KPC基因; B:NDM-1基因; M:2 000 bp DNA Marker;阴:阴性对照;阳:阳性对照 图 2 KPC基因和NDM-1基因PCR扩增产物电泳图 Figure 2 Electrophoresis map of PCR amplification pro-ducts of KPC gene and NDM-1 gene |
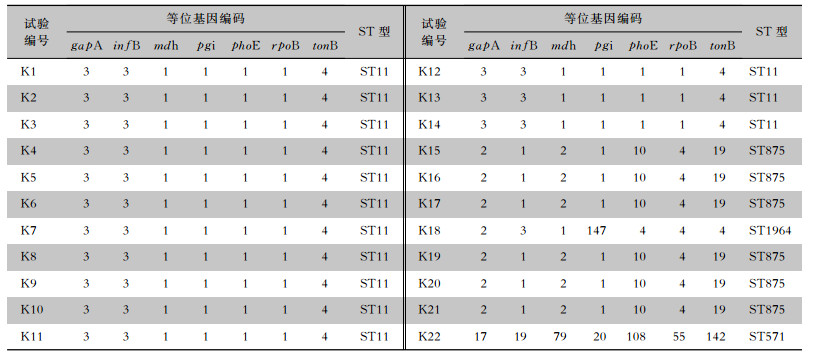
按MLST法22株CRKP可分为ST11、ST875、ST1964和ST571四种序列型,其中K1~K14为ST11型,K15~K17和K19~K21为ST875型,K18为ST1964型,K22为ST571型,MLST结果详见表 3。按ERIC-PCR法分型可分为A、B、C三种类型,其中K1~K14及K18为A型,K15~K17和K19~K21为B型,K22为C型,见图 3。
| 表 3 22株CRKP MLST结果 Table 3 MLST results of 22 strains of CRKP |
|
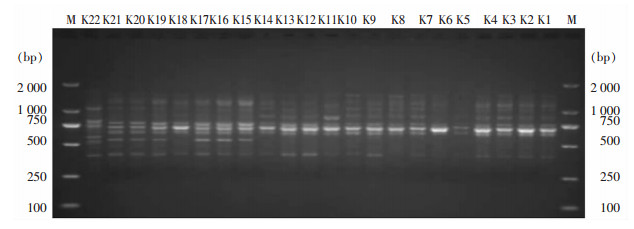 |
| M:2 000 bp DNA Marker 图 3 22株CRKP ERIC-PCR扩增产物电泳图 Figure 3 Electrophoresis map of ERIC-PCR amplification products of 22 strains of CRKP |
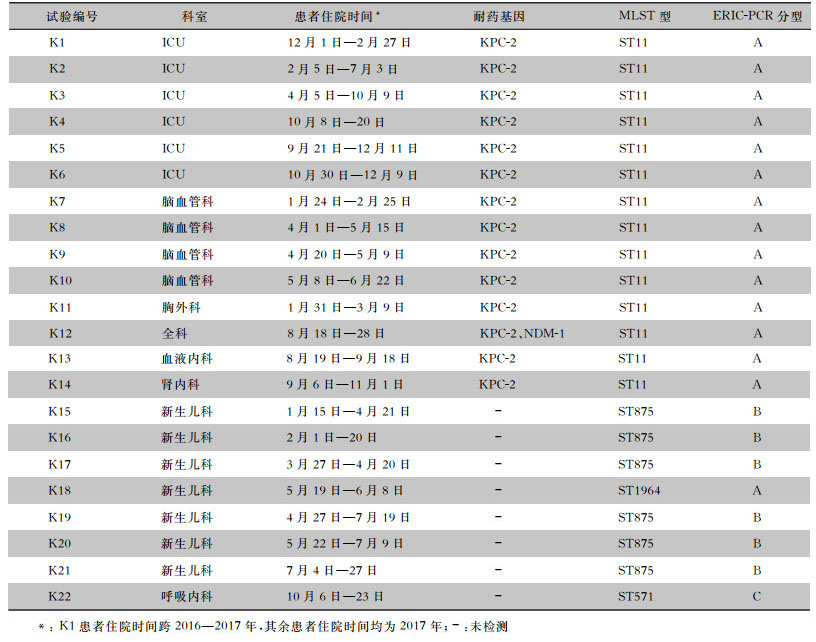
分型结果相同的菌株中K1~K6同属ICU,K7~K10同属脑血管外科,其中K1与K2,K2与K3,K3与K5,K8与K9,K9与K10均有共同住院时间,K8与K9病床相连,且患者存在转科情况,K2、K8均由脑血管外科转入ICU,K13、K14分别从ICU转入血液内科、肾内科。新生儿科K15与K16及K17均有共同住院时间,K19、K20和K21均有共同住院时间,K20与K21有共同住院时间,见表 4。
| 表 4 22株CRKP菌株来源科室与同源性检测结果 Table 4 Source departments and homology detection results of 22 strains of CRKP |
|
KPN碳青霉烯酶可水解包括碳青霉烯类抗生素在类的β-内酰胺类抗生素,如头孢菌素类、青霉素类及单环酰胺类,导致菌株对多种抗菌药物耐药,但其不能水解头霉素类抗生素。中国细菌耐药性监测数据[10]显示,2015年KPN对MEM的耐药率为2.90%,对IPM的耐药率为3.00%,仅过两年,KPN对MEM及IPM的耐药率分别上升至24.00%、20.90%,上升幅度在5倍以上,而感染CRKP后病死率高达47.90% [11]。本研究中22株CRKP对IPM、MEM、ETP的耐药率均达100%,对临床其他常用的抗菌药物也高度耐药。建议临床医生应根据患者的症状和体征,并结合药敏结果,严格选择抗菌药物,避免滥用抗菌药物。22株CRKP中有7株分离自新生儿科,6株分离自ICU;22例患者中,11例年龄≥60岁,6例年龄<28 d;所有患者均患2种或更多基础疾病,20例患者住院期间有过≥2项的侵入性操作或治疗,20例患者住院期间使用抗菌药物种类≥2种,提示病情重、基础疾病多、免疫力低、有创操作和(或)无创操作多、长期使用抗菌药物和(或)联用抗菌药物的患者可能易感染CRKP,与巴西学者Da silva等[12]的研究结论一致。对具有上述特征的患者,医务人员应给予高度关注,尽量避免医院感染的发生。22株CRKP中13株从呼吸道标本中检出,表明细菌容易侵入呼吸道,引起呼吸系统感染,临床医生应加强患者气道管理,及时送检标本,争取做到早发现,早防控,早治疗。
迄今为止,已发现24种KPN的KPC亚型(KPC-1和KPC-2后被证实为同一型别),其中KPC-2和KPC-3是国内外最常见型别,已在全球多个国家暴发流行[13-14]。本研究中,14株产酶菌株均携带KPC-2耐药基因,其中K12同时携带NDM-1基因,提示该院碳青霉烯酶基因存在多态性,但同时携带KPC-2及NDM-1基因的菌株表现出的耐药性与其他菌株无明显差异,可能是NDM-1基因并未表达或仅仅低表达。携带碳青霉烯酶耐药基因的14株CRKP,MLST分类属于ST11型,与中国CRKP菌株的主要流行基因型和克隆型一致[15]。该院还存在ST875型CRKP的克隆流行,此型全部分布于新生儿科,与祝俊英等[16]研究结果不同,可能与不同地区抗菌药物使用差异有关,且新生儿科的7株CRKP产酶试验均阴性,提示可能存在其他耐药机制。此外该院还存在ST1964和ST571两种序列型,但尚未在该院流行。
研究[17]证实,CRKP的耐药基因可位于以下基因元件上:包括可移动的质粒、整合子及插入序列等,可在不同患者、病区、医院、地区,甚至不同菌种间进行传播,造成大范围的流行。本研究同源性分析发现,K1~K14 MLST均为ST11型,ERIC-PCR分型均为A型;K15~K17和K19~K21 MLST均为ST875型,ERIC-PCR分型均为B型;K22菌株在两种同源性分析方法中均独立成一型,分别为ST571型和C型,以上菌株两种同源性分析方法结果一致。分型结果相同的菌株中K1~K6同属ICU,K7~K10同属脑血管外科,其中K1与K2,K2与K3,K3与K5,K8与K9,K9与K10均有共同住院时间,且K8与K9病床相连,K2是由脑血管外科转入,与脑血管外科的K7有共同住院时间,K8因病情加重后转入ICU,与ICU的K2与K3均有共同住院时间,血液内科的K13是由ICU转入的,与ICU的K3有共同住院时间,而肾内科的K14是由ICU转入的,与ICU的K3、K5均有共同住院时间,提示该院ICU、脑血管外科、肾内科和血液内科病区间存在ST11型CRKP的克隆传播。新生儿科分型相同的K15~K17和K19~K21中,K15与K16及K17均有共同住院时间,K19与K20和K21均有共同住院时间,而K20与K21有共同住院时间,说明2017年该院新生儿科存在ST875型CRKP暴发流行。针对此次ST11型和ST875型CRKP在该院的暴发流行,通过及时与相关科室沟通,隔离感染患者,加强医务、保洁等人员的医院感染防控意识,加强手卫生管理,及清洁和消毒床单元和共用物品,已基本控制该院CRKP的进一步播散。
近年来,CRKP在全球各地散发和(或)流行时有发生,甚至在曾经检出率较低的欧洲国家也出现了流行,对CRKP的监测与防控仍是一项非常重要的工作。临床医生应了解CRKP的耐药机制及分子流行病学特点,做好医院感染防控,减少CRKP的传播。
| [1] |
Tang Y, Shen P, Liang W, et al. A putative multi-replicon plasmid co-harboring beta-lactamase genes blaKPC-2, blaCTX-M-14 and blaTEM-1 and trimethoprim resistance gene dfrA25 from a Klebsiella pneumoniae sequence type (ST) 11 strain in China[J]. PLoS One, 2017, 12(2): e0171339. DOI:10.1371/journal.pone.0171339 |
| [2] |
Satlin MJ, Chen L, Patel G, et al. Multicenter clinical and molecular epidemiological analysis of bacteremia due to carbape-nem-resistant enterobacteriaceae(CRE) in the CRE epicenter of the United States[J]. Antimicrob Agents Chemother, 2017, 61(4): 2349-2365. |
| [3] |
Lorenzoni VV, Silva DDC, Rampelotto RF, et al. Evaluation of carbapenem-resistant Enterobacteriaceae in a tertiary-level reference hospital in Rio Grande do Sul, Brazil[J]. Rev Soc Bras Med Trop, 2017, 50(5): 685-688. DOI:10.1590/0037-8682-0209-2017 |
| [4] |
Madkour LA, Soliman MS, Hassan DM, et al. Detection of carbapenemase-producers:evaluating the performance of the carbape-nem inactivation method and Carba NP test versus multiplex PCR[J]. J Glob Antimicrob Resist, 2017, 9(1): 10-14. |
| [5] |
Clinical and Laboratory Standard Institute(CLSI). Perfor-mance standards for antimicrobial susceptibility testing[J]. CLSI document M100: 2018. Wayne, PA: CLSI, 2018.
|
| [6] |
Smith ME, Hanson ND, Herrera VL, et al. Plasmid-mediated, carbapenem-hydrolysing beta-lactamase, KPC-2, in Klebsiella pneumoniae isolates[J]. J Antimicrob Chemother, 2003, 51(3): 711-714. DOI:10.1093/jac/dkg124 |
| [7] |
刘婧娴.耐碳青霉烯类肺炎克雷伯菌的耐药机制及分子流行病学研究[D].上海: 上海交通大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10248-1016789168.htm
|
| [8] |
黄维真, 梁军荣, 王双杰, 等. 新生儿耐碳青霉烯类肺炎克雷伯菌耐药性及耐药基因研究[J]. 检验医学与临床, 2016, 13(15): 2100-2102. DOI:10.3969/j.issn.1672-9455.2016.15.011 |
| [9] |
苏珊珊, 宫雪, 张吉生, 等. 重症监护室流行耐碳青霉烯类肺炎克雷伯菌的耐药机制及同源性分析[J]. 中国感染与化疗杂志, 2018, 18(5): 508-514. |
| [10] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [11] |
Wang Z, Qin RR, Huang L, et al. Risk factors for carbape-nem-resistant Klebsiella pneumoniae infection and mortality of Klebsiella pneumoniae infection[J]. Chin Med J(Engl), 2018, 131(1): 56-62. |
| [12] |
Da Silva KE, Maciel WG, Sacchi FP, et al. Risk factors for KPC-producing Klebsiella pneumoniae:watch out for surgery[J]. J Med Microbiol, 2016, 65(6): 547-553. DOI:10.1099/jmm.0.000254 |
| [13] |
Mathers AJ, Peirano G, Pitout JD. The role of epidemic resistance plasmids and international high-risk clones in the spread of multidrug-resistant Enterobacteriaceae[J]. Clin Microbiol Rev, 2015, 28(3): 565-591. DOI:10.1128/CMR.00116-14 |
| [14] |
Chen L, Mathema B, Chavda KD, et al. Carbapenemase-producing Klebsiella pneumoniae:molecular and genetic decoding[J]. Trends Microbiol, 2014, 22(12): 686-696. DOI:10.1016/j.tim.2014.09.003 |
| [15] |
Lee CR, Lee JH, Park KS, et al. Global dissemination of carbapenemase-producing Klebsiella pneumoniae:Epidemiology, genetic context, treatment options, and detection methods[J]. Front Microbiol, 2016, 7: 895. |
| [16] |
祝俊英, 王春, 孙燕, 等. 儿童患者中分离的碳青霉烯类耐药肺炎克雷伯菌分子流行病学分析及耐药机制研究[J]. 中国感染与化疗杂志, 2016, 16(5): 578-582. |
| [17] |
Poirel L, Lienhard R, Potron A, et al. Plasmid-mediated carbapenem-hydrolysing β-lactamase KPC-2 in a Klebsiella pneumoniae isolate from Switzerland[J]. J Antimicrob Chemother, 2011, 66(3): 675-676. DOI:10.1093/jac/dkq499 |



