颈部脊髓损伤(cervical spinal cord injury, CSCI)作为最常见的脊髓损伤类型之一,不仅发病率、病死率和致残率高,而且并发症极多[1],其中肺部感染位居首位[2],是脊髓损伤患者的主要死亡原因之一[3],也是医院感染监控的重点。此外,肺部感染不仅增加CSCI患者住院时间,而且还阻碍患者神经功能康复预后[4]。为此,控制肺部感染的发生有利于改善CSCI患者结局。CSCI后肺部感染高发的成因复杂,主要与呼吸肌瘫痪引发肺通气能力差和咳嗽能力减弱,导致肺不张和气道分泌物潴留密切相关。同时研究指出在CSCI人群中还有如完全性性瘫痪、高位脊髓损伤、长期吸烟、长时间卧床以及其他尚未完全明了的独立危险因素[5]。为此,识别CSCI患者肺部感染危险因素将有助于临床制定有效的防治措施,进而降低肺部感染发生率,改善患者预后。
1 资料与方法 1.1 病例资料回顾性队列研究,研究对象为2016年1月—2020年11月某院康复医学科住院治疗的108例CSCI患者(C1~C8脊髓损伤)。根据发病后1个月内是否发生肺部感染,分为肺部感染组和非肺部感染组。
1.1.1 纳入标准① 患者入院后行颈椎正侧位片或颈椎CT和颈椎MRI证实有明确的颈脊髓损伤,且急性脊髓损伤为第一诊断,损伤节段为C1~C8;②处于脊髓损伤后1月内;③致伤原因为交通事故、高处坠落、砸伤等;④年龄18~75岁。
1.1.2 排除标准① 患者脊髓损伤发病时患有上呼吸道感染;②患有先天性胸廓畸形、慢性阻塞性肺疾病、支气管扩张、肺癌、肺结核、硒肺等肺部原发疾病;③患者有艾滋病、白血病、恶性肿瘤等导致免疫障碍的全身性疾病;④患者伴有颅脑外伤,如创伤性蛛网膜下腔出血、创伤性脑出血、硬膜下出血等;⑤严重全身多发损伤患者;⑥病例资料不完整者;⑦既往存在神经肌肉病变;⑧存在精神疾病患者。
1.2 方法 1.2.1 资料收集对患者的医疗记录进行系统回顾,收集患者如下资料:①年龄、性别、受伤形式;②入院24 h内患者血清白蛋白、血红蛋白、血小板、血清钠离子测定值;③入院时患者是否存在肺挫伤、肋骨骨折及创伤性胸腔积液;④既往是否存在吸烟史及糖尿病;⑤是否曾使使用呼吸机辅助通气;⑥患者损伤节段及入院ASIA评分。
1.2.2 诊断标准依据2001年卫生部制定的《医院感染诊断标准(试行)》下呼吸道感染的诊断标准进行肺部感染的诊断[6]。患者出现咳嗽、痰黏稠,肺部出现湿啰音,并有下列情况之一:①发热;②白细胞总数和(或)嗜中性粒细胞比例增高;③X线显示肺部有炎性浸润性改变。排除非感染性原因如肺栓塞、心力衰竭、肺水肿、肺癌等所致的下呼吸道的胸片的改变。出现肺实质炎症(X线显示)者为医院感染肺炎(包括肺脓肿)。
1.3 统计学分析应用SPSS 24.0软件进行统计分析。单因素分析中,分类变量采用卡方检验或Fisher’s精确概率法;符合正态分布的连续性变量采用均值±标准差表示,进行独立样本t检验;如果不服从正态分布,采用中位数(P25, P75)表示,进行两个独立样本的非参数检验。多因素分析采用logistic回归分析,P≤0.05为差异有统计学意义。
2 结果 2.1 CSCI患者肺部感染情况符合纳入标准的CSCI患者共108例,年龄52(43.25~60)岁。其中男性81例,女性27例。108例患者中,55例发生肺部感染,肺部感染发生率为50.9%。
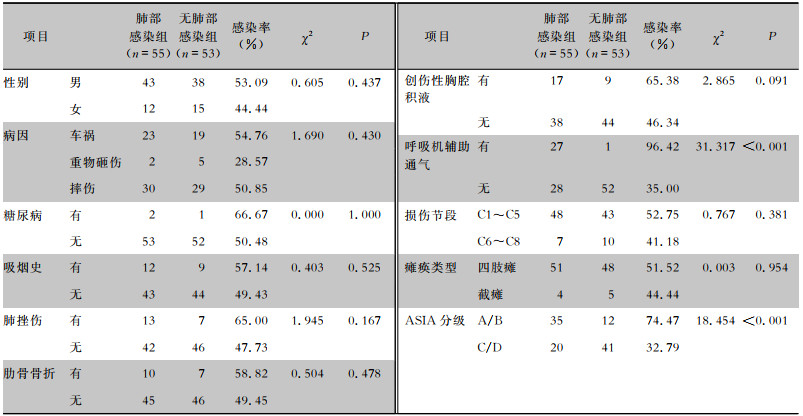
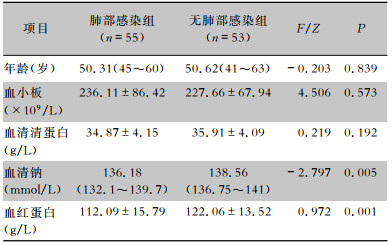
2.2 CSCI患者肺部感染单因素分析单因素分析结果显示,低血红蛋白水平、ASIA分级、低钠血症、呼吸机辅助通气是CSCI患者发生肺部感染的危险因素,差异均有统计学意义(均P<0.05);年龄、性别、吸烟史、糖尿病等比较,差异均无统计意义(均P>0.05)。见表 1、2。
| 表 1 CSCI患者肺部感染影响因素单因素分析(分类变量,例) Table 1 Univariate analysis on influencing factors for PI in patients with CSCI (categorical variable, No. of cases) |
|
| 表 2 CSCI患者肺部感染影响因素单因素分析(连续性变量) Table 2 Univariate analysis on influencing factors for PI in patients with CSCI (continuous variable) |
|
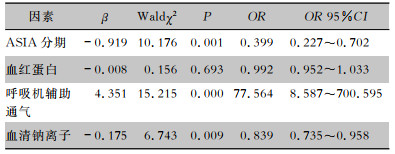
将单因素分析有意义的指标(血红蛋白水平、血清钠离子、ASIA分期、呼吸机辅助通气)纳入logistic回归分析,结果显示ASIA分级(OR=0.399,95%CI:0.227~0.702,P=0.001) 及呼吸机辅助通气(OR=77.564,95%CI:8.587~700.595,P<0.001)、血清钠离子水平(OR=0.839,95%CI:0.735~0.958,P=0.009)具有统计学意义。见表 3。
| 表 3 CSCI患者肺部感染多因素logistic回归分析 Table 3 Multivariate logistic regression analysis on PI in patients with CSCI |
|
肺部感染是CSCI最常见的并发症,据估计在脊髓损伤后的4周内发病率最高,不仅增加患者死亡率,而且可增加压疮等并发症的发病率,延长住院时间和医疗花费,甚至影响患者神经功能恢复[5-9]。除呼吸肌群瘫痪外,目前认为呼吸道失交感神经支配、脊髓损伤后免疫力受损等亦是CSCI后肺部感染的病理生理机制[4, 10],促使肺部感染高发的独立危险因素尚未明确。为此,本研究纳入108例CSCI患者,发现ASIA分级为A或B级、使用呼吸机辅助呼吸及低钠血症是CSCI患者肺部感染的独立危险因素。
ASIA分级是目前国际上评估脊髓神经功能损伤最常用的一个评分量表,分级标准如下,A级:完全性损伤,骶段S4~5无任何运动及感觉功能保留;B级:不完全性损伤,神经平面以下,包括骶段S4~5存在感觉功能,但无任何运动功能;C级:不完全性损伤,神经平面以下有运动功能保留,一半以上的关键肌肌力 < 3级;D级:不完全性损伤,神经平面以下有运动功能保留,一半以上的关键肌肌力≥3级;E级:正常,感觉和运动功能正常。作为衡量脊髓损伤后运动功能的指标之一,ASIA分级A或B级代表损伤平面以下运动功能完全缺失。首先,完全性运动损伤患者的肋肌和腹肌等呼吸肌群瘫痪严重,微小气道趋于闭塞,呼吸模式异常,咳痰能力差,痰液等气道分泌物容易蓄积[11]。其次,完全性运动损伤的CSCI患者气道失交感神经支配较严重导致气道狭窄,痰液排出不易[3]。最后该类患者卧床时间较长,无法自主翻身,气道分泌物容易坠积肺底。研究[3]发现,ASIA分级A级或B级的CSCI患者其肺部感染的发病率远高于不完全性CSCI患者(ASIA分级C或D级)。本研究发现ASIA分级处于A或B级水平是CSCI肺部感染的独立危险因素,与其他文献[3]报道相符。
CSCI患者常因呼吸瘫痪或休克等原因使用呼吸机辅助呼吸,伴随而来的呼吸机相关肺炎始终是医院感染的防治重点。其主要原因是口咽部和上呼吸道定植菌污染,外源性细菌入侵等[12]。研究指出,在脊髓损伤患者中,因呼吸无力、长时间仰卧位及咳嗽无效等,呼吸机相关肺炎发病率更高[13],并且使用呼吸机时间越长,肺部感染发生概率越大[14]。优化呼吸机使用参数及尽早脱机可降低CSCI患者肺炎发生率[15]。
低钠血症亦是CSCI后最常见的并发症之一[2],也是最常见的电解质紊乱类型。具体机制尚未完全明了,目前认为可能与CSCI后抗利尿激素分泌异常增多和肾失交感神经支配后钠离子的重吸收减少相关[16]。低钠血症可导致肺组织水肿和气道水肿,使气道分泌物增多和呼气阻力增大。在CSCI后呼吸肌群瘫痪的情况下,可能促使肺部感染发生。同时低钠血症可导致白细胞等免疫细胞功能受损[17],但是低钠血症和感染是否有直接关联尚不清楚。研究[18]发现,肺部感染患者出院时低钠血症和肺炎复发密切相关。本研究发现低钠血症是CSCI后肺部感染独立危险因素,其具体机制尚需进一步明确。
作为回顾性分析,本研究亦有一定的缺陷。首先,108例患者的样本量太小,小样本单中心分析容易造成结果偏倚;其次,未纳入患者身体质量指数(BMI)、吸烟史的长短及频次、术后常规预防感染的抗菌药物种类和使用天数等指标,相关文献支持肥胖亦是肺部感染的危险因素之一[19]。未分析呼吸功能测定各种参数,由于呼吸功能是当前反映CSCI后呼吸肌瘫痪严重程度的敏感指标之一[20],因此未来亟需展开相关研究。
总之,对于CSCI,应警惕完全性运动损伤、使用呼吸机辅助呼吸以及低钠血症患者肺部感染高发的可能性,尽早采取措施,减少发病率,改善患者预后。
| [1] |
Wang ZM, Zou P, Yang JS, et al. Epidemiological characteri-stics of spinal cord injury in Northwest China: a single hospital-based study[J]. J Orthop Surg Res, 2020, 15(1): 214. DOI:10.1186/s13018-020-01729-z |
| [2] |
Yuan SY, Shi ZJ, Cao FJ, et al. Epidemiological features of spinal cord injury in China: a systematic review[J]. Front Neurol, 2018, 9: 683. DOI:10.3389/fneur.2018.00683 |
| [3] |
Stricsek G, Ghobrial G, Wilson J, et al. Complications in the management of patients with spine trauma[J]. Neurosurg Clin N Am, 2017, 28(1): 147-155. DOI:10.1016/j.nec.2016.08.007 |
| [4] |
Kopp MA, Watzlawick R, Martus P, et al. Long-term functional outcome in patients with acquired infections after acute spinal cord injury[J]. Neurology, 2017, 88(9): 892-900. DOI:10.1212/WNL.0000000000003652 |
| [5] |
Liebscher T, Niedeggen A, Estel B, et al. Airway complications in traumatic lower cervical spinal cord injury: a retrospective study[J]. J Spinal Cord Med, 2015, 38(5): 607-614. DOI:10.1179/2045772314Y.0000000254 |
| [6] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [7] |
Krishnan S, Karg PE, Boninger ML, et al. Association between presence of pneumonia and pressure ulcer formation following traumatic spinal cord injury[J]. J Spinal Cord Med, 2017, 40(4): 415-422. DOI:10.1080/10790268.2016.1180099 |
| [8] |
Conradsson D, Phillips J, Nizeyimana E, et al. Risk indicators of length of acute hospital stay after traumatic spinal cord injury in South Africa: a prospective, population-based study[J]. Spinal Cord, 2019, 57(9): 763-769. DOI:10.1038/s41393-019-0286-0 |
| [9] |
Jaja BNR, Jiang F, Badhiwala JH, et al. Association of pneumonia, wound infection, and sepsis with clinical outcomes after acute traumatic spinal cord injury[J]. J Neurotrauma, 2019, 36(21): 3044-3050. DOI:10.1089/neu.2018.6245 |
| [10] |
Brommer B, Engel O, Kopp MA, et al. Spinal cord injury-induced immune deficiency syndrome enhances infection susceptibility dependent on lesion level[J]. Brain, 2016, 139(Pt 3): 692-707. |
| [11] |
Agostinello J, Battistuzzo CR, Batchelor PE. Early clinical predictors of pneumonia in critically ill spinal cord injured individuals: a retrospective cohort study[J]. Spinal Cord, 2019, 57(1): 41-48. DOI:10.1038/s41393-018-0196-6 |
| [12] |
Rouzé A, Martin-Loeches I, Nseir S. Airway devices in ventilator-associated pneumonia pathogenesis and prevention[J]. Clin Chest Med, 2018, 39(4): 775-783. DOI:10.1016/j.ccm.2018.08.001 |
| [13] |
Younan D, Lin E, Griffin R, et al. Early trauma-induced coa-gulopathy is associated with increased ventilator-associated pneumonia in spinal cord injury patients[J]. Shock, 2016, 45(5): 502-505. DOI:10.1097/SHK.0000000000000531 |
| [14] |
Michetti CP, Prentice HA, Rodriguez J, et al. Supine position and nonmodifiable risk factors for ventilator-associated pneumonia in trauma patients[J]. Am J Surg, 2017, 213(2): 405-412. DOI:10.1016/j.amjsurg.2016.05.019 |
| [15] |
Hatton GE, Mollett PJ, Du RE, et al. High tidal volume ventilation is associated with ventilator-associated pneumonia in acute cervical spinal cord injury[J]. J Spinal Cord Med, 2020, 1-7. DOI:10.1080/10790268.2020.1722936.Epubaheadofprint |
| [16] |
Ohbe H, Koakutsu T, Kushimoto S. Analysis of risk factors for hyponatremia in patients with acute spinal cord injury: a retrospective single-institution study in Japan[J]. Spinal Cord, 2019, 57(3): 240-246. DOI:10.1038/s41393-018-0208-6 |
| [17] |
Portales-Castillo I, Sterns RH. Allostasis and the clinical manifestations of mild to moderate chronic hyponatremia: no good adaptation goes unpunished[J]. Am J Kidney Dis, 2019, 73(3): 391-399. DOI:10.1053/j.ajkd.2018.10.004 |
| [18] |
Potasso L, Sailer CO, Blum CA, et al. Mild to moderate hyponatremia at discharge is associated with increased risk of recurrence in patients with community-acquired pneumonia[J]. Eur J Intern Med, 2020, 75: 44-49. DOI:10.1016/j.ejim.2019.12.009 |
| [19] |
Peters U, Suratt BT, Bates JHT, et al. Beyond BMI: obesity and lung disease[J]. Chest, 2018, 153(3): 702-709. DOI:10.1016/j.chest.2017.07.010 |
| [20] |
Raab AM, Krebs J, Perret C, et al. Maximum inspiratory pressure is a discriminator of pneumonia in individuals with spinal-cord injury[J]. Respir Care, 2016, 61(12): 1636-1643. DOI:10.4187/respcare.04818 |



