鲍曼不动杆菌是一种非发酵、动力阴性、氧化酶阴性的革兰阴性杆菌[1],常引起血液、下呼吸道、泌尿道和伤口等多部位感染[2]。鲍曼不动杆菌感染的危险因素包括机械通气、外科手术、免疫力下降、侵入性操作、重症监护病房(ICU)住院时间、总住院时间的延长以及基础疾病严重等[2]。鲍曼不动杆菌感染患者的病死率高,研究[3]显示鲍曼不动杆菌感染中医院获得性肺炎、呼吸机相关肺炎患者的病死率为28%~68%,鲍曼不动杆菌菌血症患者的病死率为30%~76%[4];而耐药鲍曼不动杆菌感染患者具有更高的病死率[5]。由于鲍曼不动杆菌具有快速获得耐药性和传播耐药性的能力,加上抗菌药物的广泛使用,鲍曼不动杆菌耐药形势愈发严峻,已成为我国乃至世界上相当严重的超级细菌[6-7],被美国感染病协会列为全球6个严重的医院感染多重耐药微生物之一[8]。
近些年由多重耐药革兰阴性杆菌如鲍曼不动杆菌引起的血流感染日益增多,且病死率高。一项来自意大利7个地区的多中心研究[9],纳入281例由多重耐药鲍曼不动杆菌引起的血流感染患者,结果显示血流感染患者14天死亡率高达61.2%,30天死亡率达73.6%,且62.9%患者会发生感染性休克,休克患者的病死率达82.5%。一项荟萃分析[5]显示,耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii,CRAB)感染患者的临床病死率是碳青霉烯类敏感鲍曼不动杆菌(CSAB)感染患者的2倍。长期以来,碳青霉烯类抗生素被认为是鲍曼不动杆菌感染的有效治疗药物之一,但临床上鲍曼不动杆菌对碳青霉烯类的耐药率在全球范围内处于上升趋势[10]。耐药菌的产生不仅增加治疗难度,延长患者的住院时长,影响患者预后,也增加了医务人员的工作量,浪费有限的医疗卫生资源[11]。本研究旨在分析CRAB血流感染的危险因素并分析降钙素原(procalcitonin,PCT)、C反应蛋白(C-reactive protein,CRP)、白细胞(white blood cell,WBC)、中性粒细胞百分比(neutrophil percentage,NEU%)、血小板(platelet,PLT)对患者预后的评估价值,以期为临床耐药鲍曼不动杆菌感染的预防与治疗提供帮助。
1 对象与方法 1.1 研究对象收集某院2013年1月—2020年8月检验科实验室数据库中鲍曼不动杆菌血培养阳性报告的病例,根据患者住院号,通过医院海泰或联众病历系统搜索患者的临床资料,结合纳入标准与排除标准确定最终纳入的研究对象。纳入标准:(1)血培养为鲍曼不动杆菌;(2)符合血流感染的诊断标准[12];(3)年龄>18岁。排除标准:(1)住院期间通过痰、血、尿、脑脊液、脓液、穿刺液、导管尖端等标本培养出其他致病菌;(2)重度烧伤或者确诊恶性肿瘤患者;(3)住院时间<7 d;(4)病历资料不完整者。
1.2 相关定义CRAB指对亚胺培南、美罗培南、厄他培南等任意一种碳青霉烯类抗生素不敏感的鲍曼不动杆菌。预后良好指患者病情好转出院。预后不良指患者病情恶化,自动出院或死亡。
1.3 资料收集本研究为回顾性研究,收集的临床资料如下:入院时资料(性别、年龄、来源、基础疾病);入院后48 h内的炎症指标(包括PCT、CRP、WBC、NEU%、PLT);确诊鲍曼不动杆菌血流感染后48 h内的炎症指标;确诊鲍曼不动杆菌血流感染前抗菌药物的使用情况;患者预后。基础疾病包括高血压病、糖尿病、慢性阻塞性肺疾病(COPD)、冠状动脉粥样硬化性心脏病、慢性肾病。
1.4 病例分组根据鲍曼不动杆菌对碳青霉烯类抗生素的耐药性分为CRAB组与CSAB组;根据患者预后的不同将CRAB组分为预后良好组与预后不良组。
1.5 统计学分析应用SPSS 19.0软件进行统计分析。符合正态分布的计量资料采用x±s表示,采用t检验进行比较;非正态分布计量资料的比较采用秩和检验;计数资料比较采用卡方检验;并通过受试者工作特征曲线(ROC曲线)评估炎症生物标志物对患者预后的预测价值;P≤0.05为差异具有统计学意义。
2 结果 2.1 临床特征共纳入64例鲍曼不动杆菌血流感染患者,包括CRAB组43例与CSAB组21例。单因素分析显示,CRAB组在来源于ICU、使用抗菌药物>2类、使用抗菌药物时间>7 d的比率及WBC、NEU%均高于CSAB组,差异均有统计学意义(均P<0.05);而在高血压患病率、糖尿病患病率、基础疾病种数、预后良好率均低于CSAB组,差异均有统计学意义(均P<0.05)。两组患者的其他临床特征比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 CRAB组与CSAB组患者的临床特征比较 Table 1 Comparison of clinical characteristics between patients in CRAB group and CSAB group |
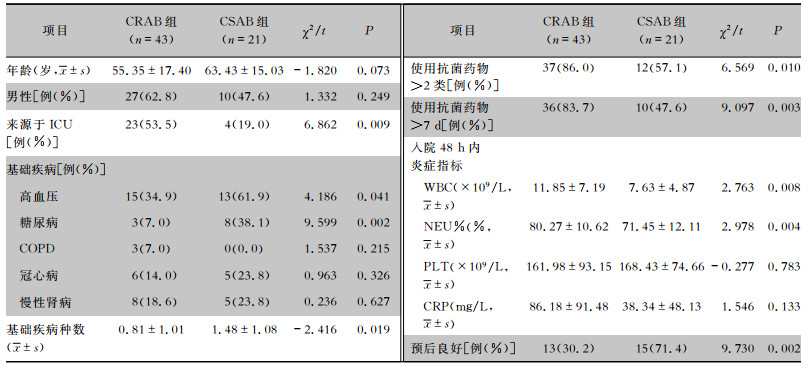
|
CRAB组与CSAB组患者入院48 h内PCT检测情况比较,差异无统计学意义(Z=-0.595,P=0.552),见表 2。
| 表 2 CRAB组与CSAB组入院48 h内PCT比较(例) Table 2 Comparison of PCT between CRAB group and CSAB group within 48 hours after admission(No. of cases) |
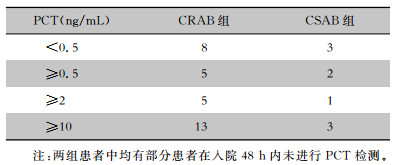
|
结合临床实际,将单因素分析中有统计学差异的危险因素进行二元logistic分析,结果表明,使用抗菌药物>7 d是CRAB血流感染的独立危险因素(P=0.023)。见表 3。
| 表 3 CRAB血流感染危险因素多因素的logistic分析 Table 3 Multivariate logistic analysis on risk factors for CRAB-BSI |
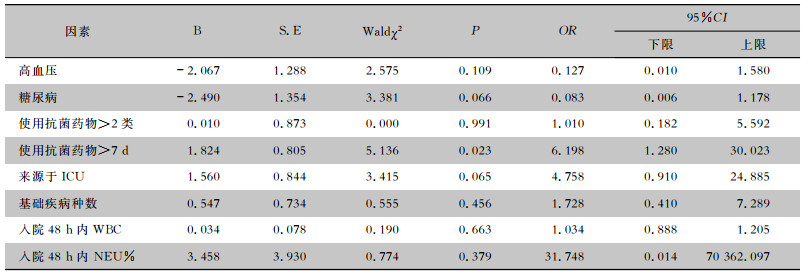
|
43例CRAB血流感染患者中13例预后良好。根据临床预后结果将CRAB血流感染患者分为预后良好组(13例)与预后不良组(30例)。单因素分析显示,两组患者的临床特征比较,差异均无统计学意义(均P>0.05),两组资料具有可比性。见表 4。
| 表 4 CRAB预后良好组与预后不良组的临床特征比较 Table 4 Comparison of clinical characteristics between CRAB patients with good prognosis and poor prognosis |
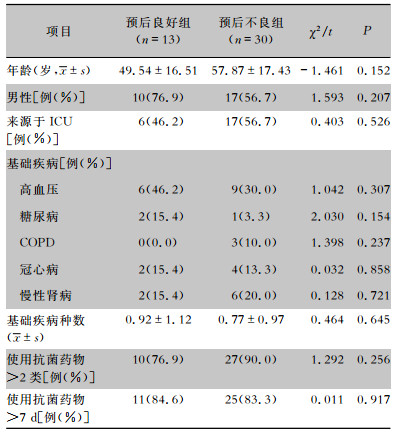
|
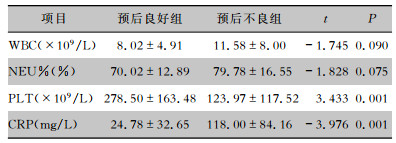
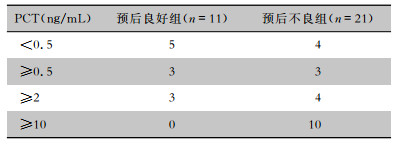
43例CRAB血流感染患者,在确诊48 h内有42例进行了WBC、NEU%、PLT检测,25例进行了CRP检测,32例进行了PCT检测。使用非参数检验对WBC、NEU%、PLT、PCT、CRP进行正态性检验,结果显示除PCT外,其余指标皆符合正态分布。经t检验发现,预后不良组的PLT低于预后良好组,CRP高于预后良好组,差异均有统计学意义(均P<0.05);两组患者的WBC、NEU%比较,差异无统计学意义(均P>0.05)。见表 5。PCT为半定量资料,分为四个等级进行比较,经两独立样本秩和检验分析,预后不良组的PCT水平高于预后良好组,差异有统计学意义(Z=-2.549,P=0.011)。见表 6。
| 表 5 不同预后CRAB血流感染患者确诊48 h内WBC、NEU%、PLT、CRP比较(x±s) Table 5 Comparison of WBC, NEU%, PLT and CRP within 48 hours of diagnosis between CRAB-BSI patients with different prognosis (x±s) |
|
| 表 6 不同预后CRAB血流感染患者确诊48 h内PCT比较(例) Table 6 Comparison of PCT within 48 hours of diagnosis between CRAB-BSI patients with different prognosis |
|
PCT、CRP以及PCT联合CRP评估预测CRAB血流感染患者不良预后的ROC曲线下面积分别为0.829(95%CI:0.658~1.000,P=0.015)、0.800(95%CI:0.610~0.990,P=0.026)、0.895(95%CI:0.751~1.000,P=0.003),而PLT评估预测CRAB血流感染患者不良预后的ROC曲线下面积为0.276(95%CI:0.066~0.486,P=0.098)。见图 1。PCT预测CRAB血流感染不良预后的最佳临界点为2.245、灵敏度60.0%、特异度100.0%、约登指数60.0%,CRP预测CRAB血流感染不良预后的最佳临界点为42.6、灵敏度73.3%、特异度87.5%、约登指数59.0%。
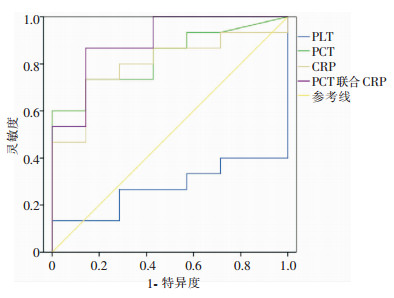 |
| 图 1 PLT、CRP、PCT预测CRAB血流感染患者不良预后的ROC曲线 Figure 1 ROC curve of PLT, CRP and PCT in predicting poor prognosis in patients with CRAB-BSI |
CRAB是引起医院感染的重要致病菌,被世界卫生组织列为急需药物研发应对的关键病原菌之一[13]。本研究以CRAB引起的血流感染患者为研究对象,探讨CRAB血流感染的危险因素。多因素logistic分析表明使用抗菌药物>7 d是CRAB血流感染的独立危险因素。鲍曼不动杆菌具有在恶劣的医疗环境中长期存活的能力,部分菌株经过消毒处理后仍可能存活[14],长期住院会增加患者与之接触的概率,从而导致感染[2];而长时间的抗感染治疗特别是经验性使用碳青霉烯类抗生素易造成鲍曼不动杆菌耐药性的提高[15]。因此,在长时间抗菌治疗中应警惕耐药菌的产生。
此外,预测CRAB血流感染患者的预后对临床治疗有重要指导意义。本研究评估了PCT、PLT、CRP 3个临床常用的炎症生物标志物的价值。PCT是一种由116个氨基酸组成的PCT前体激素,在细菌感染的早期会显著上升[16];CRP也是感染的重要标志物,是炎症急性期时相蛋白,主要由肝细胞合成[17],而PLT除了传统上认为在止血中起中心作用外,还可以直接识别、隔离、杀灭病原体,调节白细胞的行为,已经进化为宿主血管内免疫与炎症的关键调节因子之一[18]。本研究结果显示确诊48 h内的PCT、CRP结果对CRAB血流感染不良预后具有良好预测价值,准确度分别为82.9%、80%,两者联合的诊断准确度达89.5%。当诊治CRAB血流感染时,应尽早检测血清PCT、CRP水平,对患者的预后进行评估,对有不良预后倾向的患者需及早实施干预。
本研究分析CRAB血流感染的危险因素并评估了PCT、CRP对CRAB血流感染患者预后的预测价值,为鲍曼不动杆菌感染的预防与治疗提供依据。但该研究也存在一定的局限性,由于所有病例的收集仅在一所医院进行,无多中心合作,而且样本量不多,因此研究结论的外推受限。
| [1] |
Vázquez-López R, Solano-Gálvez SG, Juárez Vignon-Whaley JJ, et al. Acinetobacter baumannii resistance: a real challenge for clinicians[J]. Antibiotics (Basel), 2020, 9(4): 205. DOI:10.3390/antibiotics9040205 |
| [2] |
Ibrahim ME. Prevalence of Acinetobacter baumannii in Saudi Arabia: risk factors, antimicrobial resistance patterns and mechanisms of carbapenem resistance[J]. Ann Clin Microbiol Antimicrob, 2019, 18(1): 1. DOI:10.1186/s12941-018-0301-x |
| [3] |
Mohd Sazlly Lim S, Zainal Abidin A, Liew SM, et al. The global prevalence of multidrug-resistance among Acinetobacter baumannii causing hospital-acquired and ventilator-associated pneumonia and its associated mortality: a systematic review and Meta-analysis[J]. J Infect, 2019, 79(6): 593-600. DOI:10.1016/j.jinf.2019.09.012 |
| [4] |
Ballouz T, Aridi J, Afif C, et al. Risk factors, clinical presentation, and outcome of Acinetobacter baumannii bacteremia[J]. Front Cell Infect Microbiol, 2017, 7: 156. DOI:10.3389/fcimb.2017.00156 |
| [5] |
Butler DA, Biagi M, Tan X, et al. Multidrug resistant Acinetobacter baumannii: resistance by any other Name would still be hard to treat[J]. Curr Infect Dis Rep, 2019, 21(12): 46. DOI:10.1007/s11908-019-0706-5 |
| [6] |
Ayoub Moubareck C, Hammoudi Halat D. Insights into Acine-tobacter baumannii: a review of microbiological, virulence, and resistance traits in a threatening nosocomial pathogen[J]. Antibiotics (Basel), 2020, 9(3): 119. DOI:10.3390/antibiotics9030119 |
| [7] |
Lee CR, Lee JH, Park M, et al. Biology of Acinetobacter baumannii: pathogenesis, antibiotic resistance mechanisms, and prospective treatment options[J]. Front Cell Infect Microbiol, 2017, 7: 55. |
| [8] |
van Dessel H, Dijkshoorn L, van der Reijden T, et al. Identification of a new geographically widespread multiresistant Acinetobacter baumannii clone from European hospitals[J]. Res Microbiol, 2004, 155(2): 105-112. DOI:10.1016/j.resmic.2003.10.003 |
| [9] |
Russo A, Bassetti M, Ceccarelli G, et al. Bloodstream infections caused by carbapenem-resistant Acinetobacter baumannii: clinical features, therapy and outcome from a multicenter study[J]. J Infect, 2019, 79(2): 130-138. DOI:10.1016/j.jinf.2019.05.017 |
| [10] |
Nowak P, Paluchowska P. Acinetobacter baumannii: biology and drug resistance-role of carbapenemases[J]. Folia Histochem Cytobiol, 2016, 54(2): 61-74. |
| [11] |
吴晓英, 丁丽娜, 吴修建. 多重耐药鲍曼不动杆菌医院感染的直接经济损失研究[J]. 中国感染控制杂志, 2018, 17(8): 735-738. DOI:10.3969/j.issn.1671-9638.2018.08.017 |
| [12] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [13] |
Brink AJ. Epidemiology of carbapenem-resistant Gram-negative infections globally[J]. Curr Opin Infect Dis, 2019, 32(6): 609-616. DOI:10.1097/QCO.0000000000000608 |
| [14] |
Bravo Z, Orruño M, Navascues T, et al. Analysis of Acinetobacter baumannii survival in liquid media and on solid matrices as well as effect of disinfectants[J]. J Hosp Infect, 2019, 103(1): e42-e52. DOI:10.1016/j.jhin.2019.04.009 |
| [15] |
张建武, 沈平华, 郭清莲. 耐碳青霉烯类鲍曼不动杆菌的临床危险因素[J]. 武汉大学学报(医学版), 2017, 38(5): 775-779. |
| [16] |
Karakioulaki M, Stolz D. Biomarkers in pneumonia-beyond procalcitonin[J]. Int J Mol Sci, 2019, 20(8): 2004. DOI:10.3390/ijms20082004 |
| [17] |
Sproston NR, Ashworth JJ. Role of C-reactive protein at sites of inflammation and infection[J]. Front Immunol, 2018, 9: 754. DOI:10.3389/fimmu.2018.00754 |
| [18] |
Vardon-Bounes F, Ruiz S, Gratacap MP, et al. Platelets are critical key players in sepsis[J]. Int J Mol Sci, 2019, 20(14): 3494. DOI:10.3390/ijms20143494 |



