2. 福建医科大学附属第一医院检验科, 福建 福州 350005
2. Department of Laboratory Medicine, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
人工关节感染(prosthetic joint infection, PJI)是关节置换术后严重并发症[1],常需要多次清创手术及长疗程的抗菌药物治疗。而不恰当的治疗最终可能会导致患者截肢,甚至死亡,给患者带来巨大的身心痛苦, 同时也给社会带来巨大的经济负担[2],因此, 提高PJI的诊断及治疗迫在眉睫。
尽管初次关节置换术后PJI的发生率仅为1%~3%[3-4],但随着人工关节置换术数量的日益增加,PJI数量也增多,且出现了罕见菌引起的PJI,需引起骨科医生的高度重视。本文就我院收治的一例罕见嗜沫凝聚杆菌(Aggregatibactet aphrophilus)引起的PJI病例进行报告及文献复述。
1 病历资料 1.1 病史患者女性,70岁,18年前因严重的骨性关节炎于外院行右侧全髋关节置换术,术后情况良好。入院前20 d开始出现右髋关节肿胀、剧烈疼痛。无发热、畏冷、寒战。既往无外伤史,2个月前有拔牙史,拔牙后无抗菌药物使用史。
1.2 体格及实验室检查结果入院后查体:髋关节活动度欠佳,Harris评分为50分。血清炎性指标C反应蛋白(CRP): 116 mg/L(正常值为5 mg/L);红细胞沉降率(ESR): 109 mm/h(正常值为20 mm/h);白细胞计数(WBC):6.35×109/L。全身同位素骨扫描显示右侧髋臼周围摄取增高,X线片可见假体周围骨溶解。术前彩色多普勒超声见关节内存在积液,遂在无菌条件下进行穿刺。关节液常规:关节液白细胞计数(SF-WBC): 73.83×109/L, 关节液多核细胞百分比(SF-PMN%): 89.9%。穿刺液宏基因组二代测序(mNGS)检测,48 h后结果回报为嗜沫凝聚杆菌,穿刺液培养7 d仍未见病原菌生长。见图 1、2。
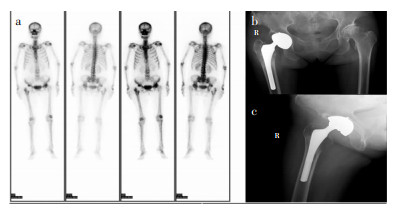 |
| 注:a为全身同位素骨扫描显像;b为双髋关节X线正位片;c为右髋关节X线侧位片。 图 1 患者影像检查及关节穿刺液mNGS检测结果 Figure 1 Imaging examination and joint puncture fluid mNGS detection results of patient |
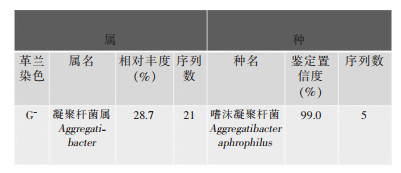 |
| 图 2 患者关节穿刺液宏基因组二代测序结果 Figure 2 Metagenomic next-generation sequencing result of joint puncture fluid of patient |
初步考虑右髋PJI,采用二期翻修治疗。术中将假体取出,植入骨水泥间隔器。术中可见大量脓性液体,SF-WBC: 66.42×109/L,SF-PMN%: 86.2%,术中冰冻结果为阳性(>5个中性粒细胞/高倍视野)。术中取假体周围多份组织、关节液进行培养,并将假体进行超声裂解后接种于培养瓶。根据术前mNGS结果同时进行需氧、厌氧和5% CO2培养,并将培养时间延长至14 d。此外,还使用16S聚合酶链反应(PCR)对细菌进行鉴定。最终在术后14 d培养出嗜沫凝聚杆菌,16S PCR结果亦为嗜沫凝聚杆菌。根据其药敏结果,静脉使用美罗培南2周,1周后CRP、ESR均将至正常值范围。出院后口服阿莫西林/克拉维酸钾4周。
术后3个月,患者再次入院行假体植入。术前查炎性指标正常,术中关节液常规SF-WBC及SF-PMN%均正常,考虑感染控制,遂将骨水泥间隔器取出,彻底清创后重新植入假体,术后静脉使用敏感抗菌药物治疗2周。末次随访时(术后6个月)血清炎性指标均正常,影像学检查无感染及松动征象,Harris评分80分。
2 文献复习嗜沫凝聚杆菌定植于人体口腔组织中,肌肉骨骼系统的感染可继发于口腔操作及口腔感染,感染后可出现发热、疼痛、肿胀等急性炎症反应。而嗜沫凝聚杆菌肌肉骨骼系统的感染治疗并不复杂,大部分患者在明确病原菌后,选择头孢曲松或环丙沙星治疗后均可治愈,而无需进行外科清创。见表 1。
| 表 1 肌肉骨骼系统嗜沫凝聚杆菌感染性疾病的临床特点 Table 1 Clinical characteristics of musculoskeletal infectious disease caused by A. aphrophilus |
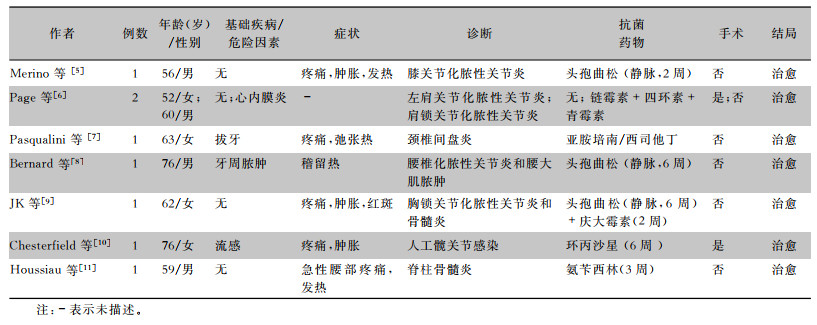
|
PJI是关节置换术后灾难性的并发症, 虽然其发生率并不高,但随着接受关节置换手术患者数量的不断增加,PJI病例数也在显著增加,同时PJI的病原菌谱也随之扩大,出现了越来越多的罕见菌感染引起的PJI[12-13],因此,骨科医生尤其是关节外科医生需特别重视,在PJI的诊疗过程中需采取各种手段积极寻找致病菌,尤其是苛养菌。
微生物培养目前仍认为是PJI诊断的“金标准”,不仅可以提供病原学证据,还可以为抗菌药物的选择提供依据。然而,目前PJI的微生物培养阳性率并不高,特别是诸如痤疮丙酸杆菌、嗜沫凝聚杆菌等苛养菌[14]。包括mNGS在内的分子诊断技术近年来在诊断病原菌方面展现出了其独特的优越性,特别是对苛养菌的诊断[15-16]。但这些分子诊断方法目前并不是诊断PJI的“金标准”,且均存在局限性,即无法获得病原菌的抗菌药物敏感性信息,不能指导临床抗感染治疗,但根据这些结果优化培养条件,可提高苛养菌的检出率并进行药敏检测。本病例中,即根据术前穿刺液mNGS结果判断可能的病原菌,并根据病原菌的生长特点优化术中标本的培养方法,最终培养出嗜沫凝聚杆菌。因此,mNGS结果可用于指导微生物培养,特别是一些苛养菌的培养,可提高标本培养阳性率。
嗜沫凝聚杆菌是一种体积较小的革兰阴性菌,为苛养菌,是HACEK(Haemophilus, Actinobacillus, Cardiobacterium, Eikenella, Kingella)家族中的一员,定植于正常人口腔组织内。1940年首次在心内膜炎中发现嗜沫凝聚杆菌,而在嗜沫凝聚杆菌引起的感染性疾病中,心内膜炎占半数以上[17]。此外,嗜沫凝聚杆菌亦常见于脑脓肿以及肝脓肿[18-19],肌肉骨骼系统感染较为少见,仅见于个案报道[5-11]。由于嗜沫凝聚杆菌存在于口腔组织中,口腔侵入性操作及口腔脓肿是导致其他部位嗜沫凝聚杆菌感染的危险因素。其引起的肌肉骨骼系统感染主要症状包括疼痛、肿胀,部分患者还可存在发热。根据药敏选择敏感抗菌药物治疗2~6周后,大部分患者均可治愈, 因此病原学证据的寻找在嗜沫凝聚杆菌肌肉骨骼系统感染的治疗中至关重要。
嗜沫凝聚杆菌感染在PJI中较为罕见,所占比率<4%[20]。Chesterfield等[10]于2008年首次在PJI中报道了嗜沫凝聚杆菌感染,但在首次接诊时,并未检出该致病菌,因此导致患者漏诊,患者在第3次入院时才被诊断,增加了患者的痛苦和医疗费用。查阅文献确定本研究为第二例关于人工髋关节置换术(THA)术后嗜沫凝聚杆菌感染的病例报告,而本病例在术前使用了mNGS检测病原菌,并根据mNGS结果对培养方法进行优化,成功获得了病原学依据及药敏信息,并且经过人工髋关节二期翻修联合抗菌药物治疗后,成功治愈。因此,对于近期有口腔操作史的关节置换术后患者,如果出现关节肿胀、疼痛、发热,应考虑嗜沫凝聚杆菌感染的可能,进行微生物培养时应同时进行需氧、厌氧和5% CO2培养,并延长培养时间。mNGS可用于术前病原菌的检测,并可根据检测结果针对不同病原菌的生长特点优化培养条件,提高培养的阳性率,因此,在有条件情况下应进行术前关节液mNGS检测。明确病原菌后,选择二期翻修术并根据药敏结果选择敏感抗菌药物进行治疗,可获得较好的疗效。
综上所述,对于关节置换术后嗜沫凝聚杆菌感染引起PJI,其病原学诊断存在困难,对于有口腔操作史的患者,应考虑其感染的可能,可以采用mNGS等分子诊断方法查找病原菌。病原菌的确定是治疗嗜沫凝聚杆菌感染性PJI的关键,一旦获取病原学证据,经二期翻修及敏感抗菌药物治疗后PJI可治愈。
| [1] |
Ricciardi BF, Muthukrishnan G, Masters EA, et al. New developments and future challenges in prevention, diagnosis, and treatment of prosthetic joint infection[J]. J Orthop Res, 2020, 38(7): 1423-1435. DOI:10.1002/jor.24595 |
| [2] |
Alp E, Cevahir F, Ersoy S, et al. Incidence and economic burden of prosthetic joint infections in a university hospital: a report from a middle-income country[J]. J Infect Public Health, 2016, 9(4): 494-498. DOI:10.1016/j.jiph.2015.12.014 |
| [3] |
Jämsen E, Varonen M, Huhtala H, et al. Incidence of prosthetic joint infections after primary knee arthroplasty[J]. J Arthroplasty, 2010, 25(1): 87-92. DOI:10.1016/j.arth.2008.10.013 |
| [4] |
Tayton ER, Frampton C, Hooper GJ, et al. The impact of patient and surgical factors on the rate of infection after primary total knee arthroplasty: an analysis of 64, 566 joints from the New Zealand Joint Registry[J]. Bone Joint J, 2016, 98: 334-340. |
| [5] |
Merino D, Saavedra J, Pujol E, et al. Haemophilus aphrophilus as a rare cause of arthritis[J]. Clin Infect Dis, 1994, 19(2): 320-322. DOI:10.1093/clinids/19.2.320 |
| [6] |
Page MI, King EO. Infection due to Actinobacillus actinomy-cetemcomitans and Haemophilus aphrophilus[J]. N Engl J Med, 1966, 275(4): 181-188. DOI:10.1056/NEJM196607282750403 |
| [7] |
Pasqualini L, Mencacci A, Scarponi AM, et al. Cervical spondylodiscitis with spinal epidural abscess caused by Aggregatibacter aphrophilus[J]. J Med Microbiol, 2008, 57(Pt 5): 652-655. |
| [8] |
Bernard F, Rossi P, Lagier JC, et al. Lumbar septic arthritis and psoas abscess due to Aggregatibacter aphrophilus[J]. BMJ Case Rep, 2011, 2011: bcr0820103215. |
| [9] |
JK LOH, D O'Shea, K O'Connell, et al. Sternoclavicular joint septic arthritis and osteomyelitis caused by Aggregatibacter aphrophilus[J]. Q J Med, 2014, 107: 751-754. DOI:10.1093/qjmed/hcr272 |
| [10] |
Chesterfield H, Abdolali A, Pallett A, et al. Prosthetic joint infection due to Haemophilus aphrophilus[J]. Prof Med J, 2008, 15: 533-536. |
| [11] |
Houssiau FA, Huaux JP, Nagant de Deuxchaisnes C. Haemophilus aphrophilus: a rare pathogen in vertebral osteomyelitis[J]. Ann Rheum Dis, 1987, 46(3): 248-250. DOI:10.1136/ard.46.3.248 |
| [12] |
Huang Z, Zhang C, Li W, et al. Metagenomic next-generation sequencing contribution in identifying prosthetic joint infection due to Parvimonas micra: a case report[J]. J Bone Jt Infect, 2019, 4(1): 50-55. DOI:10.7150/jbji.30615 |
| [13] |
Manning L, Metcalf S, Clark B, et al. Clinical characteristics, etiology, and initial management strategy of newly diagnosed periprosthetic joint infection: a multicenter, prospective observational cohort study of 783 patients[J]. Open Forum Infect Dis, 2020, 7(5): ofaa068. DOI:10.1093/ofid/ofaa068 |
| [14] |
Berbari EF, Marculescu C, Sia I, et al. Culture-negative prosthetic joint infection[J]. Clin Infect Dis, 2007, 45(9): 1113-1119. DOI:10.1086/522184 |
| [15] |
Ivy MI, Thoendel MJ, Jeraldo PR, et al. Direct detection and identification of prosthetic joint infection pathogens in synovial fluid by metagenomic shotgun sequencing[J]. J Clin Microbiol, 2018, 56(9): e00402-e00418. |
| [16] |
Street TL, Sanderson ND, Atkins BL, et al. Molecular diagnosis of orthopedic-device-related infection directly from sonication fluid by metagenomic sequencing[J]. J Clin Microbiol, 2017, 55(8): 2334-2347. DOI:10.1128/JCM.00462-17 |
| [17] |
Brouqui P, Raoult D. Endocarditis due to rare and fastidious bacteria[J]. Clin Microbiol Rev, 2001, 14(1): 177-207. DOI:10.1128/CMR.14.1.177-207.2001 |
| [18] |
Tsui K, Tsai CR, Lin LC, et al. Aggregatibacter aphrophilus pyogenic liver abscess in an immunocompetent young woman[J]. J Microbiol Immunol Infect, 2012, 45(5): 385-389. DOI:10.1016/j.jmii.2011.12.004 |
| [19] |
Maraki S, Papadakis IS, Chronakis E, et al. Aggregatibacter aphrophilus brain abscess secondary to primary tooth extraction: case report and literature review[J]. J Microbiol Immunol Infect, 2016, 49(1): 119-122. DOI:10.1016/j.jmii.2013.12.007 |
| [20] |
Flurin L, Greenwood-Quaintance KE, Patel R. Microbiology of polymicrobial prosthetic joint infection[J]. Diagn Microbiol Infect Dis, 2019, 94(3): 255-259. DOI:10.1016/j.diagmicrobio.2019.01.006 |



