2. 同济大学附属上海市第四人民医院感控管理办公室, 上海 200434
2. Office of Healthcare-associated Infection Management, Shanghai Fourth People's Hospital Affiliated to Tongji University School of Medicine, Shanghai 200434, China
体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)作为一种体外生命支持技术,应用于危急重症心肺衰竭患者,维持体外呼吸与循环,并为原发病的治疗及心肺功能恢复争取时间[1-2]。随着ECMO技术的不断进步及应用,民众的接受度也逐渐提高[3],并在新型冠状病毒感染导致的急性呼吸窘迫综合征(ARDS)患者的心肺功能恢复中发挥了重要的作用[4]。然而,ECMO支持治疗中并发症的发生率可达75.8%[5], 出血、肾衰竭及感染是ECMO术后常见并发症,其中ECMO术后医院感染作为其并发症之一,显著增加患者病死率[6]。本文对某院2013年1月—2019年12月接受过ECMO支持治疗的163例患者进行医院感染危险因素分析,以期为减少ECMO术后相关医院感染提供参考依据。
1 对象与方法 1.1 研究对象选取某大型三甲医院2013年1月—2019年12月接受ECMO支持治疗的患者, ECMO术后相关医院感染定义为ECMO开始后24 h至结束后48 h内发生的医院感染[7],并参照卫生部2001年颁布的《医院感染诊断标准(试行)》进行医院感染诊断,根据ECMO术后是否发生医院感染分为感染组和非感染组。
1.2 研究方法采用回顾性调查方法,通过医院信息系统提取并整理感染组及非感染组患者的性别、年龄、医院感染发病率、医院感染例次发病率、住院日数、抗菌药物使用日数、是否联合用药、使用呼吸机日数、中心静脉置管日数及导尿管置管日数等资料,对感染组及非感染组进行非线性回归分析。细菌鉴定采用Vitek 2 Compact全自动细菌鉴定仪(法国生物梅里埃公司)或API鉴定系统(法国生物梅里埃公司)。质控菌株大肠埃希菌(ATCC 25922)、肺炎克雷伯菌(ATCC 700603)、金黄色葡萄球菌(ATCC 25923)、鲍曼不动杆菌(ATCC 19606)、铜绿假单胞菌(ATCC 278553)和阴沟肠杆菌(ATCC 700323), 购自国家卫生计生委临床检验中心。
1.3 统计分析应用SPSS 26.0软件整理录入资料并对相关数据进行分析。计数资料采用构成比(%)描述,组间比较采用卡方检验。计量资料以(x±s)或M(P25~P75)描述,组间比较采用两独立样本非参数检验。单因素分析得出ECMO术后医院感染差异具有统计学意义的因素,再使用二元logistic回归分析ECMO术后感染的独立危险因素。以P ≤ 0.05为差异有统计学意义。
2 结果 2.1 一般情况共收集163例ECMO支持治疗患者的病历资料,其中男性100例(61.35%),女性63例(38.65%);发生术后医院感染39例、64例次,医院感染发病率为23.93%,例次发病率为39.26%。
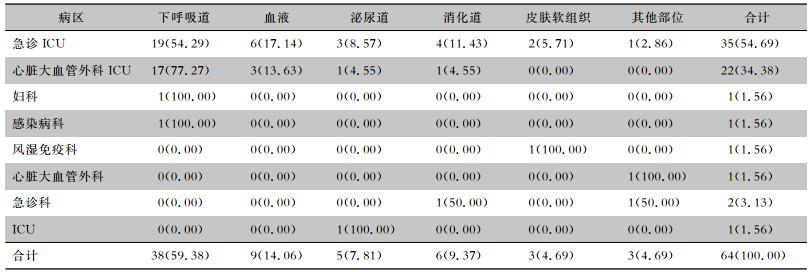
2.2 ECMO术后医院感染情况ECMO术后医院感染发病率最高的科室是急诊重症监护病房(ICU,54.69%),其次为心脏大血管外科ICU (34.38%)、急诊科(3.13%)。ECMO术后医院感染以下呼吸道感染(59.38%)为主,主要为呼吸机相关肺炎;其次是血流感染(14.06%),主要为导管相关血流感染及继发性败血症;再次为消化系统感染(9.37%)、泌尿系统感染(7.81%)。不同病区ECMO术后医院感染部位分布情况见表 1。
| 表 1 不同病区ECMO术后医院感染部位分布情况[例次(%)] Table 1 Distribution of HAI sites after ECMO in different wards(No. of cases[%]) |
|
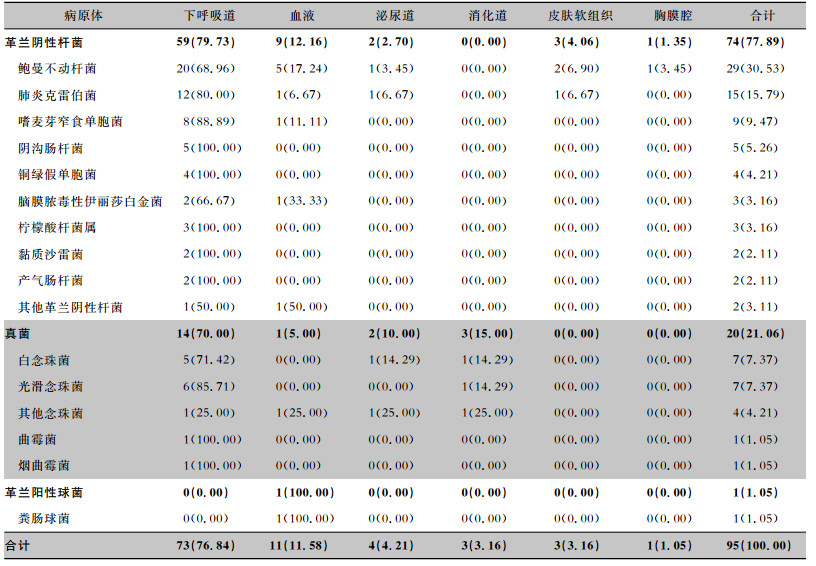
39例ECMO术后感染患者送检标本,共检出病原体95株,其中革兰阴性杆菌74株(77.89%),主要为鲍曼不动杆菌、肺炎克雷伯菌及嗜麦芽窄食单胞菌;真菌20株(21.06%),主要为白念珠菌、光滑念珠菌;革兰阳性球菌1株(1.05%),为屎肠球菌。主要分离自痰标本(73株,76.84%),以鲍曼不动杆菌、肺炎克雷伯菌为主;其次为血标本(11株,11.58%),主要以鲍曼不动杆菌为主。见表 2。感染组39例患者中,29例检出多重耐药菌,占74.36%;检出多重耐药菌50株,占检出病原菌52.63%。
| 表 2 ECMO术后感染患者各感染部位病原体检出情况[株(%)] Table 2 Isolation of pathogens from different infection sites in patients with HAI after ECMO (No. of isolates[%]) |
|
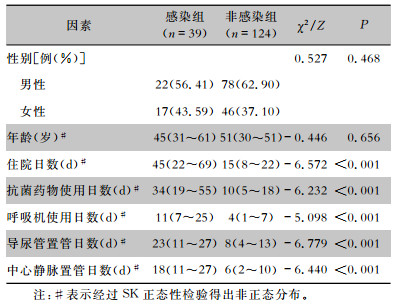
163例接受ECMO支持治疗的患者,39例ECMO术后发生医院感染(感染组),124例ECMO术后未发生医院感染(非感染组)。经单因素分析,感染组与非感染组患者相比,除性别、年龄外,住院日数、抗菌药物使用日数、呼吸机使用日数、导尿管置管日数及中心静脉置管日数两组差异均有统计学意义(均P < 0.001)。基于以上单因素分析筛查获得的影响因素,进行多因素分析未获得独立危险因素。见表 3。
| 表 3 ECMO术后医院感染危险因素分析 Table 3 Risk factors for HAI after ECMO |
|
近年来,随着ECMO技术在我国的逐步开展,ECMO理论、技术及实践均在不断成熟。目前有较多综合性医院开展了ECMO技术, 但由于各种因素限制, 导致对其并发症的预防和处理策略尚缺乏经验[8]。危急重症心肺功能衰竭的患者在ECMO支持治疗期间,细菌感染会延长ECMO及机械通气的时间,增加并发症的概率,从而影响ECMO患者预后及病死率[9]。因此,了解ECMO术后医院感染情况,预防其医院感染的发生至关重要。本文调查了163例ECMO支持治疗患者的临床资料,发现医院感染39例,发病率为23.93%。与之前文献报道的ECMO支持治疗期间感染发病率为20.5%~35.0%[10-11]一致,低于王静等[12]的研究结果(医院感染发病率为40.62%)。
本研究中,ECMO术后医院感染部位主要以下呼吸道为主,与文献[12-15]报道结果一致。也有其他研究[16-17]显示,ECMO支持治疗的患者中,术后医院感染以血流感染为主,其次是呼吸系统感染、泌尿系统感染。可能与研究纳入的人群及预防感染策略不同有关。呼吸机的使用及气管插管或切开,使机体防御机制受到了破坏,气体可直接进入下呼吸道,容易导致下呼吸道感染,因此,需要及时评估患者病情,尽早拔除插管。本研究中,39例ECMO术后医院感染患者共检出病原菌95株,革兰阴性杆菌占77.89%,以鲍曼不动杆菌、肺炎克雷伯菌居多,与王静等[12]研究的结果一致,鲍曼不动杆菌为医院感染常见病原菌,具有天然耐药性且易发生耐药变迁。及时了解患者医院感染病原菌的分布及耐药情况,合理使用抗菌药物,有利于疾病的治疗及控制。但本研究检出的病原体中,革兰阳性球菌仅占1.05%,与其他相关研究存在差异,可能与疾病状态及支持治疗前后预防性使用抗菌药物不同有关。
本研究显示,感染组抗菌药物使用日数、呼吸机、导尿管及中心静脉置管的使用日数明显高于非感染组。在ECMO支持治疗期间,会有较多的有创侵入性操作,如静脉置管、气管插管、导尿管留置等,这些均为易感高危因素。ECMO支持患者多因处在高应激状态,极易导致全身炎症反应,使免疫力降低,易发生医院感染。随着置管日数延长,滋生细菌繁殖,病原菌数量增加,导致医院感染的发生,特别是下呼吸道感染发病率明显增加。本研究因纳入因素未获得独立危险因素,需在后续进一步对ECMO术后医院感染进行相关危险因素研究,以获得证据学更高的结果。
综上所述,ECMO术后医院感染与住院日数、抗菌药物使用日数、使用呼吸机日数、导尿管置管日数及中心静脉置管日数相关,应严格执行无菌操作, 规范日常维护, 合理使用抗菌药物,及时评估患者病情,尽早拔除导管,以减少相关医院感染的发生。同时,本研究存在一定的局限性。首先,本研究为单中心回顾性研究,后续期待多中心进行研究,以获得证据学更高的结果。其次,本研究纳入的危险因素较少,需在后续加入基础疾病、ECOM使用日数、ICU入住情况、患者疾病结局、实验室指标等更多影响因素,进一步明确ECMO术后医院感染相关危险因素。
| [1] |
Wang GN, Chen XF, Qiao L, et al. Comparison of extracorporeal and conventional cardiopulmonary resuscitation: a Meta-analysis of 2260 patients with cardiac arrest[J]. World J Emerg Med, 2017, 8(1): 5-11. DOI:10.5847/wjem.j.1920-8642.2017.01.001 |
| [2] |
Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults[J]. N Engl J Med, 2011, 365(20): 1905-1914. DOI:10.1056/NEJMct1103720 |
| [3] |
Firstenberg MS, Stahel PF, Hanna J, et al. Successful COVID-19 rescue therapy by extra-corporeal membrane oxygenation (ECMO) for respiratory failure: a case report[J]. Patient Saf Surg, 2020, 14: 20. DOI:10.1186/s13037-020-00245-7 |
| [4] |
宋美君, 许兆军, 陈碧新, 等. ECMO治疗甲型H1N1流感病毒感染致ARDS的临床研究[J]. 中华医院感染学杂志, 2019, 29(4): 485-488. |
| [5] |
高国栋, 黑飞龙, 吉冰洋, 等. 128例成人体外膜肺氧合支持治疗患者相关并发症回顾分析[J]. 中国分子心脏病学杂志, 2015, 15(1): 1197-1201. |
| [6] |
Zangrillo A, Landoni G, Biondi-Zoccai G, et al. A Meta-analysis of complications and mortality of extracorporeal membrane oxygenation[J]. Crit Care Resusc, 2013, 15(3): 172-178. |
| [7] |
Hsu MS, Chiu KM, Huang YT, et al. Risk factors for nosocomial infection during extracorporeal membrane oxygenation[J]. J Hosp Infect, 2009, 73(3): 210-216. DOI:10.1016/j.jhin.2009.07.016 |
| [8] |
章晓华, 庄建. 中国体外膜肺氧合技术开展的现状及思考[J]. 中国体外循环杂志, 2017, 15(2): 68-71, 91. |
| [9] |
Bull T, Corley A, Smyth DJ, et al. Extracorporeal membrane oxygenation line-associated complications: in vitro testing of cyanoacrylate tissue adhesive and securement devices to prevent infection and dislodgement[J]. Intensive Care Med Exp, 2018, 6(1): 6. DOI:10.1186/s40635-018-0171-8 |
| [10] |
周晔, 李呈龙, 王晓存, 等. 体外膜肺氧合辅助患者医院感染病原菌分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(22): 5097-5099. |
| [11] |
周宁, 鲍玫, 王振全. 体外膜肺氧合支持治疗应用及并发症防范研究进展[J]. 临床误诊误治, 2018, 31(4): 106-111. DOI:10.3969/j.issn.1002-3429.2018.04.030 |
| [12] |
王静, 熊莹, 施颖, 等. 成人心脏术后患者体外膜肺氧合治疗相关医院感染的危险因素及病原学分析[J]. 中华临床感染病杂志, 2019, 12(1): 38-43. DOI:10.3760/cma.j.issn.1674-2397.2019.01.006 |
| [13] |
曾伟英, 萧帼穗, 钟振锋, 等. 体外膜肺氧合术后患者医院感染危险因素分析[J]. 中国感染控制杂志, 2014, 13(4): 212-214. |
| [14] |
孙各琴, 李斌飞, 叶子, 等. 体外膜肺氧合支持治疗患者的感染危险因素分析[J]. 中华胸部外科电子杂志, 2016, 3(4): 209-215. |
| [15] |
廖小卒, 李斌飞, 孙各琴, 等. 体外膜肺氧合应用于心脏手术后支持治疗的医院感染分析[J]. 岭南心血管病杂志, 2018, 24(2): 165-168. DOI:10.3969/j.issn.1007-9688.2018.02.11 |
| [16] |
Bizzarro MJ, Conrad SA, Kaufman DA, et al. Infections acquired during extracorporeal membrane oxygenation in neonates, children, and adults[J]. Pediatr Crit Care Med, 2011, 12(3): 277-281. DOI:10.1097/PCC.0b013e3181e28894 |
| [17] |
Sun HY, Ko WJ, Tsai PR, et al. Infections occurring during extracorporeal membrane oxygenation use in adult patients[J]. J Thorac Cardiovasc Surg, 2010, 140(5): 1125-1132. DOI:10.1016/j.jtcvs.2010.07.017 |



