2019年12月在武汉首次被报道并流行至今的新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)无疑成了世界难题,新型冠状病毒感染的患者是疾病的主要传染源,无症状携带者也可以传播疾病[1],这无疑使新型冠状病毒感染的控制变得更加棘手。根据已有报告显示,在感染新型冠状病毒的人群中,有30%~50%的患者携带1种及以上的合并症。其中,糖尿病是COVID-19患者最常见的合并症之一[2]。COVID-19患者合并糖尿病的比率为8.0%~20.0%,其中,危重症患者合并糖尿病的比例更高[3-4]。众所周知,糖尿病患者由于自身的免疫稳态失衡,容易导致各种感染的发生,是许多疾病的危险因素。糖尿病与中东呼吸综合征患者的不良预后显著相关[5],在感染甲型H1N1流感后,合并糖尿病的患者住院后进入ICU的风险增加了4倍[6],另外,糖尿病还是严重急性呼吸综合征(SARS)患者死亡和发病的独立预测因子[7]。同样,在H7N9及社区获得性肺炎患者的相关研究中也得出类似结论[8-9]。合并糖尿病的患者基础情况较健康人群差,对疾病的抵抗力较低,容易促进疾病的进展。为了确定糖尿病是否是影响COVID-19疾病进展和预后的危险因素,本文对浙江省2020年1月17日—2月7日确诊为COVID-19的糖尿病患者的临床数据及流行病学特征进行回顾性分析。
1 对象与方法 1.1 研究对象回顾性分析2020年1月17日—2月7日浙江省确诊为新型冠状病毒肺炎的856例住院患者的临床及流行病学资料,其中64例合并糖尿病,792例未合并糖尿病。
1.2 诊断标准及分型所有患者均至少1次呼吸道标本(痰液或咽拭子)实时荧光RT-PCR检测2019-nCoV核酸阳性,COVID-19患者的诊断标准及临床分型参照《新型冠状病毒肺炎的诊断及治疗方案(第6版)》[10]。轻型:临床症状轻微,影像学未见肺炎表现。普通型:具有发热、呼吸道等症状,影像学可见肺炎表现。重型:符合下列任何一条,呼吸频率≥30次/min;静息状态下,指氧饱和度≤93%;动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg。危重型:符合以下情况之一者,出现呼吸衰竭,且需要机械通气;出现休克;合并其他器官功能衰竭需重症监护病房(ICU)监护治疗。该研究得到了浙江大学医学院附属第一医院临床研究伦理委员会的批准(编号IIT20200005C)。
1.3 数据采集患者的流行病学、实验室检查、影像学检查、临床特征、治疗方案以及预后均由定点收治医院上报中国浙江卫生健康委员会,数据由1名研究者录入计算机数据库,并由另外一名经验丰富的临床医生核对。入院患者均接受相应的影像学检查(胸片/CT)和常规呼吸道病毒筛除[包括副流感病毒、甲型流感病毒、腺病毒、SARS冠状病毒、中东呼吸综合征冠状病毒(MERS)等],病情随访至2020年2月7日。
1.4 相关定义本研究将COVID-19病例分为重症和普通病例,其中重症病例包含重型及危重型患者,普通病例包含普通型及轻症患者。本研究的终点结局是一个复合终点,包括由于病情的进展进入ICU监护治疗,出现呼吸衰竭需要机械通气,休克及死亡。在统计终点事件时,只要达到以上任何一项标准即符合。
1.5 统计学方法应用SPSS 25.0软件进行统计学分析。对于呈正态分布的连续计量资料以均数±标准差表示,非正态分布的计量资料以中位数及四分位数(Q1~Q3)表示。分类变量以百分比(%)表示。符合正态分布的计量资料组间比较采用t检验,不符合正态分布的计量资料组间比较采用非参数检验(Mann-Whitney U检验);分类变量采用卡方检验。P≤0.05为差异有统计学意义。在计算生存时间时,以首先达到终点事件的时间为准。在运用COX回归模型时,对吸烟及性别因素进行调整,结果用风险比(HR)及95%置信区间(CI)进行表示。
2 结果 2.1 流行病学及临床特征856例COVID-19患者中共64例合并糖尿病。64例糖尿病患者中男性36例(56.3%),女性28例(43.7%);平均年龄(58.1±11.2)岁,高于非糖尿病患者(P<0.001)。64例糖尿病患者均为2型糖尿病,其中26例(40.6%)患者有过疫区接触史,21例(32.8%)患者曾经与确诊患者密切接触,10例(15.6%)为家庭聚集性发病。在糖尿病患者中,46.9%的患者还合并高血压,6.3%合并心脏病,4.7%合并慢性乙型肝炎及3.1%合并慢性肾病。入院时最常见的症状为发热(89.1%),其次是咳嗽(71.9%)、咳痰(39.1%) 及乏力(25.0%)。其中,合并糖尿病的患者较未合并糖尿病的患者更容易出现肌肉酸痛(P=0.047)。患者起病到确诊中位时间为4(2~8)d。在糖尿病患者中,重症病例占34.4%,而在非糖尿病患者中仅占16.7%,差异具有统计学意义(P<0.001)。入院时,93.8%的患者有影像学异常改变,多表现为以多发斑片/磨玻璃样改变为主的双侧肺部感染。见表 1。
| 表 1 糖尿病与非糖尿病COVID-19患者的流行病学及临床特征比较 Table 1 Comparison of epidemiological and clinical characteristics between COVID-19 patients with and without DM |
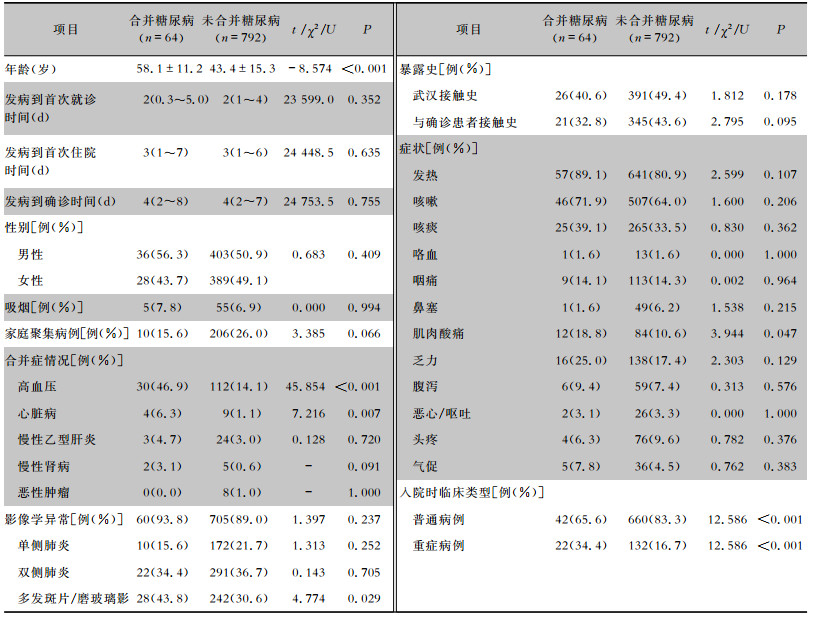
|
64例患者中有18例(28.1%)白细胞减少,13例(20.3%)淋巴细胞降低,25例(39.1%)清蛋白降低,9例(14.1%)钾离子降低及26例(40.6%)钠离子降低。糖尿病组与非糖尿病组的转氨酶、肌酐、乳酸脱氢酶值比较,差异均无统计学意义(均P>0.05)。糖尿病组中性粒细胞绝对值[3.27(2.43~5.00)]高于非糖尿病组[2.96(2.20~3.97)];糖尿病组C反应蛋白(CRP)升高的比率高于非糖尿病组(73.4% VS 49.6%);差异均具有统计学意义(均P<0.001)。见表 2。
| 表 2 糖尿病与非糖尿病COVID-19患者的实验室检查及治疗比较 Table 2 Comparison of laboratory examination and treatment between COVID-19 patients with and without DM |
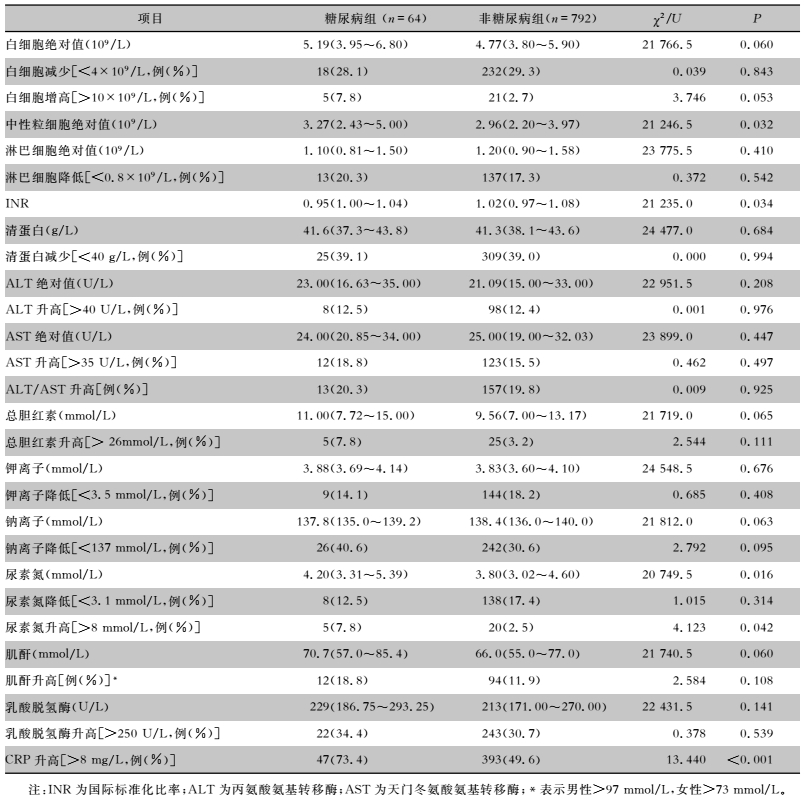
|
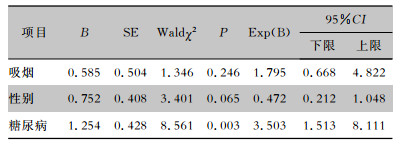
64例糖尿病COVID-19患者均行抗病毒治疗,发病到抗病毒治疗的中位时间为4(2~7)d。常见的抗病毒方案包括干扰素联合克力芝及阿比多尔(37.5%)、克力芝联合阿比多尔(15.6%)、干扰素联合克力芝(14.1%)。除了抗病毒治疗外,51.6%的患者还使用了抗菌药物,另外,分别有25.0%和18.8%的患者因病情需要使用了糖皮质激素及免疫球蛋白进行治疗,其使用比例高于非糖尿病组患者。在住院期间,糖尿病组患者中出现急性呼吸窘迫综合征(ARDS)的比率高于非糖尿病组(20.3% VS 8.7%),其中1例(1.6%)患者因病情需要使用体外膜肺氧合(ECOM)。糖尿病组患者住院时间为18.5(13.8~25.0)d。有7例(10.9%)患者到达复合终点,相比于非糖尿病组患者,差异具有统计学意义(P=0.005),7例患者均因病情需要行有创机械通气并进入ICU,其中,有2(3.1%)例患者在治疗期间发生休克。截至观察日期,仅有1例患者死亡,见表 3。纳入时间因素后,与未合并糖尿病的患者相比,合并糖尿病的患者到达复合终点的风险显著增高,见图 1。在调整了吸烟和性别因素后,合并糖尿病的患者到达复合终点的风险显著高于非糖尿病组(HR=3.50,95%CI:1.51~8.11)。见表 4。
| 表 3 糖尿病组与非糖尿病组COVID-19患者的治疗与转归 Table 3 Treatment and prognosis of COVID-19 patients with and without DM |
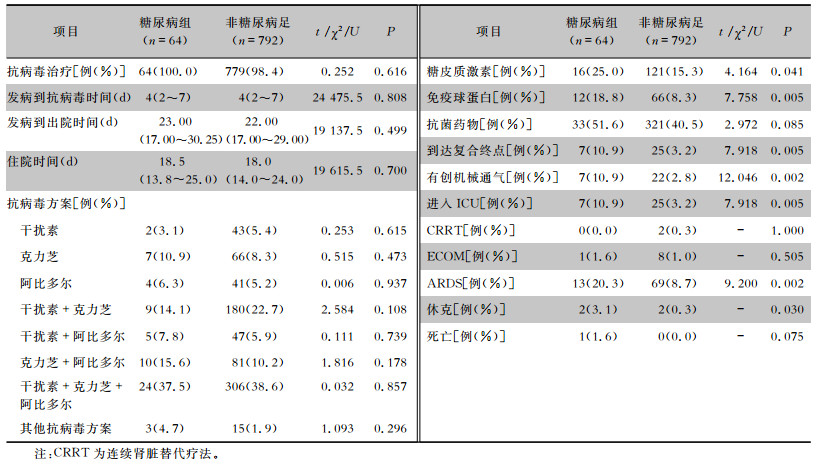
|
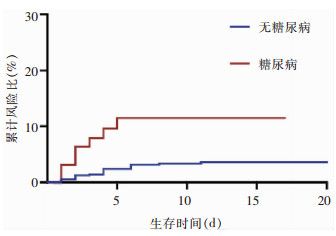 |
| 图 1 糖尿病与未合并糖尿病的COVID-19患者到达复合终点的累计风险比 Figure 1 Cumulative risk ratio of reaching the composite endpoints of COVID-19 patients with and without DM |
| 表 4 合并与未合并糖尿病的COVID-19患者到达复合终点的风险比较 Table 4 Comparison of the risk of reaching the composite endpoint between COVID-19 patients with and without DM |
|
本研究是一项大型多中心回顾性研究,是浙江省首次对于COVID-19合并糖尿病情况进行的全面性调查,能够很好的代表中国中部地区新型冠状病毒流行病学的情况。此项研究描述了COVID-19合并糖尿病患者的流行病学及临床特征,并分析了糖尿病与COVID-19不良结局之间的关系,对临床上COVID-19的诊治及预防起着一定的作用。总的来说,本研究表明,合并糖尿病的COVID-19患者重症病例比例高于未合并糖尿病组,糖尿病组患者更容易出现ARDS且有更多患者达到复合终点,差异均具有统计学意义(均P<0.05)。与最近一项新研究提出的糖尿病是COVID-19患者疾病进展及不良结局的危险因素相呼应[11-12],另外,在目前已有的诸多相关报道中均表明,老龄COVID-19患者重症化倾向高,并发症多,是COVID-19不良结局的危险因素[13],合并糖尿病COVID-19患者的年龄高于未合并糖尿病组患者(P<0.001),且合并高血压及心脏病的比例也高于未合并糖尿病组患者(P<0.01),这些也许是促进合并糖尿病COVID-19患者病情进展的重要因素之一。
糖尿病是世界范围内的主要健康问题,由于肥胖和人口老龄化,全球糖尿病负担正在增加。糖尿病患者常存在免疫细胞减少、自然杀伤细胞活性降低等免疫功能异常,是各种感染发生的高危人群[14]。本研究发现,与未合并糖尿病的患者相比,合并糖尿病的COVID-19患者体内某些与炎症相关的生物标志物的血清水平更高,如中性粒细胞、CRP,提示糖尿病患者发生感染的倾向更高。而之前的报道也表明,嗜中性粒细胞的增多与病毒入侵引起的细胞因子风暴有关[15],因此,对于合并糖尿病的COVID-19患者,我们应该更加密切关注其病情变化,尤其对于高龄与糖尿病共存时,更加应该警惕严重不良事件的发生。
血糖控制不良与多种严重感染密切相关[16],在住院期间,由于糖尿病患者病情较重,其糖皮质激素及免疫球蛋白的使用率显著高于非糖尿病患者。糖皮质激素有着强大的抗炎作用,在重症患者中短期使用有助于患者全身炎性反应的控制,可以减轻病毒感染引起的肺损伤和呼吸困难,但同时,使用糖皮质激素也会导致患者血糖的升高。肝脏在葡萄糖的合成与代谢中扮演着十分重要的角色,在新型冠状病毒感染的过程中,部分患者可能出现肝损伤[17]。当肝细胞广泛受到破坏后,其糖原合成及葡萄糖利用能力下降,患者体内血糖水平将进一步上升。而血糖水平升高是COVID-19非危重病例进展为危重病例/死亡的独立危险因素[18]。研究[11]表明,合并糖尿病的COVID-19患者良好的血糖控制(3.9~10.0 mmol/L)可减少严重不良结局事件和死亡的发生。因此,血糖的控制在COVID-19的治疗中也有着举足轻重的地位。临床上应高度重视合并糖尿病COVID-19患者的血糖管理。但本研究数据来源于多个中心,在疫情暴发初期,出于医疗资源紧张、定点隔离及转院治疗等各种原因,无法做到对每例糖尿病患者进行全程管理,部分患者无法获得治疗期间具体的血糖值变化,因而本文中未对血糖控制与结局间的关系进行探讨。
综上所述,本研究结果表明,糖尿病是COVID-19疾病进展及不良预后的危险因素,因此,对于COVID-19合并糖尿病的患者应更加密切关注其病情变化,在进行积极治疗的同时,也应做好血糖控制和管理。
致谢: 感谢中国浙江省卫生健康委员会对数据收集的协调及帮助!
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Bai Y, Yao LS, Wei T, et al. Presumed asymptomatic carrier transmission of COVID-19[J]. JAMA, 2020, 323(14): 1406-1407. DOI:10.1001/jama.2020.2565 |
| [2] |
Zhou F, Yu T, Du RH, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study[J]. Lancet, 2020, 395(10229): 1054-1062. DOI:10.1016/S0140-6736(20)30566-3 |
| [3] |
Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [4] |
Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteri-stics and outcomes of 1 591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy[J]. JAMA, 2020, 323(16): 1574-1581. DOI:10.1001/jama.2020.5394 |
| [5] |
Garbati MA, Fagbo SF, Fang VJ, et al. A comparative study of clinical presentation and risk factors for adverse outcome in patients hospitalised with acute respiratory disease due to MERS coronavirus or other causes[J]. PLoS One, 2016, 11(11): e0165978. DOI:10.1371/journal.pone.0165978 |
| [6] |
Allard R, Leclerc P, Tremblay C, et al. Diabetes and the severity of pandemic influenza A (H1N1) infection[J]. Diabetes Care, 2010, 33(7): 1491-1493. DOI:10.2337/dc09-2215 |
| [7] |
Yang JK, Feng Y, Yuan MY, et al. Plasma glucose levels and diabetes are independent predictors for mortality and morbidity in patients with SARS[J]. Diabet Med, 2006, 23(6): 623-628. DOI:10.1111/j.1464-5491.2006.01861.x |
| [8] |
Bermejo-Martin JF, Almansa R, Ortiz de Lejarazu R. Weakened immunity in aged hosts with comorbidities as a risk factor for the emergence of influenza A H7N9 mutants[J]. J Infect Dev Ctries, 2013, 7(6): 497-498. DOI:10.3855/jidc.3810 |
| [9] |
Cillóniz C, Polverino E, Ewig S, et al. Impact of age and comorbidity on cause and outcome in community-acquired pneumonia[J]. Chest, 2013, 144(3): 999-1007. DOI:10.1378/chest.13-0062 |
| [10] |
国家卫生健康委员会, 国家中医药管理局. 新型冠状病毒肺炎诊疗方案(试行第六版)[J]. 中国病毒病杂志, 2020, 10(2): 81-85. |
| [11] |
Zhu LH, She ZG, Cheng X, et al. Association of blood glucose control and outcomes in patients with COVID-19 and pre-existing type 2 diabetes[J]. Cell Metab, 2020, 31(6): 1068-1077.e3. DOI:10.1016/j.cmet.2020.04.021 |
| [12] |
Roncon L, Zuin M, Rigatelli G, et al. Diabetic patients with COVID-19 infection are at higher risk of ICU admission and poor short-term outcome[J]. J Clin Virol, 2020, 127: 104354. DOI:10.1016/j.jcv.2020.104354 |
| [13] |
Lian JS, Jin X, Hao SR, et al. Analysis of epidemiological and clinical features in older patients with coronavirus disease 2019 (COVID-19) outside Wuhan[J]. Clin Infect Dis, 2020, 71(15): 740-747. DOI:10.1093/cid/ciaa242 |
| [14] |
Carey IM, Critchley JA, DeWilde S, et al. Risk of infection in type 1 and type 2 diabetes compared with the general population: a matched cohort study[J]. Diabetes Care, 2018, 41(3): 513-521. DOI:10.2337/dc17-2131 |
| [15] |
Wang DW, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA, 2020, 323(11): 1061-1069. DOI:10.1001/jama.2020.1585 |
| [16] |
Critchley JA, Carey IM, Harris T, et al. Glycemic control and risk of infections among people with type 1 or type 2 diabetes in a large primary care cohort study[J]. Diabetes Care, 2018, 41(10): 2127-2135. DOI:10.2337/dc18-0287 |
| [17] |
Cai QX, Huang DL, Yu H, et al. COVID-19:abnormal liver function tests[J]. J Hepatol, 2020, 73(3): 566-574. DOI:10.1016/j.jhep.2020.04.006 |
| [18] |
Wu JF, Huang JQ, Zhu GC, et al. Elevation of blood glucose level predicts worse outcomes in hospitalized patients with COVID-19:a retrospective cohort study[J]. BMJ Open Diabetes Res Care, 2020, 8(1): e001476. DOI:10.1136/bmjdrc-2020-001476 |



