免疫抑制患者容易发生机会性致病菌感染。奴卡菌是一种少见的革兰阳性菌,可引起局部或播散性器官感染,通常发生于免疫受损患者。曲霉是一类广泛存在于自然界的真菌,主要侵袭肺部,属于条件致病菌。两者具有相似的危险因素,如长期使用糖皮质激素、免疫抑制剂、实体器官移植、血液系统肿瘤、糖尿病、结构性肺病等。肺奴卡菌病和侵袭性肺曲霉病虽均属于肺部机会性感染病,但两者混合感染少见,临床诊治复杂,现报告某院收治的2例肺奴卡菌病合并曲霉感染患者的临床特点,并结合国内外文献进行复习,以提高对该疾病的诊治水平。
1 临床资料 1.1 病例1患者女性,53岁,因“反复咳嗽、咳痰、咯血20余年,加重1周”入院。患者20余年来反复出现阵发性咳嗽,咳黄色黏痰,伴有咯血,曾多次住院,诊断为“支气管扩张症并感染”,给予抗感染、祛痰、止血等治疗。1周前感冒后再次出现上述症状,每日咯血量约1~2 mL,为求进一步诊治以支气管扩张症并感染收入院。既往无吸烟饮酒史。入院查体:体温36℃,脉搏88次/分,呼吸18次/分,血压126/77 mmHg,未吸氧下经皮脉搏氧饱和度为96%,急性病容,咽充血,双侧扁桃体Ⅱ度肿大,表面无脓点,双肺呼吸音粗,未闻及明显干湿啰音,未闻及胸膜摩擦音,心脏、腹部查体阴性,双下肢无水肿。
入院后辅助检查:血常规白细胞计数4.7×109/L,中性粒细胞百分比60.2%,血红蛋白129 g/L,血小板185×109/L。血沉10 mm/h,C反应蛋白(CRP)3.5 mg/L,降钙素原0.24 ng/mL。血清(1, 3)-β-D葡聚糖试验(G试验)、曲霉菌血清学试验、结核菌素试验(PPD试验)、呼吸道病病原体IgM抗体(呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、肺炎衣原体、肺炎支原体、嗜肺军团菌)阴性,痰细菌+真菌培养未查见致病菌,痰抗酸染色、真菌涂片镜检阴性。胸部CT:双肺下叶部分支气管扩张,周围见斑片状密度增高影,边界模糊,见图 1(A、B)。
 |
| 注:A、B为病例1入院时,左肺下叶见多发斑片状磨玻璃影,支气管管壁增粗;C、D为病例1治疗2个月后,左肺下叶磨玻璃影明显吸收;E、F为病例2治疗前,双肺见多发结节状、斑片状高密度影,边缘模糊,左肺下叶胸膜下呈局部实变,内见支气管充气征改变;G、H为病例2治疗1个月后复查,双肺结节、实变较前吸收。 图 1 两例患者胸部CT检查结果 Figure 1 Chest CT examination results of two patients |
入院后给予头孢哌酮/舒巴坦(3.0 g, q12h)、莫西沙星(0.4 g, qd)抗感染治疗,溴己新(4 mg, bid)祛痰、酚磺乙胺(0.5 g, bid)止血治疗。患者仍有频繁咳嗽,咳黄黏痰。入院后第4天行支气管镜检查:右侧各级支气管、左肺上叶支气管未见异常;左肺下叶支气管口聚集褐色黏稠痰,生理盐水冲洗后见痰液主要自下叶基底段溢出,吸引干净后,下叶基底段管口通畅,未见新生物,基底段各亚段黏膜充血,管腔稍狭窄,于内基底段、外基底段管口黏膜处活检送病理,灌洗液、刷检物送病原学检查。支气管肺泡灌洗液(BALF)半乳甘露聚糖试验(GM试验)0.71 μg/L(正常<0.65 μg/L),BALF培养示盖尔森基兴奴卡菌,刷检物培养示烟曲霉菌,BALF、刷检物均未查见抗酸杆菌。经支气管镜肺活检病理:送检物为少量支气管黏膜,黏膜呈慢性炎症,可见淋巴细胞、浆细胞及少量单核细胞、嗜酸性粒细胞浸润。诊断为肺奴卡菌病合并曲霉感染,遂停用头孢哌酮/舒巴坦、莫西沙星,更改为复方磺胺甲
患者女性,50岁,因“发热、咳嗽、咳痰、喘憋6 d”入院。6 d前受凉后出现发热,体温最高40.5℃,伴有畏寒、寒战,出现阵发性咳嗽,痰为黄色脓痰,自服阿莫西林、复方甘草片,症状渐加重,为进一步诊治以肺炎收入院。既往有支气管哮喘病史40余年,平常间断吸入布地奈德福莫特罗粉吸入剂;12年前因反复支气管扩张症并感染行左肺下叶切除术;抗磷脂抗体综合征病史4个月,目前口服泼尼松(10 mg, qd)、阿司匹林(100 mg, qd)、羟氯喹(0.2 g, bid)治疗。入院查体:体温37.4℃,脉搏84次/分,呼吸23次/分,血压114/66 mmHg,未吸氧下经皮脉搏氧饱和度92%。神志清,精神差,急性热病容,浅表淋巴结未触及肿大,双肺呼吸音粗,可闻及干湿性啰音,未闻及胸膜摩擦音,心脏、腹部查体阴性,双下肢无水肿。
入院后辅助检查:血常规示白细胞22.5×109/L,中性粒细胞百分比85.5%,血红蛋白124 g/L,血小板161×109/L,血沉46 mm/h,CRP 160.67 mg/L,降钙素原1.07 ng/mL。血清真菌G试验、曲霉菌血清学试验、PPD试验、血培养、呼吸道病病原体IgM抗体(呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、肺炎衣原体、肺炎支原体、嗜军团菌)阴性,清蛋白27.6 g/L,抗心磷脂抗体>300 AU/mL,抗SS-A/Ro60kD抗体弱阳性。连续2次痰培养为烟曲霉菌(痰涂片白细胞10~25、上皮细胞<10/低倍镜)。胸部CT示:双肺多发斑片状、结节状密度增高,边界模糊,局部呈实变表现,纵隔见多发增大淋巴结,双侧胸膜增厚,见图 1(E、F)。
入院后给予左氧氟沙星(0.5 g, qd)、哌拉西林/他唑巴坦(3.375 g, q12h)抗感染,氨溴索(30 mg, bid)祛痰,雾化布地奈德+异丙托溴铵(前者1 mg,后者500 μg,bid)平喘,口服泼尼松(10 mg, qd)、阿司匹林(100 mg, qd)、羟氯喹(0.2 g, bid)。患者仍有反复发热,咳嗽、喘憋症状较前加重,入院后第5天行支气管镜检查:右侧各叶段支气管未见异常,左肺下叶见手术盲端,左肺上叶各叶段通畅,见少许黄白色分泌物,于右肺上叶后端、左肺舌叶给予灌洗并送病原学检测。BALF细菌培养烟曲霉菌,肺泡灌洗液宏基因组二代测序为脓肿奴卡菌和烟曲霉。颅脑MRI未见异常。停用左氧氟沙和哌拉西林/他唑巴坦,更换为TMP/SMX(2片,q8h)、伏立康唑(0.2 g, q12h)治疗,患者体温降至正常,咳嗽、喘憋症状逐渐缓解,出院后继续口服TMP/SMX(2片,q8h)、伏立康唑(0.2 g, q12h)。1个月后复查胸部CT示:双肺感染较前明显吸收,见图 1(G、H)。
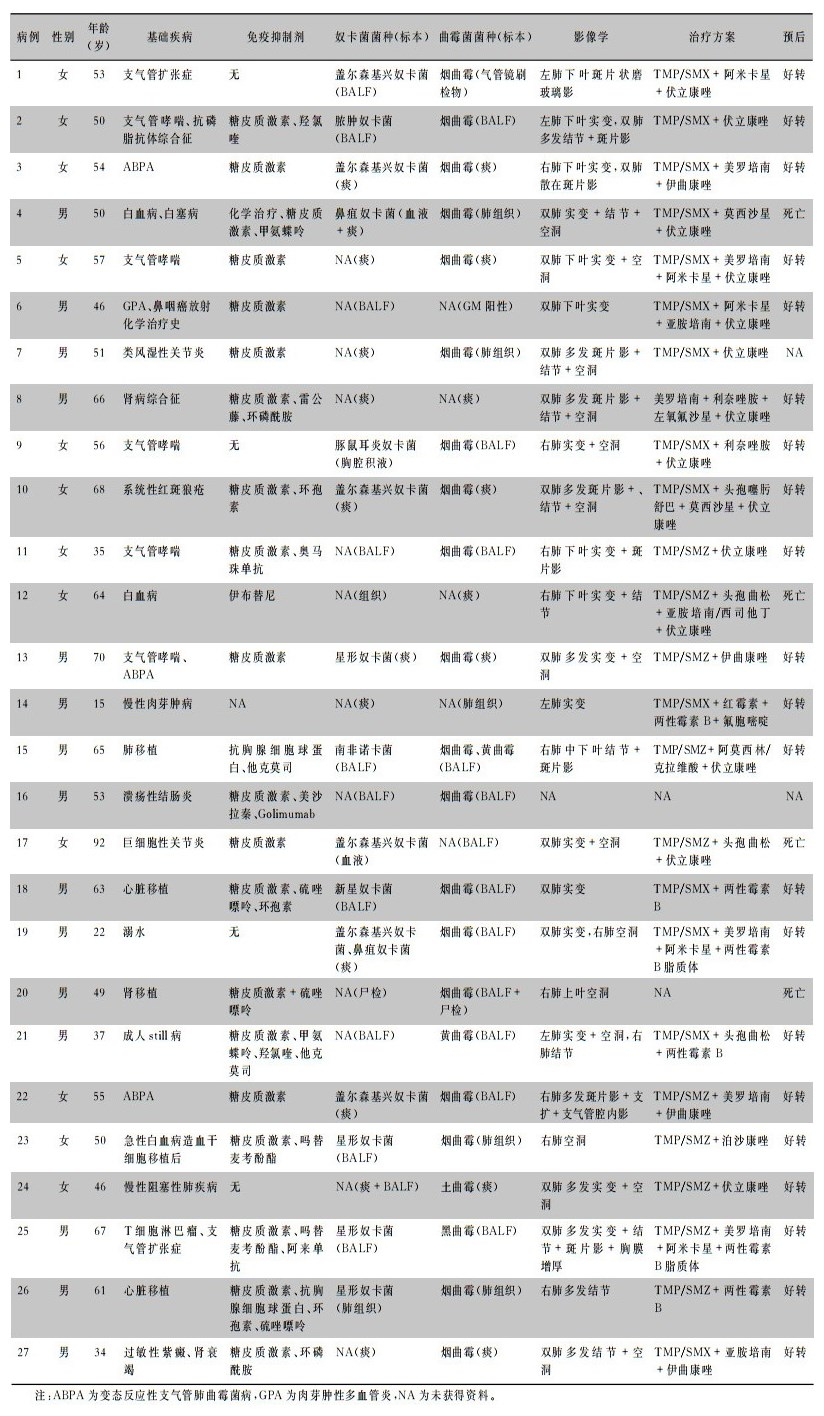
2 文献复习截至2022年1月31日,以奴卡、曲霉组合为关键词,在万方数据库和中国知网进行检索。以nocardiosis、aspergillosis为关键词,在PubMed、Web of Science数据库进行检索,除临床资料不完整和非英语文献外,共检索到6篇中文文献[1-6]和17篇外文文献[7-23]并获取全文,收集所有患者的临床资料进行分析,包括基线资料、临床症状、影像学表现、治疗及转归。报道的病例结合本组2例总共27例患者的临床特征,见表 1。其中男性15例,女性12例;年龄15~92岁,平均(52.9±15.6)岁。除1例溺水者外[12],23例为有基础疾病(包括实体器官移植、血液系统肿瘤、结缔组织病等)的免疫功能受损患者,3例有慢性肺病基础(如慢性阻塞性肺疾病、支气管哮喘、支气管扩张),长期使用糖皮质激素和/或免疫抑制剂者占77.8%(21/27)。临床症状主要为咳嗽、咳痰、发热,部分患者可有活动后气促、咯血、胸痛,严重者可出现呼吸衰竭、感染性休克。影像学表现以实变、结节、空洞为主,空洞大小不等,可单发或多发,以中下肺叶多见。BALF和痰培养是最主要的病原学标本来源,其他还有肺穿刺组织、血培养、胸腔积液、淋巴结、尸检等。除2例不详外,其余25例均接受针对奴卡菌和曲霉菌的抗感染治疗。奴卡菌以TMP/SMX单药或联合用药为主;曲霉菌以使用伏立康唑最常见,部分患者使用两性霉素B、伊曲康唑。大多数患者(21/27)预后良好,4例患者死于重症感染、感染性休克、多脏器功能衰竭[5, 8, 20, 22]。
| 表 1 27例肺奴卡菌病合并曲霉感染患者的临床资料 Table 1 Clinical data of 27 cases of pulmonary nocardiosis complicated with Aspergillus infection |
|
奴卡菌广泛存在于土壤、粉尘、水源和腐烂的植物中,主要通过皮肤伤口、呼吸道、消化道等侵入人体,引起局限性或播散性化脓性病变,以星形奴卡菌、鼻疽奴卡菌、巴西奴卡菌感染最常见[24-25]。曲霉是一种广泛存在于自然界的真菌,经呼吸道吸入曲霉孢子可引起侵袭性肺部真菌病,其中烟曲霉是最常见的感染菌种。奴卡菌和曲霉主要感染免疫受损人群,两者感染具有相似的危险因素。奴卡菌和曲霉可以共同感染免疫受损患者,也可感染无免疫受损的结构性肺病患者。文献复习显示,除1例健康溺水者外[12],有2例结构性肺病患者发生奴卡菌和曲霉共同感染[3, 23],可能与结构性肺病患者气道上皮病原菌定植导致纤毛运动障碍,损伤上皮细胞功能,利于奴卡菌、曲霉菌等生长[26-27]有关。
本病例报告及文献复习显示,肺奴卡菌病临床症状无特异性,以发热、咳嗽、呼吸困难、咯血等常见,此与常见细菌性肺炎、肺恶性肿瘤、肺结核等临床表现相似。曲霉菌肺炎的临床症状同样缺乏典型表现。与临床特征类似,肺奴卡菌病的影像学表现也是非特异性的,可以表现为多发不规则结节或伴空洞、实变、斑片状浸润、肺脓肿或胸腔积液[28]。在侵袭性肺曲霉菌病中,影像学呈现多样性,可表现为结节周围伴有磨玻璃影浸润(晕征),随着时间推移,结节内可出现空洞。两者共同感染使得影像学表现更为复杂化,弱化了影像学的提示意义,增加了鉴别诊断的困难性。提示影像学上有结节、实变或空洞等多态性表现时,结合有无免疫受损和结构性肺病病史,需考虑机会性致病菌感染的风险,治疗失败或反复时,需考虑混合感染的可能,应及早获取病原学结果。
明确诊断的关键仍然是从临床标本中分离出病原体。对于奴卡菌而言,从身体任何部位分离出的奴卡菌均应视为有临床意义。曲霉菌则需要仔细甄别定植、污染和致病问题。最简单、无创的标本来源是痰,但阳性率低。侵入性的诊断策略包括BALF和经皮肺穿刺活检,可以明显提高阳性率,但奴卡菌具有生长缓慢、培养周期长的特点,常导致临床诊治延迟。传统的革兰染色法和改良的抗酸染色法在病原菌诊断方面发挥重要作用的同时,新型分子诊断技术,如聚合酶链反应、基因测序技术、限制性酶切分析,已经越来越多的用于特殊病原菌种属的鉴定[29-30],可以精准地检测病原菌种类、数目,缩短检测周期,实现病原体的快速诊断。尤其对于特殊类型、难以检测、培养周期长、阳性率低的病原微生物,新型分子诊断技术使得诊断窗口前移,从而指导临床诊治和延长实验室培养时间,提高培养阳性率以及获得药敏结果,明显改善了患者的预后。病例2通过宏基因组测序,快速、准确地鉴定出病原菌种属,实现了感染分子水平的精准诊断。在免疫抑制和结构性肺病基础的人群中,需警惕机会性致病菌的感染,病原菌普通培养周期长、阳性率低等特点使其指导临床存在滞后性、增加误诊率,在这些特殊人群中,应用诸如基因测序等新型分子诊断技术,可尽早获取准确的病原菌信息,指导临床针对性诊治。
由于缺乏前瞻性的随机对照试验,肺奴卡菌病的治疗方案基于回顾性临床研究,以TMP/SMX为基础[31],在治疗效果欠佳时,可根据药敏结果,联用阿米卡星、亚胺培南、第三代头孢菌素、莫西沙星和利奈唑胺等,并延长疗程以预防复发[32]。曲霉菌肺炎的治疗仍以唑类为主。病原学明确后,及时、正确地针对肺奴卡菌病和曲霉进行治疗,大多数患者预后良好。
综上所述,免疫受损和存在结构性肺病的患者易发生条件致病菌感染,也是混合感染的高危人群,当经验性抗感染治疗无效时,应考虑发生奴卡菌和曲霉菌感染的可能,甚至是混合感染的可能。因为这两种微生物感染缺乏特征性的临床表现和影像学征象,及早确定感染病原体并采取针对性治疗尤为重要,但是传统的微生物涂片镜检和培养方法阳性率低、周期长,给临床病因治疗带来困难,新型诊断技术的出现实现了病原体快速筛查,明显缩短了检测周期,可以尽早给予针对性治疗。提示在特殊群体中,需注意特殊病原体的感染和混合感染的可能,及早获取病原菌结果实现感染的精准治疗,才能降低病死率,改善预后。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
陈中举, 左鹏, 熊盛道, 等. 烟曲霉合并诺卡菌致肺脓肿1例并文献复习[J]. 临床检验杂志, 2017, 35(10): 781-782. Chen ZJ, Zuo P, Xiong SD, et al. Pulmonary abscess caused by Aspergillus fumigatus combined with nocardia: a case report and literature review[J]. Chinese Journal of Clinical Laboratory Science, 2017, 35(10): 781-782. |
| [2] |
吴小静, 黄絮, 冯莹莹, 等. 肺奴卡菌病合并曲霉感染三例并文献复习[J]. 中国呼吸与危重监护杂志, 2018, 17(4): 359-363. Wu XJ, Huang X, Feng YY, et al. Pulmonary nocardiosis complicated with aspergillosis: three cases report and literature review[J]. Chinese Journal of Respiratory and Critical Care Medicine, 2018, 17(4): 359-363. |
| [3] |
刘利华, 李钊, 李晓哲, 等. 豚鼠耳炎诺卡菌合并曲霉感染一例[J]. 中国呼吸与危重监护杂志, 2019, 18(2): 179-181. Liu LH, Li Z, Li XZ, et al. A case of Nocardia auriculitis associated with aspergillus infection in guinea pig[J]. Chinese Journal of Respiratory and Critical Care Medicine, 2019, 18(2): 179-181. |
| [4] |
黄东东, 蒋涛, 肖建, 等. 变态反应性支气管肺曲霉菌病继发肺诺卡菌感染一例并文献复习[J]. 国际呼吸杂志, 2019, 39(15): 1182-1185. Huang DD, Jiang T, Xiao J, et al. Nocardia infection secon-dary to allergic bronchopulmonary aspergillosis: a case report and literature review[J]. International Journal of Respiration, 2019, 39(15): 1182-1185. DOI:10.3760/cma.j.issn.1673-436X.2019.15.012 |
| [5] |
张银利, 高大泉, 谢亚萍, 等. 播散性诺卡菌病合并肺曲霉感染1例[J]. 中国感染与化疗杂志, 2021, 21(1): 93-95. Zhang YL, Gao DQ, Xie YP, et al. Disseminated nocardiosis complicated with pulmonary Aspergillus infection: a case report[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(1): 93-95. |
| [6] |
段智梅, 毛丹, 徐轶, 等. 侵袭性肺曲霉病合并肺奴卡菌病1例并文献复习[J]. 解放军医学杂志, 2021, 46(4): 348-353. Duan ZM, Mao D, Xu Y, et al. Co-infection of pulmonary aspergillosis and nocardiosis: a case report and literature review[J]. Medical Journal of Chinese People's Liberation Army, 2021, 46(4): 348-353. |
| [7] |
Casale TB, Macher AM, Fauci AS. Concomitant pulmonary aspergillosis and nocardiosis in a patient with chronic granulomatous disease of childhood[J]. South Med J, 1984, 77(2): 274-275. DOI:10.1097/00007611-198402000-00042 |
| [8] |
Carter JM, Green WR, Callender CO, et al. Pulmonary cavitation with Nocardia and Aspergillus in a renal transplant patient[J]. J Natl Med Assoc, 1990, 82(7): 527-528, 530-531. |
| [9] |
Galbraith J, Preiksaitis JK, Czekanski S, et al. Successful management of sequential pulmonary infections in a cardiac transplant recipient[J]. Can J Infect Dis, 1990, 1(3): 85-91. |
| [10] |
Holt RI, Kwan JT, Sefton AM, et al. Successful treatment of concomitant pulmonary nocardiosis and aspergillosis in an immunocompromised renal patient[J]. Eur J Clin Microbiol Infect Dis, 1993, 12(2): 110-112. DOI:10.1007/BF01967584 |
| [11] |
Monteforte JS, Wood CA. Pneumonia caused by Nocardia nova and Aspergillus fumigatus after cardiac transplantation[J]. Eur J Clin Microbiol Infect Dis, 1993, 12(2): 112-114. DOI:10.1007/BF01967585 |
| [12] |
van Dam AP, Pruijm MTC, Harinck BIJ, et al. Pneumonia involving Aspergillus and Rhizopus spp. after a near-drowning incident with subsequent Nocardia cyriacigeorgici and N. farcinica coinfection as a late complication[J]. Eur J Clin Microbiol Infect Dis, 2005, 24(1): 61-64. DOI:10.1007/s10096-004-1263-9 |
| [13] |
Hamadani M, Benson DM Jr, Blum W, et al. Pulmonary Nocardia and Aspergillus co-infection in a patient with chronic graft-versus-host disease[J]. Transpl Infect Dis, 2008, 10(1): 24-26. DOI:10.1111/j.1399-3062.2007.00268.x |
| [14] |
Al-Anazi KA, Aljurf MD, Al-Mohareb FI, et al. Successful management of invasive pulmonary nocardiosis and aspergillosis in a patient with T-cell lymphoma: a case report[J]. Clin Med Case Rep, 2008, 1: 65-71. |
| [15] |
Cabada MM, Nishi SP, Lea AS, et al. Concomitant pulmonary infection with Nocardia transvalensis and Aspergillus ustus in lung transplantation[J]. J Heart Lung Transplant, 2010, 29(8): 900-903. DOI:10.1016/j.healun.2010.04.016 |
| [16] |
Sharma B, Ghosh G, Kamble U, et al. Allergic bronchopulmonary aspergillosis complicated by nocardiosis[J]. Case Rep Pulmonol, 2012, 2012: 758630. |
| [17] |
Misra DP, Parida JR, Chowdhury AC, et al. Pulmonary co-infection with Nocardia and Aspergillus in a patient with adult-onset Still's disease receiving steroids and tacrolimus[J]. BMJ Case Rep, 2014, 2014: bcr2014207335. DOI:10.1136/bcr-2014-207335 |
| [18] |
Alonso-Sierra M, Calvo M, González-Lama Y. Nocardia and Aspergillus coinfection in a patient with ulcerative colitis du-ring golimumab therapy[J]. J Crohns Colitis, 2016, 10(9): 1127-1128. DOI:10.1093/ecco-jcc/jjw064 |
| [19] |
Matsubayashi S, Iikura M, Numata T, et al. A case of Aspergillus and Nocardia infections after bronchial thermoplasty[J]. Respirol Case Rep, 2019, 7(2): e00392. DOI:10.1002/rcr2.392 |
| [20] |
Dotson J, Katz H, Jafri H, et al. A rare instance of simultaneous infection with disseminated Nocardia and pulmonary Aspergillus in a patient receiving treatment with ibrutinib for chronic lymphocytic leukemia[J]. Cureus, 2018, 10(10): e3427. |
| [21] |
Wu JY, Wu YP, Zhu ZQ. Pulmonary infection caused by Nocardia cyriacigeorgica in a patient with allergic bronchopulmonary aspergillosis: a case report[J]. Medicine (Baltimore), 2018, 97(43): e13023. DOI:10.1097/MD.0000000000013023 |
| [22] |
Gomes F, La Feria P, Costa C, et al. Nocardia cyriacigeorgica and Aspergillus co-infection in a patient with giant-cell arteritis[J]. Eur J Case Rep Intern Med, 2019, 6(1): 000997. |
| [23] |
Meena DS, Kumar D, Bohra GK, et al. Pulmonary nocardiosis with aspergillosis in a patient with COPD: a rare co-infection[J]. IDCases, 2020, 20: e00766. DOI:10.1016/j.idcr.2020.e00766 |
| [24] |
Hirayama T, Takazono T, Horai Y, et al. Pulmonary nocardiosis caused by Nocardia concava with a literature review[J]. Intern Med, 2016, 55(9): 1213-1217. DOI:10.2169/internalmedicine.55.6228 |
| [25] |
Lai CC, Liu WL, Ko WC, et al. Multicenter study in Taiwan of the in vitro activities of nemonoxacin, tigecycline, doripe-nem, and other antimicrobial agents against clinical isolates of various Nocardia species[J]. Antimicrob Agents Chemother, 2011, 55(5): 2084-2091. DOI:10.1128/AAC.01808-10 |
| [26] |
Fujita T, Ikari J, Watanabe A, et al. Clinical characteristics of pulmonary nocardiosis in immunocompetent patients[J]. J Infect Chemother, 2016, 22(11): 738-743. DOI:10.1016/j.jiac.2016.08.004 |
| [27] |
Kim YK, Sung H, Jung J, et al. Impact of immune status on the clinical characteristics and treatment outcomes of nocardiosis[J]. Diagn Microbiol Infect Dis, 2016, 85(4): 482-487. DOI:10.1016/j.diagmicrobio.2016.05.004 |
| [28] |
Sato H, Okada F, Mori T, et al. High-resolution computed tomography findings in patients with pulmonary nocardiosis[J]. Acad Radiol, 2016, 23(3): 290-296. DOI:10.1016/j.acra.2015.11.008 |
| [29] |
Weng SS, Zhang HY, Ai JW, et al. Rapid detection of Nocardia by next-generation sequencing[J]. Front Cell Infect Microbiol, 2020, 10: 13. DOI:10.3389/fcimb.2020.00013 |
| [30] |
Rouzaud C, Rodriguez-Nava V, Catherinot E, et al. Clinical assessment of a Nocardia PCR-based assay for diagnosis of nocardiosis[J]. J Clin Microbiol, 2018, 56(6): e00002-18. |
| [31] |
Williams E, Jenney AW, Spelman DW. Nocardia bacteremia: a single-center retrospective review and a systematic review of the literature[J]. Int J Infect Dis, 2020, 92: 197-207. DOI:10.1016/j.ijid.2020.01.011 |
| [32] |
Tashiro H, Takahashi K, Kusaba K, et al. Relationship between the duration of trimethoprim/sulfamethoxazole treatment and the clinical outcome of pulmonary nocardiosis[J]. Respir Investig, 2018, 56(2): 166-172. DOI:10.1016/j.resinv.2017.11.008 |



