慢性乙型肝炎是由乙型肝炎病毒(HBV)持续感染引起的肝脏慢性炎症性疾病,慢性HBV感染是全球重大公共卫生问题,据世界卫生组织(WHO)报道,目前全球约2.57亿慢性HBV感染者[1]。据估计,我国慢性HBV感染者高达7 000万例,其中慢性乙型肝炎患者达到(2 000~3 000)万例[2]。慢性乙型肝炎反复活动,炎症持续存在导致全球每年数十万人死于肝硬化失代偿、原发性肝细胞癌等HBV感染相关疾病,造成了严重的社会、经济负担,而通过抗HBV治疗,可以抑制HBV复制,降低肝炎活动,从而降低上述疾病发生的风险。
目前临床应用的抗HBV药物主要有2类,其一是核苷(酸)类似物,主要有恩替卡韦(ETV)、富马酸替诺福韦二吡呋酯、富马酸丙酚替诺福韦等;其二是干扰素,包括普通干扰素和聚乙二醇化干扰素-α(Peg-IFN-α)。两类药物的作用机制不同,均有其各自的优缺点,核苷(酸)类似物通过竞争性抑制HBV-DNA多聚合酶强效抑制病毒复制,促进丙氨酸氨基转移酶(ALT)恢复正常,口服方便,不良反应少,长期服药能维持病毒学应答,同时改善肝组织学,但患者一旦停药后容易导致病毒学反弹及耐药风险增加,甚至导致肝炎暴发的风险[3-4]。ETV作为目前应用最广泛的核苷(酸)类似物,能强效抑制HBV在体内的复制,副作用小,安全性能高,5年耐药率低,价格相对经济实惠,在抗病毒治疗过程中具有非常重要的地位,在临床上属于一线用药。干扰素适应证较窄,不良反应较多,其抑制HBV复制能力有限,不同患者间复发率存在较大差异,普通干扰素更是需要多次皮下注射,不方便,而Peg-IFN-α是普通干扰素分子与聚乙二醇分子的复合物,通过增强HBV特异性T淋巴细胞功能达到抗病毒及持久增强机体免疫功能的效果,在血液中有较稳定的高浓度,能获得相对持久的应答作用,不容易产生耐药,减少了注射次数,应用更方便,提高了患者的治疗依从性,美国、欧洲、亚太地区等慢性乙型肝炎防治指南都将Peg-IFN-α列为乙型肝炎抗病毒治疗的一线药物。
2018年亚太肝病研究学会、2017年欧洲指南及2019年中国慢性乙型肝炎临床治愈专家共识均提出慢性乙型肝炎临床治愈(功能性治愈)是指完成有限疗程治疗后,病毒复制得到充分抑制,肝脏炎症得到改善,组织病理学得到改善,血清乙型肝炎表面抗原(HBsAg)持续检测不到,乙型肝炎病毒e抗原(HBeAg)阴转,伴或不伴HBsAg血清学转换,同时强调以停药后持久应答为终点,最终达到延缓或阻止肝硬化失代偿、肝衰竭、肝癌发生的治疗目标[5-7]。据报道,单用核苷(酸)类似物或Peg-IFN-α治疗实现慢性乙型肝炎临床治愈率<5%,而核苷(酸)类似物和Peg-IFN-α合理联用能够产生互补和协同作用。研究[8-9]报道,ETV和Peg-IFN-α序贯治疗的优化方案其临床治愈率高于单药治疗。目前已报道的相关研究缺乏对比ETV和ETV序贯Peg-IFN-α治疗的系统评价,且纳入的研究随访时间短,观察指标少[10];因此,本研究纳入更新的高质量临床研究,同时从HBsAg转换率、HBsAg清除率、HBeAg转换率及HBeAg清除率四个方面来系统评价与分析经ETV治疗获得病毒学应答的慢性乙型肝炎患者,序贯Peg-IFN-α与继续单用ETV治疗在第48周时的疗效差异。
1 资料与方法 1.1 文献基本信息本研究对文献基本要求:选择随机双盲对照试验,研究对象选取长期使用ETV获得病毒学应答的慢性乙型肝炎患者,及ETV序贯Peg-IFN-α治疗获得病毒学应答的慢性乙型肝炎患者。
1.2 纳入及排除标准所有使用ETV单药或者ETV序贯Peg-IFN-α的随机对照试验均被纳入。排除标准包括研究对象为酒精性、免疫性、遗传性、肝癌及其他病毒性肝炎等肝病,或者慢性乙型肝炎合并其他肝病;合并严重心脑血管疾病、肾病、血液系统疾病、严重感染;有严重的精神、神经病病史等;妊娠哺乳期妇女;使用不同抗病毒治疗方案;对干扰素、ETV有过敏史的患者;不适合本研究的任何其他情况。
1.3 检索方法本研究使用关键词“慢性乙型肝炎、恩替卡韦、聚乙二醇化干扰素-α、序贯治疗、系统评价与分析”或“chronic hepatitis B(CHB), ETV, Peg-IFN-α, sequential therapy, system evaluation and analysis”搜索2012年1月—2021年12月包括PubMed、Cochrane Library、Embase、中国知网、万方数据库等国内外权威数据库的中英文文献,按照纳入、排除标准进行筛选,获得10篇有效研究论文。
1.4 质量评价随机对照试验研究质量评价应用Cochrane ROB 2 tool。
1.5 数据提取使用预先设计的数据提取方法分别提取数据,将数据导入Stata 16.0软件进行评价,讨论并解决数据提取过程的偏差。
1.6 统计分析应用Stata 16.0软件进行统计学分析,绘制森林图对系统评价与分析的结果进行综合表达。本篇系统分析在纳入文献中提取的数据属于二分类变量,以比值比(OR)为分析统计量,因此,计数资料采用OR及95%可信区间(CI)表示。异质性评价采用I2统计量检验,若I2<50%,P>0.10提示各研究间存在统计学异质性小,采用固定效应模型进行数据分析;I2≥50%,P≤0.10,提示各研究间存在统计学异质性大,采用随机效应模型。
2 结果 2.1 文献检索流程在数据检索库中输入研究关键词共获得相关研究论文1 318篇,阅读文献标题及提纲后排除不相关论文1 160篇,进一步阅读全文,根据文献研究对象、观察指标等不符合纳入标准的论文146篇,最终符合条件的研究论文共10篇[8, 11-19],包括8篇英文和2篇中文文献,均为随机对照试验研究,文献筛选流程及结果见图 1。
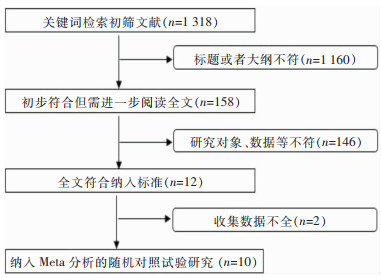 |
| 图 1 纳入文献筛选流程及结果 Figure 1 Screening process and results of included literatures |
10篇随机对照试验研究共纳入1 250例研究对象,其中697例患者为ETV对照组(Control),553例患者为ETV序贯Peg-IFN-α试验组(Treatment),在治疗第48周评估患者各项测量指标。纳入文献中两组患者年龄、性别、ALT、天门冬氨酸氨基转移酶(AST)、乙型肝炎病毒DNA定量(HBV-DNA)、HBsAg、HBeAg水平比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 纳入研究对象的基线特征 Table 1 Baseline characteristics of included subjects |
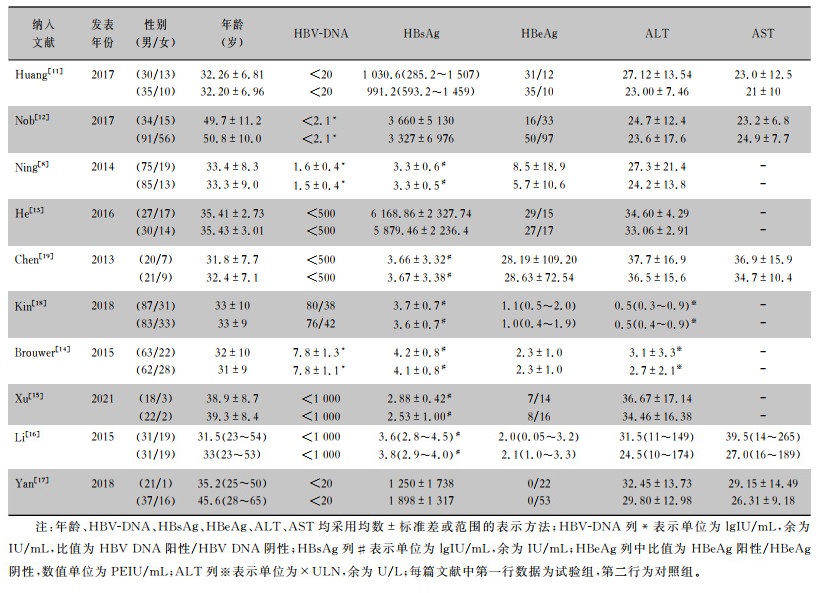
|
本研究应用Cochrane ROB 2 tool进行文献质量评价,由双人独立完成,结果如图 2所示,仅随机过程中出现较大的偏倚,表明纳入文献的随机对照试验方法学质量较好,偏倚风险低,研究结论内部真实性可靠。同时采用Egger方法评估发表偏倚情况,结果显示P>0.05,提示不存在显著的小样本效应,表明本研究无明显发表偏倚。
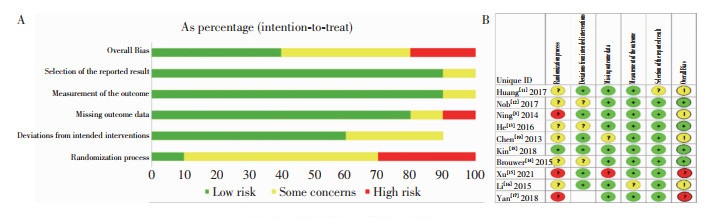 |
| 注:A为偏倚风险;B为偏倚风险汇总。 图 2 纳入研究方法学质量评价 Figure 2 Quality assessment of methodology of included literatures |
纳入研究中共有7篇文献[8, 11, 13-15, 17-18]在治疗48周时对HBsAg转换率进行了数据统计,ETV序贯Peg-IFN-α试验组共427例患者,ETV对照组470例患者,HBsAg转换试验组49例,对照组3例。采用固定效应模型进行系统评价与分析,ETV序贯Peg-IFN-α试验组的HBsAg转换率高于ETV对照组,差异有统计学意义[OR=11.65,95%CI(4.79, 28.32),Z=5.42,P<0.001],见图 3。
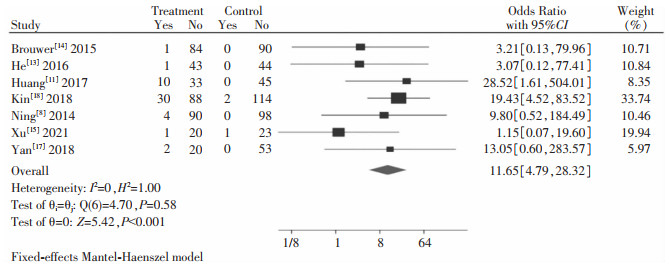 |
| 图 3 HBsAg转换率系统评价与分析结果 Figure 3 Systematic assessment and analysis results of HBsAg conversion rate |
纳入研究中有9篇文献[8, 11-18]在治疗48周时对HBsAg清除率进行了数据统计,ETV序贯Peg-IFN-α试验组共526例患者,ETV对照组667例患者,HBsAg清除试验组有35例,对照组0例。采用固定效应模型进行系统评价与分析,ETV序贯Peg-IFN-α试验组的HBsAg清除率高于ETV对照组,差异有统计学意义[OR=11.65,95%CI(4.33, 31.32),Z=4.87,P<0.001],见图 4。
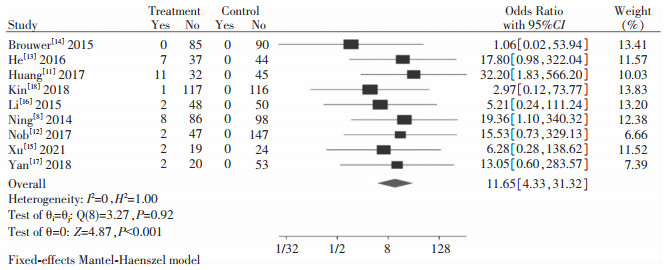 |
| 图 4 HBsAg清除率系统评价与分析结果 Figure 4 Systematic assessment and analysis results of HBsAg clearance rate |
纳入研究中共有5篇文献[11-13, 18-19]在治疗48周时对HBeAg转换率进行了数据统计,ETV序贯Peg-IFN-α试验组共281例患者,ETV对照组382例患者,HBeAg转换试验组83例,对照组22例。采用固定效应模型进行系统评价与分析,ETV序贯Peg-IFN-α试验组的HBeAg转换率高于ETV对照组, 差异有统计学意义[OR=8.14,95%CI(4.59,14.42),Z=7.18,P<0.001]。并进行敏感性分析,在删除发生数为0的研究后,总体OR为6.77(3.74, 12.25), 仍在原可信区间内,即发生数为0的研究对合并效应量无明显影响,见图 5。
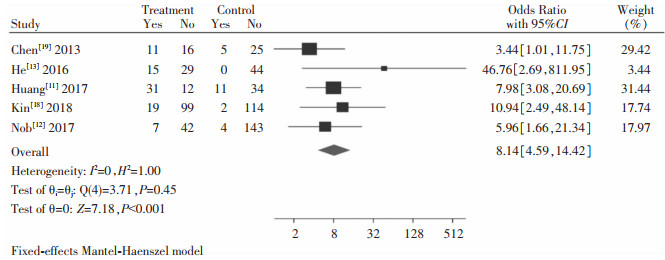 |
| 图 5 HBeAg转换率系统评价与分析结果 Figure 5 Systematic assessment and analysis results of HBeAg conversion rate |
纳入研究中共有7篇文献[8, 11-14, 18-19]在治疗48周时对HBeAg清除率进行了数据统计,ETV序贯Peg-IFN-α试验组共460例患者,ETV对照组570例患者,HBeAg清除率试验组有113例,对照组49例。采用随机效应模型进行系统评价与分析,ETV序贯Peg-IFN-α组的HBeAg清除率高于ETV对照组,差异有统计学意义[OR=3.22,95%CI(2.22,4.67),Z=6.15,P<0.001],见图 6。
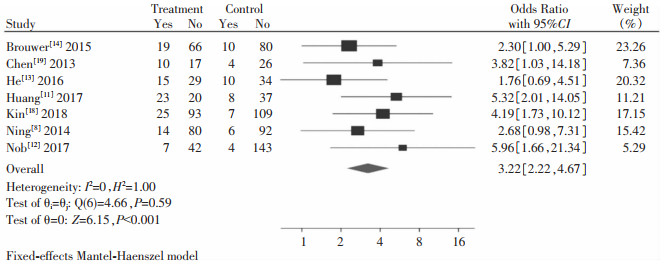 |
| 图 6 HBeAg清除率系统评价与分析结果 Figure 6 Systematic assessment and analysis results of HBeAg clearance rate |
HBV感染呈世界性流行,慢性感染者高达数亿,全球每年约有88.7万人死于HBV感染相关性疾病。我国属于乙型肝炎高发区,一般人群HBsAg流行率达5%~6%,严重阻碍了社会、经济的发展。通过积极抗病毒治疗能明显降低乙型肝炎病毒感染率,进一步降低患者肝硬化、肝癌等HBV感染相关疾病风险。目前用于抗病毒治疗的两类药物,核苷(酸)类似物和干扰素,其中ETV和Peg-IFN-α应用最广泛,单用其中一种药物治疗慢性乙型肝炎其临床治愈率低,据报道ETV序贯Peg-IFN-α能明显提高临床治愈率,但是目前关于这方面的系统评价缺乏,本研究所纳入的临床数据进一步更新,随访时间更长,达到了48周,评价指标更完善,从HBsAg转换率、HBsAg清除率、HBeAg转换率、HBeAg清除率四个方面来评价与分析。
本系统评价与分析为探讨ETV与ETV序贯Peg-IFN-α在治疗慢性乙型肝炎中的临床疗效对比,选取1 250例ETV经治获得病毒学应答的患者为研究对象,ETV序贯PEG-IFN-α试验组较ETV对照组在48周时获得了更高的抗病毒疗效,试验组的HBsAg转换率[OR=11.65, 95%CI(4.79, 28.32)]、HBsAg清除率[OR=11.65,95%CI(4.33,31.32)]、HBeAg转换率[OR=8.14,95%CI(4.59,14.42)]、HBeAg清除率[OR=3.22,95%CI(2.22,4.67)]均高于对照组,差异均有统计学意义(均P<0.001),说明ETV序贯PEG-IFN-α治疗较单用ETV在第48周时能获得更高的HBsAg转换率、HBsAg清除率、HBeAg转换率、HBeAg清除率。有研究[20-21]同样也证实ETV序贯干扰素治疗慢性乙型肝炎能获得更高的临床治愈率,但Hu等[22]研究称ETV治疗12周后序贯PEG-IFN-α,治疗结束时序贯或联合PEG-IFN-α组的HBeAg阴转率、HBV-DNA阴转率与ETV单药治疗组比较,差异无统计学意义,分析其原因可能与研究对象中部分患者ETV经治是否获得病毒学应答有关,HBV-DNA转阴可以促使机体免疫功能的恢复, 而且与纳入对象是否有肝脏炎症(ALT是否正常),有无肝脏纤维化均相关。研究[23-24]报道经核苷(酸)类似物治疗获得病毒学应答的HBeAg阳性患者序贯长效干扰素治疗,HBeAg血清学转换率可达40%左右,而ETV单药治疗1年HBeAg血清学转换率仅为16%~22%。综上所述,对核苷(酸)类似物治疗后获得病毒学应答的患者序贯长效干扰素治疗,可提高HBsAg、HBeAg血清学转换率和清除率。
ETV与干扰素序贯治疗,克服了单用ETV或干扰素临床治愈率低的缺陷,明显提高治疗期间的病毒学应答率,但多数研究结果均基于单中心、小样本研究。本系统评价与分析仍存在以下不足之处:第一,所纳入研究对象多为肝功能较好的患者,可能产生选择性偏倚或研究偏倚;第二,纳入研究中提到的随机分配,其随机序列的方法不明确,是否隐藏分组未描述;第三,慢性乙型肝炎的抗病毒治疗为长期过程,治疗的效果需要长期随访观察,本研究随访时间为48周,但仍可进一步延长随访时间。
本文通过系统评价与分析发现,对于经ETV获得病毒学应答的慢性乙型肝炎患者,序贯Peg-IFN-α是一个更好的治疗选择,然而,有必要开展更多多中心、高质量、大样本的随机对照试验研究以及进一步延长随访时间、拓宽纳入标准来进一步丰富ETV序贯Peg-IFN-a治疗疗效优于单用ETV的循证医学证据。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
World Health Organization. Hepatitis B[EB/OL]. (2022-06-24)[2022-08-01]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b.
|
| [2] |
Liu J, Liang WN, Jing WZ, et al. Countdown to 2030: eliminating hepatitis B disease, China[J]. Bull World Health Organ, 2019, 97(3): 230-238. DOI:10.2471/BLT.18.219469 |
| [3] |
Surana P, Kapuria D, Broadwell C, et al. Longitudinal effects of nucleos(t)ide analogue therapy in chronic hepatitis B patients and the utility of non-invasive fibrosis markers during treatment: a single-center experience for up to 17 years[J]. Antiviral Res, 2019, 168: 61-67. DOI:10.1016/j.antiviral.2019.05.007 |
| [4] |
Liu F, Liu ZR, Li T, et al. Varying 10-year off-treatment responses to nucleos(t)ide analogues in patients with chronic hepatitis B according to their pretreatment hepatitis B e antigen status[J]. J Dig Dis, 2018, 19(9): 561-571. DOI:10.1111/1751-2980.12654 |
| [5] |
European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. DOI:10.1016/j.jhep.2017.03.021 |
| [6] |
Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599. DOI:10.1002/hep.29800 |
| [7] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎临床治愈(功能性治愈)专家共识[J]. 中华肝脏病杂志, 2019, 27(8): 594-603. Chinese Society of Infectious Disease Chinese Society of Hepatology, Chinese Medical Association. The expert consensus on clinical cure (functional cure) of chronic hepatitis B[J]. Chinese Journal of Hepatology, 2019, 27(8): 594-603. DOI:10.3760/cma.j.issn.1007-3418.2019.08.003 |
| [8] |
Ning Q, Han MF, Sun YT, et al. Switching from entecavir to PegIFN alfa-2a in patients with HBeAg-positive chronic hepatitis B: a randomised open-label trial (OSST trial)[J]. J He-patol, 2014, 61(4): 777-784. |
| [9] |
中华医学会肝病学分会肝炎学组, 中华肝脏病杂志. 非一线核苷(酸)类似物经治慢性乙型肝炎患者治疗策略调整专家共识[J]. 中华肝脏病杂志, 2019, 27(5): 343-346. Hepatitis Group, Chinese Society of Hepatology, Chinese Medical Association, Chinese Journal of Hepatology. An expert consensus for the adjustment of treatment strategies in paints with chronic hepatitis B treated with non-first-line nucleos(t)ide analogues[J]. Chinese Journal of Hepatology, 2019, 27(5): 343-346. DOI:10.3760/cma.j.issn.1007-3418.2019.05.004 |
| [10] |
贾晓艳, 程勇前, 张政, 等. 核苷(酸)类似物序贯/序贯联合聚乙二醇干扰素治疗HBeAg阳性慢性乙型肝炎的Meta分析[J]. 中国感染控制杂志, 2017, 16(10): 909-915. Jia XY, Cheng YQ, Zhang Z, et al. Meta analysis on nucleo(s)tide analogues sequential/sequential combined with pegylated interferon for the therapy of HBeAg-positive chronic hepatitis B[J]. Chinese Journal of Infection Control, 2017, 16(10): 909-915. DOI:10.3969/j.issn.1671-9638.2017.10.004 |
| [11] |
Huang J, Zhang K, Chen WL, et al. Switching to PegIFNα-2b leads to HBsAg loss in patients with low HBsAg levels and HBV DNA suppressed by NAs[J]. Sci Rep, 2017, 7(1): 13383. DOI:10.1038/s41598-017-13747-9 |
| [12] |
Tamaki N, Kurosaki M, Kusakabe A, et al. Hepatitis B surface antigen reduction by switching from long-term nucleoside/nucleotide analogue administration to pegylated interferon[J]. J Viral Hepat, 2017, 24(8): 672-678. DOI:10.1111/jvh.12691 |
| [13] |
He LT, Ye XG, Zhou XY. Effect of switching from treatment with nucleos(t)ide analogs to pegylated interferon α-2a on viro-logical and serological responses in chronic hepatitis B patients[J]. World J Gastroenterol, 2016, 22(46): 10210-10218. DOI:10.3748/wjg.v22.i46.10210 |
| [14] |
Brouwer WP, Sonneveld MJ, Xie Q, et al. Peginterferon add-on results in more HBsAg decline compared to monotherapy in HBeAg-positive chronic hepatitis B patients[J]. J Viral He-pat, 2016, 23(6): 419-426. DOI:10.1111/jvh.12468 |
| [15] |
许烂漫, 朱垠, 徐洁, 等. 恩替卡韦联合或序贯聚乙二醇干扰素α-2b对慢性乙型病毒性肝炎核苷经治患者的疗效及安全性分析[J]. 现代实用医学, 2021, 33(6): 730-732. Xu LM, Zhu Y, Xu J, et al. Efficacy and safety analysis of entecavir combined with or sequentially peG-interferon-2b on nucleoside of chronic viral hepatitis B after treatment[J]. Modern Practical Medicine, 2021, 33(6): 730-732. DOI:10.3969/j.issn.1671-0800.2021.06.012 |
| [16] |
Li GJ, Yu YQ, Chen SL, et al. Sequential combination therapy with pegylated interferon leads to loss of hepatitis B surface antigen and hepatitis B e antigen (HBeAg) seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term entecavir treatment[J]. Antimicrob Agents Chemother, 2015, 59(7): 4121-4128. DOI:10.1128/AAC.00249-15 |
| [17] |
Yan L, Zhu CW, Li J, et al. Entecavir add-on or switch-to pegylated interferon improves HBsAg clearance in HBe antigen negative chronic hepatitis B patients[J]. Infect Drug Resist, 2018, 11: 2001-2009. DOI:10.2147/IDR.S175707 |
| [18] |
Liem KS, van Campenhout MJH, Xie Q, et al. Low hepatitis B surface antigen and HBV DNA levels predict response to the addition of pegylated interferon to entecavir in hepatitis B e antigen positive chronic hepatitis B[J]. Aliment Pharmacol Ther, 2019, 49(4): 448-456. DOI:10.1111/apt.15098 |
| [19] |
陈学福, 陈小苹, 马晓军, 等. 序贯聚乙二醇干扰素α-2a治疗恩替卡韦经治未达满意终点乙型肝炎的疗效[J]. 中华肝脏病杂志, 2013, 21(7): 502-505. Chen XF, Chen XP, Ma XJ, et al. HBeAg seroconversion achieved by sequential peginterferon alfa-2a therapy in chronic hepatitis B patients with unsatisfactory end point following entecavir treatment[J]. Chinese Journal of Hepatology, 2013, 21(7): 502-505. DOI:10.3760/cma.j.issn.1007-3418.2013.07.007 |
| [20] |
Wu FP, Yang Y, Li M, et al. Add-on pegylated interferon augments hepatitis B surface antigen clearance vs continuous nucleos(t)ide analog monotherapy in Chinese patients with chronic hepatitis B and hepatitis B surface antigen ≤ 1 500 IU/mL: an observational study[J]. World J Gastroenterol, 2020, 26(13): 1525-1539. DOI:10.3748/wjg.v26.i13.1525 |
| [21] |
Hu P, Shang J, Zhang WH, et al. HBsAg loss with peg-interferon alfa-2a in hepatitis B patients with partial response to nucleos(t)ide analog: new switch study[J]. J Clin Transl Hepatol, 2018, 6(1): 25-34. |
| [22] |
Hu Y, Xu C, Xu B, et al. Safety and efficacy of telbivudine in late pregnancy to prevent mother-to-child transmission of he-patitis B virus: a multicenter prospective cohort study[J]. J Viral Hepat, 2018, 25(4): 429-437. DOI:10.1111/jvh.12834 |
| [23] |
Chen SY, Zhou JL, Wu XN, et al. Comparison of fibrosis regression of entecavir alone or combined with pegylated interferon alpha2a in patients with chronic hepatitis B[J]. Hepatol Int, 2021, 15(3): 611-620. DOI:10.1007/s12072-021-10162-1 |
| [24] |
Huang ZB, Zhao SS, Huang Y, et al. Comparison of the efficacy of lamivudine plus adefovir versus entecavir in the treatment of lamivudine-resistant chronic hepatitis B: a systematic review and Meta-analysis[J]. Clin Ther, 2013, 35(12): 1997-2006. DOI:10.1016/j.clinthera.2013.10.002 |



