Actinotignum schaalii(A. schaalii,曾用名Actinobaculium Schalii),1997年由Lawson等[1]首次报道,归入Actinobaculum属。2015年Yassin等[2]将Actinobaculium schaalii与Actinobaculium urinale重新归入Actinotignum属,该属现包括Actinotignum schaalii、Actinotignum sanguinis和Actinotignum urinale,其中A. schaalii报道引起的感染最多。该菌为革兰阳性球杆菌,是一种新型条件致病菌,兼性厌氧,需在5% CO2或厌氧气体环境中培养,生长缓慢,培养48~72 h后呈细小、灰白色菌落。笔者从1例急性尿潴留患者血培养标本中检出A. schaalii,结合文献复习,报告如下。
1 病例报告 1.1 病史患者,男性,80岁,汉族,以“前列腺增生,急性尿潴留”于2022年1月24日收治入院。自诉近三月来,出现尿急、尿频和夜尿,平均5~6次/晚,无腰痛不适,无畏寒、发热,无咳嗽、咯痰,无心慌、胸闷,粪便成形,无血便,未引起重视,未治疗。入院前2 d出现无诱因下腹部胀痛和尿排出障碍。入院体格检查:体温36.5℃,血压141/64 mmHg,身高160 cm,体重55 kg,营养良好;皮肤及黏膜无瘀斑及出血点,浅表淋巴结未见肿大;双侧瞳孔等大等圆,结膜无充血,巩膜无黄染,对光反射正常;口唇正常;颈软,无抵抗,气管居中;呼吸20次/分,双肺呼吸音正常,未闻及湿啰音;心率99次/分,律齐,心音可,未闻及病理性杂音;腹部饱满,触软,肝脾肋下未触及;肠鸣音正常;双肾区无明显红肿及隆起,双侧肋脊角无压痛,双肾下极未触及,双肾区无明显叩痛,双肾区未闻及血管杂音,沿双侧输尿管行程区无压痛,耻骨上膀胱区无明显充盈及叩痛。阴茎无畸形,导尿管在位,引流尿液淡黄清亮,尿道外口无红肿及分泌物,阴囊及内容物未触及异常;脊柱四肢正常。直肠指诊:前列腺II度增大,质韧,表面光滑,未扪及结节,中央沟变浅,无触压痛,肛门括约肌张力正常。
1.2 辅助检查血常规白细胞10.88×109/L,中性粒细胞9.77×109/L,中性粒细胞百分比89.8%;C-反应蛋白186.55 mg/L;尿常规潜血4+, 尿蛋白2+;降钙素原65.42 ng/mL,前列腺特异抗原25.28 ng/mL,游离前列腺特异抗原4.75 ng/mL,复合前列腺特异抗原20.53 ng/mL;天门冬氨基酸转移酶55.83 U/L,胆碱酯酶4 801.9 U/L,总蛋白52.31 g/L,清蛋白32.14 g/L,肌酐121.72 μmol/L,β2-微球蛋白3.25 mg/L,其余指标正常。泌尿道超声检查结果:(1)右肾囊肿伴囊壁钙化;(2)膀胱壁增厚;(3)前列腺增大并钙化;(4)前列腺回声不均匀。经腹前列腺超声(前列腺、双侧精囊)检查结果: 前列腺增生、肥大并钙化;胸部CT平扫示: (1)双肺肺气肿;(2)双侧胸膜增厚并钙化;(3)主动脉及冠状动脉硬化;(4)胸椎退行性改变;(5)左侧锁骨陈旧性骨折可能;(6)肝内多发囊肿可能。
1.3 治疗经过以静滴乐伽和糖盐,防止电解质失衡;以哈乐、保列治抗前列腺增生治疗;给予头孢他啶静脉滴注5 d,无感染症状后出院。
2 病原体鉴定 2.1 标本来源患者于1月25日凌晨采集两套血培养,置于BD FX血培养仪中培养,两套报阳时长分别为40 h 35 min、48 h 20 min,直接涂片革兰染色镜检,可见革兰阳性球杆菌,见图 1。同时转种于哥伦比亚血琼脂培养基(迪景)、麦康凯培养基和普通巧克力培养基(庞通),置于5%的CO2气体环境中培养,观察48、72 h的菌落形态。
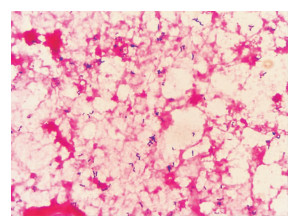 |
| 图 1 血培养直接涂片革兰染色 Figure 1 Direct blood culture smear by Gram staining |
培养48 h,哥伦比亚血琼脂和普通巧克力培养基上可见细小菌落;麦康凯培养基上未见菌落生长。培养72 h后,哥伦比亚血琼脂培养基上可见白色、干燥、无溶血环小菌落,见图 2。涂片为革兰阳性杆菌,见图 3。
 |
| A:培养48 h菌落形态;B:培养72 h菌落形态。 图 2 哥伦比亚血琼脂培养基上A. schaalii的菌落形态 Figure 2 Colony morphology of A. schaalii on Columbia blood agar medium |
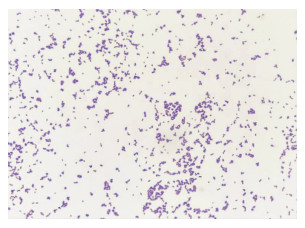 |
| 图 3 A. schaalii分离株革兰染色结果 Figure 3 Gram-staining of isolated strains of A. schaalii |
采用安图Autof ms1000微生物质谱仪进行鉴定,菌株的处理方法采用提取法。取1 μL标本凃于靶板上,加入1 μL基质液,待完全干燥后,质谱仪进行鉴定。重复以上操作检测5次。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)鉴定结果显示均为A. schaalii,质谱峰清晰可见,特征峰鲜明,得分为9.29分(9.0以上即为种水平置信),见图 4。
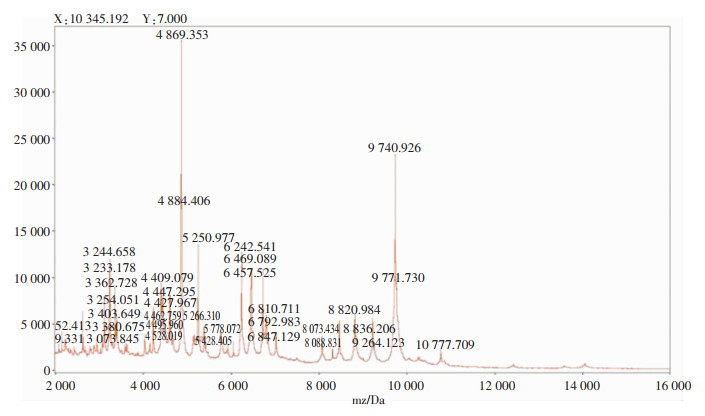 |
| 图 4 A. schaalii分离株质谱图 Figure 4 Mass spectrogram of isolated strains of A. schaalii |
采用E-test方法[参考美国临床和实验室标准协会(CLSI)和欧洲抗菌药敏感性试验委员会(EUCAST)厌氧菌药敏实验标准]进行药敏试验,结果显示A. schaalii对青霉素、阿莫西林/克拉维酸、亚胺培南、米诺环素、头孢曲松和阿奇霉素的MIC值都较低,而喹诺酮类和复方磺胺甲
| 表 1 A. schaalii药敏结果 Table 1 Antimicrobial susceptibility results of A. schaalii |
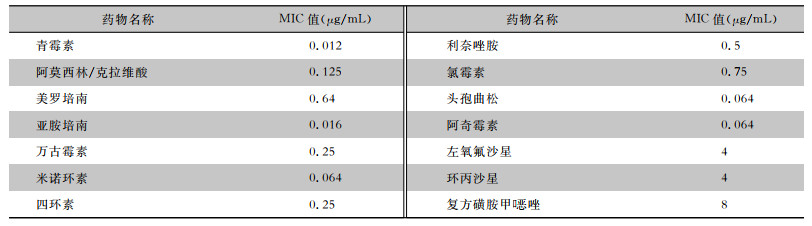
|
A. schaalii是Actinotignum属中一种新兴的共生泌尿病原体[3-5],培养要求苛刻,须在富含血液的培养基和5%的CO2或厌氧环境才能生长,大多数实验室将接种尿的培养基放在普通温箱中培养,加上鉴定技术有限,很难将其分离鉴定。近年来随着对A. schaalii关注度的提高和鉴定技术的发展,关于A. schaalii导致的尿路感染和侵袭性感染报道越来越多。Kristiansen等[6]研究表明,A. schaalii具有编码附着菌毛的基因,该菌毛极大地增强了A. schaalii在泌尿道上皮细胞定植的能力,常定植于老年患者和儿童的泌尿系统。Kotásková等[7]研究297份尿培养结果发现,虽然A. schaalii常与Propionimicrobium lymphophilum、Fusobacterium nucleatum、韦荣氏球菌属和摩根摩根菌属共生定植,促进炎症发展,但与肠杆菌和葡萄球菌属的生长相互排斥,所以肠杆菌和葡萄球菌常见于A. schaalii阴性标本中。Bank等[8]采用实时荧光PCR检测252例(其中包括177例住院患者和75例门诊患者)各年龄段患者常规尿液中A. schaalii,结果在60岁以上的患者中,22%检出A. schaalii,菌量约为104~107 CFU/mL, 表明A. schaalii是尿液中一种常见定植菌。Andersen等[9]为了解A. schaalii在儿童尿液中的定植和感染情况,使用实时荧光PCR检测29名儿童的尿标本,结果7名儿童尿液中检出了A. schaalii,菌量约为104~107 CFU/mL, 表明儿童尿液中亦有A. schaalii定植,尤其是使用了尿不湿的儿童及新生儿。Lotte等[10]回顾分析172份2015年以前检出A. schaalii的病例,结果泌尿系统感染121例(70%)、菌血症33例(19%)、脓肿12例(7%)、蜂窝组织炎2例(1.5%)、椎间盘炎2例(1.5%)、心内膜炎1例(0.5%)和坏疽1例(0.5%);121例泌尿系统感染患者平均年龄大于60岁,大多有泌尿系统疾病或潜在的泌尿系统感染易感因素,其中68例为膀胱炎或前列腺炎,51例为肾盂肾炎。
A. schaalii不仅在尿培养中检出率较高,血培养中检出也较多。Bank等[11]分析丹麦MiBa数据库中98例A. schaalii菌血症病例,发现91.8%的菌血症患者年龄大于60岁,多为老年男性泌尿道感染患者。Pedersen等[12]回顾性分析瑞典南部57例Actinotignum属菌血症,其中53例为A. schaalii,该组菌血症患者年龄中位数82岁,72%为男性,63%有泌尿系统疾病。Hashimoto等[13]关于A. schaalii菌血症的综述中,106例A. schaalii菌血症患者中有65例来源于泌尿系统。依据文献推测A. schaalii菌血症的可能易感因素为:(1)老年男性;(2)泌尿系统感染者;(3)潜在的泌尿系统感染的易感因素。
A. schaalii导致其他部位感染也有报道。Jacquier等[14]报道1例由A. schaalii引起的膝关节假体感染,患者为84岁男性,有前列腺增生和慢性尿潴留病史,并一直有尿痛症状,推测该感染可能是由于尿路感染入血扩散而致。Bryan等[15]从1例27岁女性腹腔内感染积液标本分离出A. schaalii,该患者曾接受尿失禁灌肠和Monti手术(需要频繁导尿)治疗泌尿系统疾病,虽然尿培养阴性,推测该感染来源于泌尿系统。此外,与A. schaalii相关的最新临床病例还包括脓肿[16],但这些病例患者的平均年龄小于其他部位的患者,126例平均年龄为31.1岁(年龄9月至80岁),部分老年患者有慢性病及免疫缺陷病等。Vázquez-Pérez等[17]报道首例由A. schaalii引起的儿童生殖器溃烂病例,可能是生殖器区长期的潮湿和厌氧环境,促进了A. schaalii生长,引起相关的生殖器疾病。
A. schaalii对β-内酰胺类、大环内酯类、四环素、替考拉宁、利奈唑胺、利福平、呋喃妥因、庆大霉素、利奈唑胺和万古霉素敏感,对复方磺胺甲
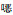
综上所述,A. schaalii为兼性厌氧的革兰阳性杆菌,常见于尿路感染或者患有潜在泌尿道疾病的老年患者,是一种新型的尿路感染病原体,常与一些细菌共生定植[7],易作为污染菌处理。大多数实验室没有微生物质谱仪,不能准确地将其鉴定,导致其错误鉴定和漏检。当无明显诱因的老年慢性尿路感染患者经验性治疗无效,尿培养在普通培养下无细菌生长,而镜检出革阳性杆菌时,应考虑可能为A. schaalii感染,重新在5% CO2或厌氧环境下进行尿培养。目前对A. schaalii引起的感染治疗尚无指南和共识,可考虑β-内酰胺类药物连续使用两周以上。本病例为前列腺增生和尿潴留的患者,血培养检出A. schaalii,推测可能是由于尿路感染引起的血流感染。尿培养阴性,是由于培养条件不是5% CO2和厌氧环境,导致A. schaalii漏检。当前A. schaalii感染相关报道以欧美居多,国内较少,目前仅有1例自尿标本分离的A. schaalii报道[20],本例是国内首次血培养分离出A. schaalii的报道。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Lawson PA, Falsen E, Akervall E, et al. Characterization of some Actinomyces-like isolates from human clinical specimens: reclassification of Actinomyces suis (soltys and spratling) as Actinobaculum suis comb. nov. and description of Actinobaculum schaalii sp. nov[J]. Int J Syst Bacteriol, 1997, 47(3): 899-903. DOI:10.1099/00207713-47-3-899 |
| [2] |
Yassin AF, Spröer C, Pukall R, et al. Dissection of the genus Actinobaculum: reclassification of Actinobaculum schaalii Lawson et al. 1997 and Actinobaculum urinale Hall et al. 2003 as Actinotignum schaalii gen. nov., comb. nov. and Actinotignum urinale comb. nov., description of Actinotignum sanguinis sp. nov. and emended descriptions of the genus Actinobaculum and Actinobaculum suis; and re-examination of the culture deposited as Actinobaculum massiliense CCUG 47753T (=DSM 19118T), revealing that it does not represent a strain of this species[J]. Int J Syst Evol Microbiol, 2015, 65(Pt 2): 615-624. |
| [3] |
Hilt EE, McKinley K, Pearce MM, et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder[J]. J Clin Microbiol, 2014, 52(3): 871-876. DOI:10.1128/JCM.02876-13 |
| [4] |
Lewis DA, Brown R, Williams J, et al. The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults[J]. Front Cell Infect Microbiol, 2013, 3: 41. |
| [5] |
Siddiqui H, Nederbragt AJ, Lagesen K, et al. Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons[J]. BMC Microbiol, 2011, 11: 244. DOI:10.1186/1471-2180-11-244 |
| [6] |
Kristiansen R, Dueholm MS, Bank S, et al. Complete genome sequence of Actinobaculum schaalii strain CCUG 27420[J]. Genome Announc, 2014, 2(5): e00880-14. |
| [7] |
Kotásková I, Syrovátka V, Obručová H, et al. Actinotignum schaalii: relation to concomitants and connection to patients' conditions in polymicrobial biofilms of urinary tract catheters and urines[J]. Microorganisms, 2021, 9(3): 669. DOI:10.3390/microorganisms9030669 |
| [8] |
Bank S, Jensen A, Hansen TM, et al. Actinobaculum schaalii, a common uropathogen in elderly patients, Denmark[J]. Emerg Infect Dis, 2010, 16(1): 76-80. DOI:10.3201/eid1601.090761 |
| [9] |
Andersen LB, Bank S, Hertz B, et al. Actinobaculum schaalii, a cause of urinary tract infections in children?[J]. Acta Paediatr, 2012, 101(5): e232-e234. DOI:10.1111/j.1651-2227.2011.02586.x |
| [10] |
Lotte R, Lotte L, Ruimy R. Actinotignum schaalii (formerly Actinobaculum schaalii): a newly recognized pathogen-review of the literature[J]. Clin Microbiol Infect, 2016, 22(1): 28-36. DOI:10.1016/j.cmi.2015.10.038 |
| [11] |
Bank S, Søby KM, Kristensen LH, et al. A validation of the Danish microbiology database (MiBa) and incidence rate of Actinotignum schaalii (Actinobaculum schaalii) bacteraemia in Denmark[J]. Clin Microbiol Infect, 2015, 21(12): 1097.e1-1097.e4. DOI:10.1016/j.cmi.2015.08.006 |
| [12] |
Pedersen H, Senneby E, Rasmussen M. Clinical and microbiological features of Actinotignum bacteremia: a retrospective observational study of 57 cases[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(5): 791-796. DOI:10.1007/s10096-016-2862-y |
| [13] |
Hashimoto T, Ando M, Komiya K, et al. Presumed septic shock caused by Actinotignum schaalii bacteremia[J]. Intern Med, 2021, 60(12): 1915-1919. DOI:10.2169/internalmedicine.4351-19 |
| [14] |
Jacquier H, Benmansour H, Zadegan F, et al. Actinobaculum schaalii, a new cause of knee prosthetic joint infection in elderly[J]. Infection, 2016, 44(4): 547-549. DOI:10.1007/s15010-015-0864-9 |
| [15] |
Bryan A, Kirkpatrick LM, Manaloor JJ, et al. 16S rRNA deep sequencing identifies Actinotignum schaalii as the major component of a polymicrobial intra-abdominal infection and implicates a urinary source[J]. JMM Case Rep, 2017, 4(5): e005091. |
| [16] |
Maraki S, Evangelou G, Stafylaki D, et al. Actinotignum schaalii subcutaneous abscesses in a patient with hidradenitis suppurativa: case report and literature review[J]. Anaerobe, 2017, 43: 43-46. DOI:10.1016/j.anaerobe.2016.11.010 |
| [17] |
Vázquez-Pérez á, Santos-Pérez JL, Herrera-Goicoechea A, et al. Actinotignum schaalii and genital ulcers in a pediatric patient[J]. Microbiol Clin (Engl Ed), 2021, 39(9): 480-481. |
| [18] |
Barberis C, Budia M, Palombarani S, et al. Antimicrobial susceptibility of clinical isolates of Actinomyces and related genera reveals an unusual clindamycin resistance among Actinomyces urogenitalis strains[J]. J Glob Antimicrob Resist, 2017, 8: 115-120. DOI:10.1016/j.jgar.2016.11.007 |
| [19] |
Lotte L, Lotte R, Durand M, et al. Infections related to Actinotignum schaalii (formerly Actinobaculum schaalii): a 3-year prospective observational study on 50 cases[J]. Clin Microbiol Infect, 2016, 22(4): 388-390. DOI:10.1016/j.cmi.2015.10.030 |
| [20] |
李莎, 杜晶辉, 商希鹏, 等. 一株尿液标本分离获得Actinotignum schaalii的鉴定及生物学特性分析[J]. 天津医药, 2020, 48(8): 760-763. Li S, Du JH, Shang XP, et al. Identification and biological characteristics of Actinotignum schaalii isolated from urine[J]. Tianjin Medical Journal, 2020, 48(8): 760-763. |
| [21] |
Kotaskova I, Obrucova H, Malisova B, et al. Molecular techniques complement culture-based assessment of bacteria composition in mixed biofilms of urinary tract catheter-related samples[J]. Front Microbiol, 2019, 10: 462. DOI:10.3389/fmicb.2019.00462 |
| [22] |
Tuuminen T, Suomala P, Harju I. Actinobaculum schaalii: identification with MALDI-TOF[J]. New Microbes New Infect, 2014, 2(2): 38-41. DOI:10.1002/2052-2975.32 |
| [23] |
Stevens RP, Taylor PC. Actinotignum (formerly Actinobaculum) schaalii: a review of MALDI-TOF for identification of clinical isolates, and a proposed method for presumptive phenotypic identification[J]. Pathology, 2016, 48(4): 367-371. DOI:10.1016/j.pathol.2016.03.006 |



