传染性单核细胞增多症(infectious mononucleo- sis, IM) 是儿童常见的原发性EB病毒(EBV)感染疾病,发病的高峰年龄为4~6岁,患儿具有典型的临床“三联征”,即发热、咽峡炎和颈淋巴结肿大[1]。目前,临床对于儿童IM尚无特效治疗方法,一般以抗病毒治疗等对症处理为主。更昔洛韦是一种核苷类抗病毒药物,是当前儿童IM抗病毒治疗的常用药[2]。既往研究[3]表明,儿童IM的发生发展与机体细胞免疫和体液免疫功能失调密切相关。叉状头/翅膀状螺旋转录因子3(Foxp3)是CD4+CD25+调节性T细胞(CD4+CD25+Treg)的特异性转录因子,可通过直接调控多种基因来调节机体免疫应答[4]。重组人干扰素α1b(rhIFN-α1b)是我国第一个国际独创的基因工程新药,具有广谱抗病毒和免疫调节双重作用,以及高度安全性等特点,近年来已广泛应用于儿童IM的临床治疗[5]。本研究以2019年3月—2020年3月某院儿科收治的IM患儿为研究对象,观察rhIFN-α1b治疗前后患儿外周血单个核细胞(PBMC)中Foxp3信使核糖核酸(Foxp3 mRNA)表达水平、机体免疫功能及血清相关细胞因子水平的变化,探讨其作用机制,并与更昔洛韦常规治疗患儿比较,评价rhIFN-α1b在儿童IM治疗中的应用效果,现报告如下。
1 对象与方法 1.1 研究对象选取2019年3月—2020年3月某院儿科收治的98例IM患儿,使用简单随机数字表法将其随机分成干扰素组(n=49)和更昔洛韦组(n=49)。该研究经该院医学伦理委员会批准。
1.2 纳入与排除标准纳入标准:(1)满足IM诊断标准,年龄<14岁;(2)未合并心包炎、脑膜炎、脾破裂等严重并发症;(3)患儿法定监护人签署知情同意书;(4)入院前无抗病毒、免疫调节剂等相关药物治疗史。排除标准:(1)确诊为巨细胞病毒、弓形虫、人免疫缺陷病毒等其他因素所致的类IM者;(2)对rhIFN-α1b、更昔洛韦等本研究涉及药物中任何成分过敏者;(3)患有免疫缺陷病者;(4)有长期服用免疫抑制剂或糖皮质激素史者;(5)患儿和/或其家属依从性较差,无法配合本临床试验者;(6)合并重要脏器器质性疾病者。
1.3 诊断标准IM诊断标准参照《诸福棠实用儿科学(第8版)》标准执行[6],病程处于急性期。
1.4 治疗方法所有患儿均采取相同的一般治疗(包括充分卧床休息、防治脾破裂和营养支持治疗)及对症治疗(肝功能异常者给予护肝降酶治疗,合并细菌感染者予以敏感抗菌药物治疗,心肌酶谱异常者加用心肌营养药治疗,退热、镇静和对高热患儿酌情补液)。在此基础上,干扰素组给予注射用rhIFN-α1b(深圳科兴生物,规格10 μg/支,产品批号190106)雾化吸入治疗,每次将2 μg/kg加入2 mL等渗生理盐水中均匀混合,氧气驱动雾化吸入,治疗时间15 min/次,2次/d,疗程7 d。更昔洛韦组予以注射用更昔洛韦(湖北科益药业,规格0.15 g/支,产品批号12090107)静脉滴注治疗,每次将5 mg/kg加入100 mL等渗生理盐水中充分稀释后给药,持续滴注>1 h/次,2次/d(每次间隔12 h),疗程7 d。
1.5 疗效判定标准[7]显效:治疗3 d内体温开始下降,5 d内降至正常(腋温≤37.2℃),咽峡炎好转,肝、脾、浅表淋巴结缩小,外周血异型淋巴细胞比例<0.10,一般情况好。有效:治疗5 d内体温开始下降,7 d内降至正常,咽峡炎好转,浅表淋巴结缩小,外周血异型淋巴细胞比例下降,一般情况好转。无效:治疗7 d后腋温仍>37.2℃,外周血异型淋巴细胞比例无改变,肝、脾、淋巴结等均未缩小。总有效率=(显效例数+有效例数)/总例数×100%。
1.6 观察指标(1) 观察两组患儿临床症状、体征的改善时间,包括热程(腋温降至≤37.2℃)、咽峡炎好转时间、淋巴结缩小(直径缩小50%)时间、脾回缩时间和肝回缩时间。(2)根据患儿临床情况定期复查其明显异常的实验室指标,包括血常规(白细胞计数)、异型淋巴细胞比例、肝功能[包括丙氨酸氨基转移酶(ALT)]和心肌酶谱[包括肌酸激酶同工酶(CK-MB)]等,观察这些指标的恢复正常(复常)时间,并观察住院时间。(3)血液学指标检测:a. 分别于治疗前和治疗7 d后采患儿空腹静脉血9 mL。b. 运用实时荧光定量PCR仪(瑞士Roche公司,型号LightCycle 96)检测血清EBV-DNA载量,试剂盒(实时荧光定量PCR法)均由武汉明德生物提供,当EBV-DNA<500 copies/L时,则检测结果判定为阴性,并统计两组血清EBV-DNA阴转率。c. 使用美国BD公司生产的BD Accuri C6型流式细胞仪及配套试剂(直接免疫荧光法)检测外周血T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平。d. 采用实时荧光定量PCR仪检测PBMC中Foxp3 mRNA表达水平,实时荧光定量PCR试剂盒、逆转录试剂盒等试验所需试剂盒均购自日本Takara公司;Foxp3上游引物:TGAGCTGGCTGCAATTCTGG,下游引物:ATCTAGCTGCTCTGCATGAGGTGA;检测结果用2-△△Ct表示,其中△△Ct=(待检样品的目的基因平均Ct值与其看家基因平均Ct值差值)-(对照组的目的基因平均Ct值与其看家基因平均Ct值差值)。e. 使用生化分析仪(美国贝克曼库尔特公司,型号DXC600)及其配套试剂盒(免疫比浊法)检测血清免疫球蛋白(Ig)A、IgG含量。f.采用酶标仪(美国BIO-RAD公司,型号680)测定血清肿瘤坏死因子(TNF)-α、白介素(IL)-6、IL-2浓度,试剂盒(酶联免疫法)均购自上海酶联生物。以上操作均按说明书进行操作。(4)不良反应监测:观察两组患儿因治疗而出现的不良反应。
1.7 统计学分析应用统计软件SPSS 20.0处理数据,计量资料以(x±s)表示,组间和组内比较采用独立样本或配对样本t检验,计数资料以(%)表示,组间比较符合卡方检验者进行χ2检验,不符合卡方检验者进行Fisher’s确切概率检验。以P≤0.05为差异有统计学意义。
2 结果 2.1 一般资料98例IM患儿中,男性52例,女性46例;年龄1~13岁,平均年龄(6.41±2.27)岁;发病至入院时间1~7 d,平均时间(3.84±1.32)d。干扰素组患儿年龄为(6.07±2.42)岁,发病至入院时间为(4.05±1.37)d,血清EBV-DNA水平为(6.33±2.61)×104 copies/L;更昔洛韦组患儿年龄为(6.63±2.19)岁,发病至入院时间为(3.69±1.28)d,血清EBV-DNA水平为(6.81±2.45)×104 copies/L;两组基线资料比较,差异均无统计学意义(均P>0.05),具有可比性。见表 1。
| 表 1 两组患儿临床资料情况[例(%)] Table 1 Clinical data of two group of children (No. of cases [%]) |
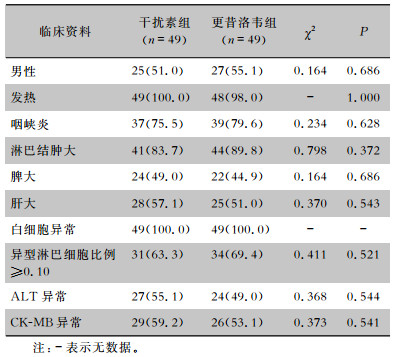
|
治疗7 d后,干扰素组总有效率高于更昔洛韦组(87.8% VS 71.4%),血清EBV-DNA阴转率高于更昔洛韦组(89.8% VS 73.5%),两组比较差异均有统计学意义(χ2值分别为4.020、0.045,均P<0.05)。见表 2。
| 表 2 两组患儿临床疗效及血清EBV-DNA阴转情况 Table 2 Clinical efficacy and negative conversion of serum EBV-DNA in two groups of children |
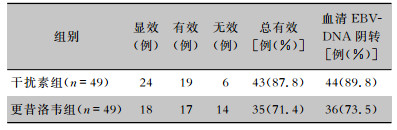
|
与更昔洛韦组患儿相比,干扰素组患儿的热程、咽峡炎好转时间及异常实验室指标(白细胞计数、异型淋巴细胞比例、ALT和CK-MB)复常时间和住院时间均明显缩短(均P<0.05)。两组患儿淋巴结缩小时间、脾回缩时间和肝回缩时间比较,差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 两组患儿临床症状、体征及实验室指标改善情况(x±s,d) Table 3 Improvement of clinical symptoms, signs and laboratory indexes in two groups of children (x±s, d) |
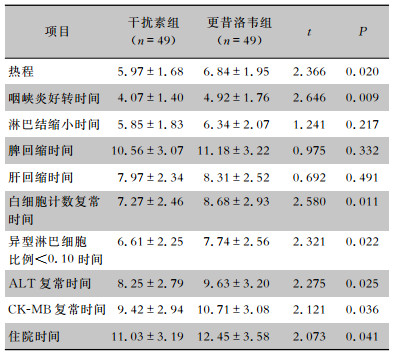
|
两组患儿治疗后外周血CD3+、CD8+水平均较本组治疗前明显下降(均P<0.05),外周血CD4+水平、CD4+/CD8+比值及PBMC中Foxp3 mRNA表达水平均高于本组治疗前(均P<0.05);但干扰素组的良性调控作用均更明显(P<0.05)。见表 4。
| 表 4 两组患儿外周血T淋巴细胞亚群水平及PBMC中Foxp3 mRNA表达水平(x±s) Table 4 Level of T lymphocyte subsets in peripheral blood and expression of Foxp3 mRNA in PBMC of two groups of children (x±s) |
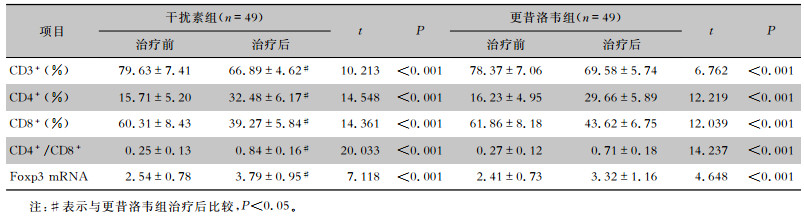
|
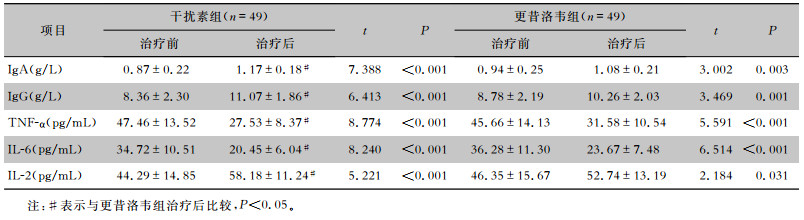
与治疗前相比,两组患儿治疗后血清IgA、IgG和IL-2浓度均明显升高(均P<0.05),血清TNF-α、IL-6水平则均明显下降(均P<0.05);但干扰素组的改善均更明显(P<0.05)。见表 5。
| 表 5 两组患儿血清体液免疫及相关细胞因子检测结果(x±s) Table 5 Detection results of serum humoral immunity and related cytokines in two groups of children (x±s) |
|
更昔洛韦组49例患儿中,发生中性粒细胞减少6例,血小板减少3例,肾损伤1例;干扰素组49例患儿中,出现恶心、中性粒细胞减少各1例。两组患儿不良反应均较轻微,其中更昔洛韦组患儿不良反应经对症处理后均恢复正常,干扰素组患儿不良反应未予以特殊处理便自行恢复。干扰素组不良反应率低于对照组(4.1% VS 20.4%,χ2=6.077,P=0.014)。
3 讨论IM是儿童常见的EBV感染性相关疾病,目前尚无特效治疗药物,大多数予以抗病毒治疗、免疫调节等对症治疗为主[8]。更昔洛韦是临床上常用的抗EBV感染药物之一,主要是通过抑制EBV多聚酶活性,终止EBV-DNA链的延伸,而产生抗EBV效应。一项Meta分析[9]表明,急性期IM应用更昔洛韦治疗有助于提高IM治疗有效率。不过部分IM患儿应用更昔洛韦治疗时存在效果欠佳,一方面是由于部分IM患儿不产生特异性的胸腺嘧啶激酶(更昔洛韦抗病毒的作用靶点),进而导致更昔洛韦无效;另一方面可能与B淋巴细胞内潜伏的EBV在复制时无需DNA多聚酶有关。同时更昔洛韦存在长期、潜在的生殖系统毒性和致癌性,因此在儿科人群中使用时应特别谨慎。
儿童免疫功能尚不成熟,当儿童受到EBV等病毒感染后,体内产生干扰素-α(IFN-α)的能力低下,体液中IFN-α含量明显不足,因此应尽早采用外源性IFN-α进行干预[10]。rhIFN-α1b属于生物治疗制剂,是儿童IM常用的广谱抗病毒药物及免疫调节剂之一,主要通过阻断EBV复制和增强机体免疫功能的双重作用,加快清除IM患儿体内的EBV,从而迅速、明显地缓解IM患儿症状,最终达到控制IM进展的目的[11]。目前rhIFN-α1b在治疗儿童IM时主要有两种给药方式,即肌内注射和雾化吸入,其中后者具有疗效高、儿童依从性高、安全性好、不良反应少等优点[12]。本研究显示儿童IM采取rhIFN-α1b雾化吸入治疗的总体疗效优于更昔洛韦静脉滴注治疗,前者能更快速清除患儿体内EBV,促进病毒转阴,加速患儿相关临床症状、体征和实验室指标的改善,缩短住院时间,与刘一波等[13]报道结果相近。从安全性评价来看,两组患儿均未发生严重的不良事件,其中更昔洛韦组患儿出现的不良反应主要是中性粒细胞减少、血小板减少和肾损伤,经对症处理后都立即缓解或消失,与单鸣凤等[14]报道结果基本一致;干扰素组患儿的不良反应为恶心、中性粒细胞减少,均未予以特殊处理,停药后自行恢复,与相关文献[12-13]报道的结果相符。同时,干扰素组不良反应发生率为4.1%,低于更昔洛韦组(20.4%)。提示rhIFN-α1b雾化吸入治疗方案的安全性高,还能有效避免因使用更昔洛韦而产生的长期潜在的生殖系统毒性等风险。
由EBV所致的机体免疫系统紊乱在儿童IM的整个病程中发挥着重要作用。Foxp3是促进CD4+CD25+Treg增殖分化和维持其功能的关键性调节基因,参与保持整体免疫细胞平衡的分子机制。研究[15]显示,IM患儿存在细胞免疫异常,主要表现为外周血CD3+、CD8+水平均明显升高,外周血CD4+水平和CD4+/CD8+比值均明显下降,其免疫功能失衡原因可能是体内CD4+CD25+Treg数量减少及Foxp3表达不足而引起的免疫抑制功能缺陷所致。王强等[16]报道结果显示,儿童IM急性期体内Foxp3 mRNA表达水平明显降低,继而引起细胞毒T淋巴细胞相关抗原-4(CTLA-4)的表达减少,从而削弱了CTLA-4对CD8+T淋巴细胞(杀伤性/抑制性)活化增殖的负性调节作用,造成CD8+T淋巴细胞(杀伤性/抑制性)异常增多,CD8+T淋巴细胞的杀伤功能亦可因Foxp3 mRNA表达下调而增强。本研究显示,干扰素组和更昔洛韦组均能有效纠正IM患儿外周血T淋巴细胞亚群紊乱,增强体液免疫功能,上调PBMC中Foxp3 mRNA表达水平,但干扰素组的良性调节作用均更明显。提示rhIFN-α1b可能通过进一步提高IM患儿PBMC中Foxp3 mRNA的表达水平,使其在改善细胞免疫及体液免疫功能异常方面发挥更明显的作用。
研究[17-18]指出,儿童IM的发生发展及转归与TNF-α、IL-6、IL-2等细胞因子密切相关,其中过度分泌的TNF-α可通过刺激其他促炎因子释放、趋化中性粒细胞向炎症部位聚集,并诱导中性粒细胞释放溶酶体酶和产生超氧阴离子等方式,参与机体组织的免疫炎性损伤[19]。IL-6是体内重要的炎性介质,也是介导天然免疫的少数免疫抑制因子,具有较强的免疫抗感染活性。Yan等[20]研究表明,IL-2是一种T淋巴细胞生长因子,能选择性上调Foxp3表达水平,在诱导免疫耐受过程中起着重要作用。据此推测IM患儿PBMC中Foxp3 mRNA表达水平下降,可能与体内TNF-α、IL-6、IL-2异常表达有关。本研究显示干扰素组和更昔洛韦组均能良性调控IM患儿血清中TNF-α、IL-6和IL-2的表达水平,但干扰素组对以上细胞因子的正性调控作用均更明显,或许是干扰素组患儿PBMC中Foxp3 mRNA表达水平进一步上调的重要原因之一。
综上所述,雾化吸入rhIFN-α1b治疗儿童IM的整体疗效及用药安全性均优于常规治疗方案(更昔洛韦静脉滴注),其作用可能与其明显上调IM患儿PBMC中Foxp3 mRNA的表达水平,从而纠正患儿异常的细胞免疫功能,提高其体液免疫水平有关。但本研究为单中心小样本研究,期待多中心大样本的研究加以验证。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pintos Pascual I. Infectious mononucleosis with unusual clinical manifestations[J]. Med Clin (Barc), 2017, 149(1): e3. DOI:10.1016/j.medcli.2016.09.005 |
| [2] |
李瑞娜, 刘小乖, 雷玲侠, 等. 更昔洛韦治疗儿童传染性单核细胞增多症的临床疗效[J]. 实用临床医药杂志, 2019, 23(6): 96-99. Li RN, Liu XG, Lei LX, et al. Clinical efficacy of ganciclovir in the treatment of infectious mononucleosis in children[J]. Journal of Clinical Medicine in Practice, 2019, 23(6): 96-99. |
| [3] |
Zhong HQ, Hu XR, Janowski AB, et al. Whole transcriptome profiling reveals major cell types in the cellular immune response against acute and chronic active Epstein-Barr virus infection[J]. Sci Rep, 2017, 7(1): 17775. DOI:10.1038/s41598-017-18195-z |
| [4] |
Lozano T, Gorraiz M, Lasarte-Cía A, et al. Blockage of Foxp3 transcription factor dimerization and Foxp3/AML1 interaction inhibits T regulatory cell activity: sequence optimization of a peptide inhibitor[J]. Oncotarget, 2017, 8(42): 71709-71724. DOI:10.18632/oncotarget.17845 |
| [5] |
申昆玲, 尚云晓, 张国成, 等. α干扰素在儿科临床合理应用专家共识[J]. 中华实用儿科临床杂志, 2018, 33(17): 1301-1308. Shen KL, Shang YX, Zhang GC, et al. Expert consensus on the rational application of interferon alpha in pediatrics[J]. Chinese Journal of Applied Clinical Pediatrics, 2018, 33(17): 1301-1308. DOI:10.3760/cma.j.issn.2095-428X.2018.17.006 |
| [6] |
江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学[M]. 8版. 北京: 人民卫生出版社, 2015: 916-918. Jiang ZF, Shen KL, Shen Y. Zhu Futang practice of pediatrics[M]. 8th ed. Beijing: People's Medical Publishing House, 2015: 916-918. |
| [7] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 3版. 北京: 科学出版社, 2007: 152-155. Zhang ZN, Shen T. Criteria for diagnosis and efficacy of hematological diseases[M]. 3rd ed. Beijing: Science Press, 2007: 152-155. |
| [8] |
Schwartzkopf J. Infectious mononucleosis[J]. JAAPA, 2018, 31(11): 52-53. DOI:10.1097/01.JAA.0000546488.73851.dd |
| [9] |
何英, 孙广超. 更昔洛韦治疗传染性单核细胞增多症有效性的Meta分析[J]. 广州医学院学报, 2008, 36(5): 46-51. He Y, Sun GC. Efficacy of ganciclovir in the treatment of infectious mononucleosis: a Meta-analysis[J]. Academic Journal of Guangzhou Medical College, 2008, 36(5): 46-51. DOI:10.3969/j.issn.1008-1836.2008.05.013 |
| [10] |
张国成, 尚云晓. 我国自主知识产权的重组人干扰素α1b在儿科的创新研究与临床实践(下)[J]. 国际儿科学杂志, 2019, 46(8): 541-544. Zhang GC, Shang YX. Innovative research and clinical application of recombinant human interferon α1b in pediatrics (vo-lume Ⅱ)[J]. International Journal of Pediatrics, 2019, 46(8): 541-544. DOI:10.3760/cma.j.issn.1673-4408.2019.08.001 |
| [11] |
马忠玉, 孙莉, 张晓军. 重组人干扰素α-1b联合更昔洛韦治疗小儿传染性单核细胞增生症疗效及对患儿免疫力影响分析[J]. 陕西医学杂志, 2018, 47(10): 1334-1336. Ma ZY, Sun L, Zhang XJ. Efficacy of recombinant human interferon α-1b combined with ganciclovir in the treatment of infantile infectious monocytosis and its effect on immunity[J]. Shaanxi Medical Journal, 2018, 47(10): 1334-1336. DOI:10.3969/j.issn.1000-7377.2018.10.035 |
| [12] |
邓胜勇, 蒲向阳. 干扰素α1b不同给药方式对小儿传染性单核细胞增多症的疗效比较[J]. 儿科药学杂志, 2019, 25(8): 10-13. Deng SY, Pu XY. Comparison of different administration methods of interferon α1b in children with infectious mononucleosis[J]. Journal of Pediatric Pharmacy, 2019, 25(8): 10-13. |
| [13] |
刘一波, 谷志勇. 用重组人干扰素α1b对传染性单核细胞增多症患儿进行雾化吸入治疗的效果研究[J]. 当代医药论丛, 2019, 17(10): 160-161. Liu YB, Gu ZY. Effect of aerosol inhalation on infective mono- nucleosis in children with recombinant human interferon α1b[J]. Contemporary Medical Symposium, 2019, 17(10): 160-161. DOI:10.3969/j.issn.2095-7629.2019.10.115 |
| [14] |
单鸣凤, 胡静, 穆原, 等. 更昔洛韦联合干扰素-α1b雾化吸入治疗儿童传染性单核细胞增多症的疗效[J]. 中华实用儿科临床杂志, 2017, 32(15): 1174-1178. Shan MF, Hu J, Mu Y, et al. Curative effect of ganciclovir combined with interferon-α1b inhalation in treating children with infectious mononucleosis[J]. Chinese Journal of Applied Clinical Pediatrics, 2017, 32(15): 1174-1178. DOI:10.3760/cma.j.issn.2095-428X.2017.15.014 |
| [15] |
赵青松, 方瑞, 刘亢亢, 等. CD4+CD25+调节性T淋巴细胞在儿童传染性单核细胞增多症的变化及作用[J]. 安徽医学, 2019, 40(2): 175-177. Zhao QS, Fang R, Liu KK, et al. Changes and roles of CD4+CD25+ regulatory T lymphocytes in children with infectious mononucleosis[J]. Anhui Medical Journal, 2019, 40(2): 175-177. DOI:10.3969/j.issn.1000-0399.2019.02.018 |
| [16] |
王强, 王佐凤, 曹玫, 等. FoxP3、CD4+CD25+调节性T细胞、TLR2和TLR9在儿童传染性单核细胞增多症中的变化[J]. 中国实验血液学杂志, 2013, 21(2): 469-473. Wang Q, Wang ZF, Cao M, et al. Changes of FoxP3, CD4+CD25+ regulatory T cells, TLR2 and TLR9 in children with infectious mononucleosis[J]. Journal of Experimental Hematology, 2013, 21(2): 469-473. |
| [17] |
陈梦佳. 诊断儿童EBV相关传染性单核细胞增多症敏感度和特异度指标探讨[D]. 衡阳: 南华大学, 2018. Chen MJ. To investigate the sensitivity and specificity of EBV related infectious mononucleosis in children[D]. Hengyang: University of South China, 2018. |
| [18] |
邓士勇, 陈明, 王旭东, 等. 联合检测HLA-G、IL-6在传染性单核细胞增多症患儿中的诊断价值[J]. 中国实验血液学杂志, 2018, 26(4): 1210-1214. Deng SY, Chen M, Wang XD, et al. Diagnostic value of combined detection of HLA-G and IL-6 in children with infectious mononucleosis[J]. Journal of Experimental Hematology, 2018, 26(4): 1210-1214. |
| [19] |
杨名, 赵扬, 陈广洁. TNF-α调节Treg细胞增殖与功能的研究进展[J]. 现代免疫学, 2013, 33(6): 505-509. Yang M, Zhao Y, Chen GJ. Research progress on TNF-α regu- lation of Treg cell proliferation and function[J]. Current Immunology, 2013, 33(6): 505-509. |
| [20] |
Yan JJ, Lee JG, Jang JY, et al. IL-2/anti-IL-2 complexes ameliorate lupus nephritis by expansion of CD4+CD25+Foxp3+ regulatory T cells[J]. Kidney Int, 2017, 91(3): 603-615. DOI:10.1016/j.kint.2016.09.022 |



