2. 中山大学附属第三医院检验科,广东 广州 510630;
3. 中山大学附属第三医院药剂科,广东 广州 510630
2. Department of Laboratory Medicine, Third Affi-liated Hospital of Sun Yat-sen University, Guangzhou 510630, China;
3. Department of Pharmacy, Third Affi-liated Hospital of Sun Yat-sen University, Guangzhou 510630, China
中枢神经系统(central nervous system,CNS)感染是常见的致残、致死性疾病,2017年全球患病人数约有1 730万例,伤残生活年数超过145万[1]。高效、准确的病原体诊断是正确治疗的前提[2],在CNS感染的诊治中发挥着关键作用。然而,常规的病原体检测技术,如直接镜检(革兰染色、墨汁染色等)、细菌/真菌培养、抗原抗体检测、传统核酸检测具有敏感性低、特异性差、通量低等缺点,难以满足临床的需求。文献报道,几乎有一半的脑膜脑炎患者没有确定病因[3],无明确病原体脑炎的病例更是高达69.8%[4]。快速分子诊断是新兴的病原体诊断技术,具有检测周期短、操作简单,可有效提高病原体诊断及指导抗微生物治疗等优点。近年来宏基因组第二代测序(metagenomics next-generation sequencing,mNGS)广泛运用于临床,提高了诊断水平,但存在缺乏检测标准、耗时长、背景菌干扰大等困境[5]。FilmArray meningitis/encephalitis (FA ME) panel是一款基于多重PCR (polymerase chain reaction)原理的自动化快速分子诊断设备,可在1 h检测14种最常见的急性CNS感染病原体。2015年FA ME被美国食品药品监督管理局批准用于临床,目前已在国外多个国家使用,但在我国大陆的使用较少。本研究以某院收治的疑似CNS感染患者为研究对象,回顾性分析FA ME及mNGS在CNS感染病原体诊断的效果,并结合细菌/真菌培养、病毒核酸/血清学结果进行比对分析,帮助临床医生正确认识以上方法的检测性能,提高CNS感染的诊断水平。
1 对象与方法 1.1 研究对象本研究为单中心、回顾性、观察性研究。以2020年6月—2021年1月中山大学附属第三医院收治的疑似CNS感染患者为研究对象,采取以下纳入与排除标准收集脑脊液(CSF)标本进行FA ME检测。纳入标准为:(1)有CNS感染的临床表现,如发热、头痛、呕吐或意识改变,神经定位体征等;(2)患者均已进行入院常规检测,如血常规、炎性指标、CSF常规及生化、CSF涂片或培养等项目;(3)CSF常规显示白细胞(WBC)升高;(4)主管医生认为不能排除CNS感染的患者。排除标准:外伤导致的CNS感染。病原学诊断细菌、真菌以培养为金标准,病毒以病毒核酸或血清学检测为金标准。研究最终纳入患者29例。所有的检测结果均由主管医疗组医生根据患者临床情况(症状、体征、实验室检查、影像学检查及治疗反应等)进行分析,作出最终诊断。本项目遵循的程序符合伦理学标准,已通过中山大学附属第三医院医学伦理委员会批准,伦理批件号为:中大附三医伦[2020]02-130-01,临床试验注册号为ChiCTR2000038045。
1.2 FA ME panelFA ME panel是利用巢式多重PCR技术进行的一站式多重病毒体分子检测系统。该设备集核酸提取、扩增及产物检测为一体,同时检测14种常见CNS感染的病原体,包括6种细菌(大肠埃希菌、流感嗜血杆菌、产单核细胞李斯特菌、脑膜炎奈瑟菌、无乳链球菌、肺炎链球菌),1种真菌(新生隐球菌)和7种病毒(巨细胞病毒、肠病毒、单纯疱疹病毒1型、单纯疱疹病毒2型、人疱疹病毒6型、人双埃可病毒、水痘带状疱疹病毒)。本研究严格按照厂家说明书使用FA ME进行检测。
1.3 mNGS本研究的mNGS检测结果来自于金域、予果生物、杰毅生物等测序公司。基本检测流程包括标本采集、核酸提取、文库建立和生物信息学分析。mNGS结果判断标准参考既往文献[6]。
1.4 实验室检查所有入组患者由主管医生根据临床情况安排入院常规检测项目,包括血常规、炎性指标、血清学检测、巨细胞病毒(cytomegalovirus,CMV)核酸、EB病毒核酸、CSF常规、CSF生化、隐球菌抗原、CSF涂片或培养等项目。各检测项目均根据规范的检测流程在医院检验科完成。
1.5 统计分析应用SPSS 25.0软件进行统计分析。患者临床特征、病原体检出情况采用例数及百分比表示,组间差异比较采用Fisher's确切概率检验,P≤0.05为差异具有统计学意义
2 结果 2.1 患者临床资料29例CNS疑似感染患者,男性23例(79.3%),24例(82.8%)患者年龄≥18岁。29例患者均进行FA ME检测,1例为无效检测。22例患者完成了mNGS检测。所有患者根据临床需要接受入院血常规、炎性指标、血清学、核酸、CSF常规及生化、CSF涂片或培养等院内检测。29例患者进行腰穿,其中22例(75.9%)患者在腰穿前使用了抗菌药物。26例(89.7%)患者为社区获得CNS感染,3例(10.3%)为医院术后相关感染。临床特征资料见表 1。
| 表 1 29例CNS患者临床特征 Table 1 Clinical characteristics of 29 patients with CNS |
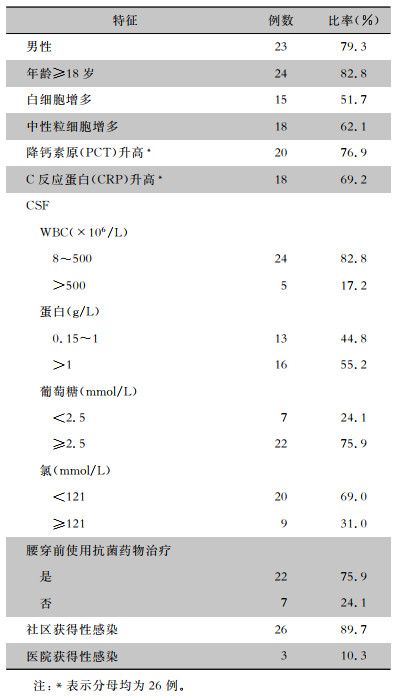
|
FA ME、mNGS细菌阳性率分别为7.1%、9.1%,数值高于细菌培养(3.4%),但差异无统计学意义(P=1.000)。FA ME检出的病原体分别为产单核细胞李斯特菌(2株)、大肠埃希菌(1株)、肺炎链球菌(1株),其中2株产单核细胞李斯特菌经临床综合判断后为假阳性。mNGS分别检出肺炎链球菌、草分枝杆菌、无乳链球菌各1株, 其中草分枝杆菌经临床判断为污染菌。培养获得耐甲氧西林金黄色葡萄球菌、藤黄微球菌及模仿葡萄球菌各1株,结合临床判断藤黄微球菌、模仿葡萄球菌为污染菌。1例患者mNGS及细菌培养阴性,FA ME检出大肠埃希菌,符合患者病情,判断为感染病原体。
真菌方面,FA ME、mNGS阳性率分别为10.7%、13.6%,均低于真菌培养(17.2%),差异具有统计学意义(P=0.003)。FA ME及培养检出的真菌均为隐球菌,mNGS检出隐球菌外,有1株为念珠菌属。其中念珠菌属经临床判断为假阳性。FA ME未检出的病例为隐球菌负荷最低的2例患者。
FA ME、mNGS对于病毒阳性率分别为3.6%、18.2%,高于院内病毒核酸/血清学检测(0)。FA ME检出巨细胞病毒(CMV)及单纯疱疹病毒2型各1株,其中CMV结果经临床综合判断后为假阳性。mNGS分别检出CMV 4株,人类(伽马)疱疹病毒4型、EB病毒及鼻病毒B各1株。其中2株CMV经临床判断为假阳性。1例患者mNGS及院内病毒核酸/血清学检测均为阴性,FA ME检出单纯疱疹病毒2型,经临床判断符合患者病情,判断为感染病原体。3例患者FA ME及院内病毒核酸/血清学检测为阴性, mNGS分别人类(伽马)疱疹病毒4型、鼻病毒B和CMV,经临床判断为感染病原体。见表 2、3。
| 表 2 FA ME、mNGS、金标准方法病原体检出情况 Table 2 Pathogens detected by FA ME panel, mNGS and the gold standard method |
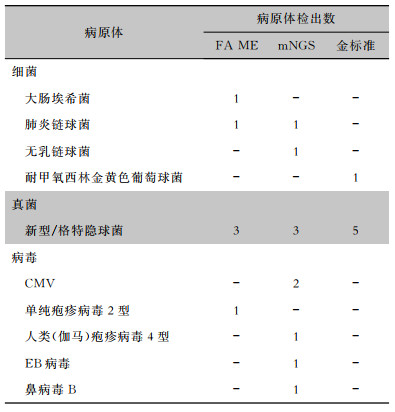
|
| 表 3 FA ME、mNGS、金标准方法病原体检出率 Table 3 Positive rates of pathogens detected by FA ME panel, mNGS and the gold standard method |
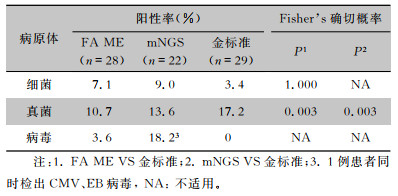
|
同时完成FA ME、mNGS和院内检测三种方法的21例患者,2例检出隐球菌,11例检测结果为阴性,三种检测方法结果一致。
3 讨论CNS感染是临床的危急重症,标本采集前普遍使用抗菌药物,加之CSF中病原菌负荷本身较低,传统的院内检测病原体方法确诊率很不理想。快速、准确的病原学诊断是目前研究的重要方向。近年来,一系列快速分子诊断设备的涌现使得许多疑难的、新的病原体诊断成为可能。本研究结果显示,FA ME在CNS感染病原体诊断中具有积极的作用。3例患者院内检测阴性,而FA ME检测明确了病原体,分别为大肠埃希菌、肺炎链球菌、单纯疱疹病毒2型感染。
病原学快速诊断使早期的特异性治疗成为可能,虽然FA ME很有吸引力,但需要注意假阳性及假阴性的情况。文献[7]报道,FA ME检出1型单纯疱疹病毒假阳性,导致结核性脑膜炎病例误诊为病毒性脑炎而延误病情。本研究结果亦显示,FA ME检出的2株产单核细胞李斯特菌及1株CMV经临床认定为假阳性。研究[3, 8-9]发现,FA ME在隐球菌诊断方面出现假阴性,甚至在隐球菌抗原、涂片及培养均获得阳性结果的病例中仍未能检出隐球菌。本组5例隐球菌感染病例中,FA ME检出率为60.0%,培养阳性率为60.0%,墨汁染色及隐球菌抗原阳性率均高达100%。因此,当怀疑隐球菌性脑膜炎时,建议使用细菌涂片、培养作为首选的检查方法。另一方面,FA ME包含自动化报告输出系统,检测完成后可自动报告结果,有研究发现自动化报告存在假阴性[10]。本组病例检测过程中有3例(1例大肠埃希菌及2例产单核细胞李斯特菌)原始报告呈假阴性。临床实践中不应盲目相信FA ME报告系统输出的结果,而应检查每个病原体靶标的溶解曲线后作出最后结论,必要时复查。特别是对于免疫抑制患者,FA ME的数据目前尚缺乏,在FA ME出现阳性结果时注意甄别是否为责任病原菌,而结果为阴性时也应慎重下结论,避免假阴性,不应盲目减少经验性治疗,以免延误病情[7, 11]。
本研究显示,产单核细胞李斯特菌及CMV是CNS感染中假阳性率最高的病原体。产单核细胞李斯特菌是一种革兰阳性杆菌,是重要的食源性病原体,可导致多种临床综合征,包括母婴感染、败血症和CNS感染等[12]。神经李斯特菌病是致命的CNS感染,研究显示仅39%的神经李斯特菌病患者存活并完全康复,长期的后遗症超过了细菌性脑膜炎和感染性脑炎[12-14]。产单核细胞李斯特菌对头孢类抗生素天然耐药,常规针对脑膜炎的经验性治疗不能充分治疗该菌引起的颅内感染,而传统培养的阳性率低[15],临床表现缺乏特异性[12],故神经李斯特菌病的诊断常常面临困境。有学者认为,FA ME检测产单核细胞李斯特菌病原是特别有利的,因为针对这些病原体的PCR检测在其他商业检测方法中不常用[3]。已有文献报道,培养阴性的CNS感染,FA ME快速诊断出产单核细胞李斯特菌脑干脑炎,进而及时采用特异性的抗菌治疗挽救了患者生命,同时减少了不必要的抗菌药物暴露[15]。然而,产单核细胞李斯特菌广泛存在于自然界中,腰穿操作、标本检测等过程中均可能受到环境污染,本研究中FA ME检出的2株李斯特菌均被证实为污染菌,无特异性抗李斯特菌治疗即好转。因此,临床实践中应特别注意结合临床和检测结果,进行综合判断。
CMV易引起潜伏感染,故CSF中容易被检测到。CSF中CMV的检出可能为原发感染,亦可能是潜伏感染或感染的再激活[16],是否为真正的责任病原体需综合临床情况。事实上,FA ME中的疱疹病毒,包括单纯疱疹病毒1型、单纯疱疹病毒2型、CMV、水痘-带状疱疹病毒、人疱疹病毒6型均可出现类似假阳性的情况,临床实践中应注意甄别[16]。另一方面,Hanson等[17]曾报道FA ME出现CMV假阴性的情况。本研究中有1例病例FA ME检测CMV阴性,mNGS检测阳性,而结合临床最终考虑为CMV脑膜脑炎。研究发现,FA ME的病毒检测敏感性低于单基因PCR检测[18],因此,推测该假阴性的结果可能由样本中病毒载量低导致,亦可能受限于FA ME对病毒的检测性能[19]。
FA ME主要针对社区获得性CNS感染病原体,不适合用于院内感染的CSF标本[20],有学者认为医院或术后脑膜炎的患者不应进行FA ME检测[7]。本组3例医院获得的CNS感染病例FA ME检测均为阴性,亦支持该观点。
mNGS是目前临床上广泛使用的新型病原学诊断手段。通过对临床样本的DNA或RNA进行鸟枪法测序,可以无偏倚地检测多种病原微生物,但因价格较高,操作过程复杂,检测流程及结果判读缺乏统一的标准等原因,导致推广受到一定的限制。尚无官方机构正式批准的适应证及推荐领域, 结果原则上需要其他方法验证,不能单独作为病原学确诊或排除的证据[21]。在CNS感染中,mNGS已成功检测到多种新发及少见病原体,提高了病原体的检出率[22],目前被推荐为急性CNS感染的二线首选及慢性CNS感染的首选检测手段[23]。本研究结果显示,mNGS较细菌培养具有更高的阳性率,尤其在病毒检测方面优势突出,但亦存在假阴性的情况(单纯疱疹病毒2型、大肠埃希菌及隐球菌)。因此临床实践中应根据患者的病情个体化选择检测方案。
以往研究FA ME在浙江及上海医疗机构收治的儿童(小于18岁)CNS感染诊断中的效果,显示FA ME在CNS感染诊断中的运用前景[24-25]。本研究对象多来自成人,82.8%患者大于18岁,且来自南方地区,是FA ME在大陆真实世界中为数不多的实践研究。如今mNGS在我国已广泛应用,本研究结合mNGS进行对比分析,进一步提高了研究的实用性,研究结果具有较好的临床借鉴作用。
单中心、回顾性研究及样本量小是本研究的不足。纳入的29例可疑CNS感染患者接受了FA ME检测和院内常规检测,仅22例进行mNGS检测。另外,本研究来自真实世界临床实践,纳入的病例来自全院不同科室,进行mNGS检测的公司不尽相同,测序平台、核酸提取试剂及判断阈值均可能存在差异,因此,本研究结果有赖于后续开展大样本量前瞻性研究进一步验证。
综上所述,FA ME、mNGS可作为传统检测的补充手段提高CNS感染病原体检出水平。鉴于CNS感染的严重性及复杂性,临床医生应综合临床情况个体化选择检测方法,并注意对结果的正确解读。
致谢: 感谢患者的理解及生物梅里埃公司的技术支持。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
GBD 2017 Disease and Injury Incidence and Prevalence Collabo-rators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2018, 392(10159): 1789-1858. DOI:10.1016/S0140-6736(18)32279-7 |
| [2] |
Shah SS, Aronson PL, Mohamad Z, et al. Delayed acyclovir therapy and death among neonates with herpes simplex virus infection[J]. Pediatrics, 2011, 128(6): 1153-1160. DOI:10.1542/peds.2011-0177 |
| [3] |
Chong BSW, Kennedy KJ. Comparison of a commercial real-time PCR panel to routine laboratory methods for the diagnosis of meningitis-encephalitis[J]. Pathology, 2021, 53(5): 635-638. DOI:10.1016/j.pathol.2020.09.029 |
| [4] |
Huppatz C, Durrheim DN, Levi C, et al. Etiology of encephalitis in Australia, 1990-2007[J]. Emerg Infect Dis, 2009, 15(9): 1359-1365. DOI:10.3201/eid1509.081540 |
| [5] |
Han DS, Diao ZL, Lai HY, et al. Multilaboratory assessment of metagenomic next-generation sequencing for unbiased microbe detection[J]. J Adv Res, 2022, 38: 213-222. DOI:10.1016/j.jare.2021.09.011 |
| [6] |
Miao Q, Ma YY, Wang QQ, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67(Suppl 2): S231-S240. |
| [7] |
Gomez CA, Pinsky BA, Liu A, et al. Delayed diagnosis of tuberculous meningitis misdiagnosed as herpes simplex virus-1 encephalitis with the FilmArray syndromic polymerase chain reaction panel[J]. Open Forum Infect Dis, 2017, 4(1): ofw245. DOI:10.1093/ofid/ofw245 |
| [8] |
Lewis PO, Lanier CG, Patel PD, et al. False negative diagnostic errors with polymerase chain reaction for the detection of cryptococcal meningoencephalitis[J]. Med Mycol, 2020, 58(3): 408-410. DOI:10.1093/mmy/myz064 |
| [9] |
Chew KL, Lee CK, Cross GB, et al. Culture-confirmed cryptococcal meningitis not detected by Cryptococcus PCR on the Biofire meningitis/encephalitis panel®[J]. Clin Microbiol Infect, 2018, 24(7): 791-792. DOI:10.1016/j.cmi.2018.02.024 |
| [10] |
Lee CK, Chiu L, Yan G, et al. False negative results caused by erroneous automated result interpretation algorithm on the FilmArray 2.0 instrument[J]. Clin Chem Lab Med, 2018, 56(2): e43-e45. DOI:10.1515/cclm-2017-0518 |
| [11] |
Tunkel AR, Glaser CA, Bloch KC, et al. The management of encephalitis: clinical practice guidelines by the Infectious Di-seases Society of America[J]. Clin Infect Dis, 2008, 47(3): 303-327. DOI:10.1086/589747 |
| [12] |
Charlier C, Perrodeau É, Leclercq A, et al. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study[J]. Lancet Infect Dis, 2017, 17(5): 510-519. DOI:10.1016/S1473-3099(16)30521-7 |
| [13] |
van de Beek D, de Gans J, Spanjaard L, et al. Clinical features and prognostic factors in adults with bacterial meningitis[J]. N Engl J Med, 2004, 351(18): 1849-1859. DOI:10.1056/NEJMoa040845 |
| [14] |
Mailles A, De Broucker T, Costanzo P, et al. Long-term outcome of patients presenting with acute infectious encephalitis of various causes in France[J]. Clin Infect Dis, 2012, 54(10): 1455-1464. DOI:10.1093/cid/cis226 |
| [15] |
Richards RJ, Simon MS, Phillips CD, et al. Rapid detection of Listeria monocytogenes rhombencephalitis in an immunocompetent patient by multiplexed PCR[J]. BMJ Case Rep, 2018, 2018: bcr2018225575. |
| [16] |
Fleischer E, Aronson PL. Rapid diagnostic tests for meningitis and encephalitis-BioFire[J]. Pediatr Emerg Care, 2020, 36(8): 397-401. DOI:10.1097/PEC.0000000000002180 |
| [17] |
Hanson KE, Slechta ES, Killpack JA, et al. Preclinical assessment of a fully automated multiplex PCR panel for detection of central nervous system pathogens[J]. J Clin Microbiol, 2016, 54(3): 785-787. DOI:10.1128/JCM.02850-15 |
| [18] |
Hanson KE. The first fully automated molecular diagnostic panel for meningitis and encephalitis: how well does it perform, and when should it be used?[J]. J Clin Microbiol, 2016, 54(9): 2222-2224. DOI:10.1128/JCM.01255-16 |
| [19] |
Piccirilli G, Chiereghin A, Gabrielli L, et al. Infectious me-ningitis/encephalitis: evaluation of a rapid and fully automated multiplex PCR in the microbiological diagnostic workup[J]. New Microbiol, 2018, 41(2): 118-125. |
| [20] |
Radmard S, Reid S, Ciryam P, et al. Clinical utilization of the FilmArray meningitis/encephalitis (ME) multiplex polymerase chain reaction (PCR) assay[J]. Front Neurol, 2019, 10: 281. DOI:10.3389/fneur.2019.00281 |
| [21] |
中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组, 中国医疗保健国际交流促进会临床微生物与感染分会. 宏基因组高通量测序技术应用于感染性疾病病原检测中国专家共识[J]. 中华检验医学杂志, 2021, 44(2): 107-120. Clinical Microbiology Group of Chinese Society of Laboratory Medicine, Clinical Microbiology Group of Chinese Society of Microbiology and Immunology, Society of Clinical Microbiology and Infection of China International Exchange and Promotion Association for Medical and Healthcare. Chinese expert consensus on metagenomics next-generation sequencing application on pathogen detection of infectious diseases[J]. Chinese Journal of Laboratory Medicine, 2021, 44(2): 107-120. |
| [22] |
Brown JR, Bharucha T, Breuer J. Encephalitis diagnosis using metagenomics: application of next generation sequencing for undiagnosed cases[J]. J Infect, 2018, 76(3): 225-240. DOI:10.1016/j.jinf.2017.12.014 |
| [23] |
《中华传染病杂志》编辑委员会. 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识[J]. 中华传染病杂志, 2020, 38(11): 681-689. |
| [24] |
Du BL, Hua CZ, Xia YJ, et al. Evaluation of the BioFire FilmArray meningitis/encephalitis panel for the detection of bacteria and yeast in Chinese children[J]. Ann Transl Med, 2019, 7(18): 437. DOI:10.21037/atm.2019.08.103 |
| [25] |
张巧珍, 罗丽娟, 王翠锦, 等. FilmArray脑炎/脑膜炎多重病原体核酸联检试剂盒在中枢神经系统感染病原学诊断中的价值[J]. 中国小儿急救医学, 2021, 28(3): 161-164. Zhang QZ, Luo LJ, Wang CJ, et al. Clinical value of FilmArray meningitis/encephalitis panel in detecting the etiology of infection in central nervous system[J]. Chinese Pediatric Emergency Medicine, 2021, 28(3): 161-164. |



