艰难梭菌(Clostridioides difficile,C.difficile)是一种革兰阳性厌氧芽孢杆菌,是引起抗菌药物相关性腹泻(antibiotic-associated diarrhea, AAD)的主要病原菌。同时,艰难梭菌感染(Clostridioides difficile infection, CDI)是一种常见的医院获得性感染,其发病率在世界范围内不断增加[1-2]。国内研究[3]表明,患者艰难梭菌检出率高,艰难梭菌抗菌药物耐药性高,并且有一定的医院传播风险。其常见临床症状主要表现为腹泻、轻中度腹部痉挛、假膜性肠炎、中毒性巨结肠、肠穿孔和脓毒血症等,严重者甚至死亡[4]。目前治疗CDI的一线药物主要是甲硝唑和万古霉素[5],但治疗后复发率较高,且易使该病原体产生抗菌药物抗性[6],非达霉素虽能减少CDI的复发率但其价格较为昂贵。粪便菌群移植(fecal microbiota transplantation, FMT)作为一种新兴的治疗方案,该方法对复发性艰难梭菌感染(recurrent Clostridioides difficile infection, rCDI)疗效显著,但也存在较多的限制因素,如复杂的粪便成分、不可预测的移植风险等,限制了广泛应用[7],因此,寻找有效的CDI治疗方案迫在眉睫。食源性物质在CDI辅助治疗中的潜在价值包括抑制艰难梭菌的生长或其毒素的产生,因此,调整患者饮食结构或对治疗CDI有益。本文就食源性物质辅助治疗CDI的相关研究作一综述,以期为后续食源性物质用于CDI的辅助治疗提供参考。
1 一般营养素食物中的膳食营养素种类繁多,主要包括蛋白质、碳水化合物、微量元素等,为身体生长发育提供必要的营养支持。研究[8]发现,特定碳水化合物饮食(specific carbohydrate diet,SCD)可以改善宿主的肠道菌群,避免rCDI的发生。因此,明确营养素以减少CDI的复发显得尤为重要。
1.1 蛋白质和氨基酸类虽然已有研究[9]显示,高蛋白饮食可加速CDI发生进程,但某些蛋白质或氨基酸对艰难梭菌却具有一定的抑制作用,如:钙网蛋白可以与锌离子结合,通过降低肠道内锌离子的浓度进而提高CDI小鼠的生存率[10]。除此之外,体外试验研究[11]也表明,40 g/L甘氨酸能抑制艰难梭菌芽孢萌发,20 g/L及以上浓度的甘氨酸和组氨酸对RT001、RT015、RT020、RT027、RT078型艰难梭菌营养细胞生长有抑制作用,这种作用可能与甘氨酸抑制艰难梭菌细胞壁的形成有关[12]。在日常饮食中适当增加甘氨酸的摄入或许对CDI患者的治疗有益,人体内的蛋白质和氨基酸种类繁多,除上述之外其他能抑制艰难梭菌的蛋白质和氨基酸值得进一步探究。
1.2 碳水化合物及其代谢物类碳水化合物是生命细胞结构的主要成分及主要供能物质,并且有调节细胞活动的重要功能。研究[13]发现,将微生物可利用的碳水化合物(microbiota accessible carbohydrates,MACs)加入饲料后可明显减少小鼠粪便中艰难梭菌载量,而饮食中缺乏MACs会延长CDI病程。由此可见,增加碳水化合物摄入在一定程度上可以缓解CDI。
葡萄糖是生物体主要的能源物质,人体摄入的碳水化合物在体内经消化变成葡萄糖或其它单糖参加机体代谢。体外试验表明,低浓度的葡萄糖(2 g/L)能够促进艰难梭菌产生毒素,而高浓度葡萄糖(5 g/L或10 g/L)则显著减少毒素的产生[14],其机制可能是高浓度的葡萄糖在被艰难梭菌代谢后产生大量乳酸,从而抑制艰难梭菌毒素分泌。海藻糖是一种非还原性糖,耐高温及耐酸,在香菇、酵母、面包、啤酒、葡萄酒、大豆、虾类等食品中含量丰富。研究[15]表明,与未接受海藻糖处理的CDI小鼠相比,CDI小鼠食用海藻糖后盲肠中毒素基因tcdA和tcdB表达降低,病情得到缓解,提示海藻糖辅助治疗CDI的潜力。另一种碳水化合物-水苏糖在发酵过程中能够降低肠道pH值,抑制肠道病原菌生长的同时[16],特异性地促进益生菌—格氏副拟杆菌(Parabacteroides goldsteinii)和多形拟杆菌(Bacteroides thetaiotaomicron)的增殖[17],通过调节肠道菌群,从而维持肠道内环境稳态,减轻CDI的严重程度。
除上述单糖外,碳水化合物还包括多糖,如黄原胶,由于其具有黏性,常被用作食品增稠剂。研究人员在整个试验期间给试验组CDI小鼠饮食中添加5%黄原胶,随后通过16S rRNA进行肠道微生物群测序和短链脂肪酸代谢组学分析,发现与正常饮食对照组小鼠相比,试验组小鼠肠道微生物的多样性和丰富度较高,肠道内短链脂肪酸丙酸和丁酸浓度显著增加,且艰难梭菌定植率明显下降。可见,黄原胶在抗菌药物治疗期间保护了肠道内正常的微生物群,从而排除艰难梭菌在肠道的定植[18]。但需要注意的是,此研究中使用的黄原胶浓度较高,较低剂量的黄原胶对CDI患者的肠道是否有有益作用尚需进一步探究。
碳水化合物被摄入后,肠道菌群可将其发酵为短链脂肪酸(short-chain fatty acids, SCFAs)[19],如乙酸、丙酸、丁酸和戊酸等,这些发酵产物能反向调节肠道菌群,在CDI过程中对机体发挥保护作用。研究[20]指出,乙酸可以促进肠道免疫细胞产生白细胞介素(IL)-22,继而诱导宿主黏液糖基化而促进肠道中的考拉杆菌属(Phascolarctobacterium spp.)生长,显著抑制艰难梭菌的定植[21]。丁酸可促进缺氧诱导因子-1(HIF-1)相关基因及细胞旁连接蛋白相关基因的表达,进而维持肠上皮的完整性,减轻艰难梭菌毒素对肠上皮的损伤[22]。此外,戊酸盐不仅能抑制不同型别的艰难梭菌生长[23],还能增加优势菌群厚壁菌门及拟杆菌门的丰富度,恢复肠道菌群的多样性[24]。可见,碳水化合物能够通过调节肠道菌群进一步增加短链脂肪酸的产生,从而维持肠道内环境的稳态,保持肠道健康。
1.3 维生素D维生素是日常饮食中不可缺少的营养成分,研究[25]发现体内维生素水平轻度降低是CDI的危险因素之一。有研究[26]指出血清25(OH)D3水平与CDI严重程度在一定范围内呈负相关;并且,与不缺乏维生素D的CDI患者相比,维生素D缺乏的CDI患者腹泻病程更长,且更易发生败血症[27];此外,当给孕妇补充维生素D后,通过16S rRNA基因序列分析发现婴儿肠道中艰难梭菌数量明显减少[28]。综上所述,给机体补充维生素D可能是辅助治疗CDI的新思路。营养素与与植物提取物对人体肠道健康的影响见图 1。
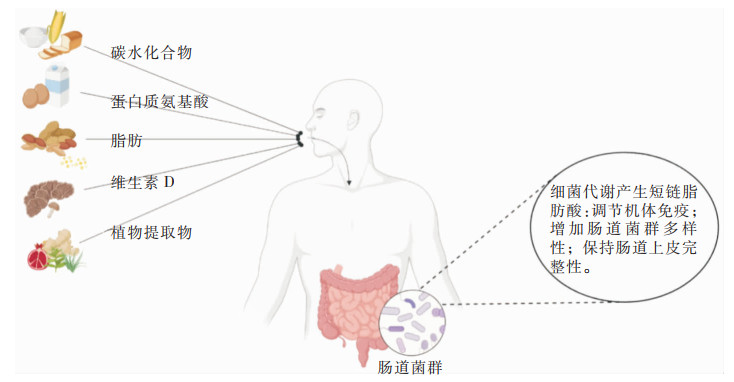 |
| 图 1 营养素与与植物提取物对人体肠道健康的影响 |
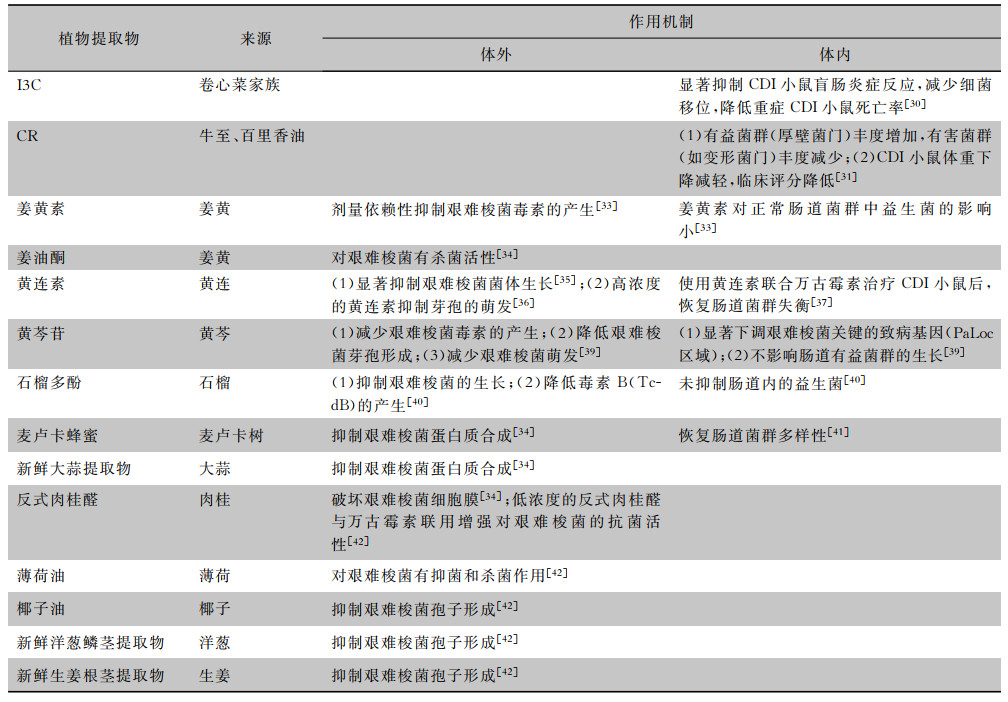
我国传统中医医学中有大量关于植物提取物被用作抗菌剂的记载[29],对艰难梭菌有抑制作用的植物提取物在国内外也多有报道。芥子油苷是一种来自于卷心菜家族的天然产物,I3C是芥子油苷的代谢物。在饲料中添加I3C后,可显著抑制CDI小鼠盲肠炎症反应,减少细菌移位,降低重症CDI小鼠死亡率[30]。目前I3C在预防人类CDI中的作用机制尚不明确,研究人员有必要发掘其在CDI防治中的潜力,如给围手术期需要抗菌药物治疗的患者或有较高患CDI风险的人群饮食中添加I3C,可能会降低CDI的发生率和/或严重程度。
2.2 香芹酚(carvacrol, CR)CR是一种食品级单萜植物酚,天然存在于牛至和百里香油中,具有抑菌和抗炎作用。研究[31]发现正常小鼠预防性食用CR可显著改变感染后肠道菌群组成,主要表现为有益菌群(厚壁菌门)丰度增加,有害菌群(如变形菌门)丰度减少;此外,与未治疗组相比,经CR治疗后的CDI小鼠体重下降的程度减轻,临床评分降低,这可能与CR抑制艰难梭菌芽孢生长和/或毒素产生有关。CR可以在不引起肠道菌群紊乱的情况下改善CDI症状。
2.3 姜黄素(curcumin)和姜油酮姜黄素主要来源于姜黄,占姜黄的0.3%~5.4%,已被证明具有抗炎、抗癌、抗氧化作用[32],体外试验[33]发现姜黄素对艰难梭菌毒素的产生呈剂量依赖性抑制,其抑制作用优于非达霉素。此外,与万古霉素、甲硝唑相比,姜黄素对正常肠道菌群中的乳杆菌属(Lactobacillus)、双歧杆菌(Bifidobacterium)和类杆菌(Bacteroides)等益生菌的影响更小。姜油酮(zingerone)来自姜黄,将艰难梭菌暴露于姜油酮24 h后,活菌数下降,有一定的杀菌活性[34];长期使用抗菌药物而导致的肠道菌群紊乱是CDI的主要诱因,增加姜黄素的摄入,加强肠道对艰难梭菌的抵抗能力,或许能够克服抗菌药物所带来的不良影响。
2.4 黄连素(berberine)黄连素又称小檗碱,是一种异喹啉生物碱,在植物界分布较广,被广泛用于治疗胃肠道疾病。将艰难梭菌培养在含有黄连素培养基中时,其菌体生长受到显著抑制[35]。高浓度的黄连素可在艰难梭菌芽孢萌发开始后不久进入芽孢,从而抑制芽孢的萌发,降低芽孢萌发带来的危害[36]。另一方面,使用黄连素联合万古霉素治疗CDI小鼠后,恢复了因使用万古霉素而导致肠道菌群失衡,且这种联合治疗方案能够预防rCDI[37]。目前,虽已有体外研究证明黄连素有一定的抗菌作用,但其治疗CDI患者的临床效果尚待验证,其在CDI治疗中的价值值得进一步探索。
2.5 黄芩苷(baicalin)黄芩苷是黄芩中的一种黄酮苷类化合物,常被广泛用来治疗感染性疾病[38]。黄芩苷已被证明能够减少毒素的产生,显著降低艰难梭菌芽孢形成和萌发,从而降低艰难梭菌的传播率以及复发风险。此外,向CDI小鼠肠道内补充黄芩苷后,艰难梭菌关键的致病基因(PaLoc区域)表达被显著下调,且不影响肠道有益菌群(如乳酸杆菌)的生长[39]。综上所述,黄芩苷用于治疗CDI的潜质应进一步研究探讨。
2.6 石榴多酚(punicalagin)石榴有一定的营养和药用价值。石榴多酚,又称为鞣花单宁,是石榴汁中含量最丰富的多酚。体外研究发现石榴多酚在一定浓度下,能以剂量依赖的方式抑制艰难梭菌的生长同时,降低高产毒菌株NAP1/027/BI中毒素B(TcdB)的产生,而对肠道内的益生菌乳酸乳球菌(Lactococcus lactis spp.)、干酪乳杆菌(Lactobacillus casei)和动物双歧杆菌(Bifidobacterium animalis)的生长则无抑制作用[40]。
2.7 蜂蜜麦卢卡蜂蜜(Manuka honey)提取自麦卢卡树,其在体外可以抑制艰难梭菌蛋白质合成[34],最近,4例难治性CDI患者接受非达霉素治疗3 d后用15%麦卢卡蜂蜜进行结肠灌洗,粪便中的艰难梭菌含量降低,并且,蜂蜜灌洗后恢复了非达霉素治疗后的肠道菌群多样性降低情况[41]。该病例报告证明蜂蜜灌肠对难治性CDI具有良好的疗效。
2.8 其他从大蒜中提取的大蒜汁和大蒜粉,可抑制艰难梭菌蛋白质合成[34],对艰难梭菌有抑菌作用[42];反式肉桂醛来自肉桂,其可以破坏艰难梭菌细胞膜,细胞膜的完整性对维持艰难梭菌在对数期和稳定期存活至关重要[34],低浓度的反式肉桂醛在体外增强了常规抗菌药物万古霉素的抗菌活性,因此,反式肉桂醛与万古霉素的联合治疗可能会提高这种感染的治疗效果[42];薄荷油来源于薄荷,8%(v/v)的薄荷油对艰难梭菌菌株也显示出抑制和杀菌作用[42]。新鲜洋葱鳞茎提取物和椰子油,以及新鲜生姜根茎提取物,抑制艰难梭菌的孢子形成,然而,效果因艰难梭菌菌株而异[42]。这些都在日常生活中常见且容易获得,但是应用时要适量,因为植物衍生物存在相关的风险,应用时要加以辨别以提供更安全的抗菌药物替代品。
植物提取物对艰难梭菌的体内外抑制作用机制见表 1。
| 表 1 植物提取物对艰难梭菌的体内外抑制作用机制 |
|
综上所述,特定的食源性物质可以影响人体肠道健康,显著改善CDI的症状。一旦发生CDI,在使用抗菌药物的同时加入一些对艰难梭菌有抑制作用的食源性物质,可以缩短抗菌药物治疗时间,减少抗菌药物使用剂量,弥补抗菌药物治疗的不足。此外,合理选择某种特定的食源性物质对防治CDI十分重要,用食源性物质辅助治疗CDI患者,具有安全性高、副作用小、患者接受度高的优势。总之,食源性物质在CDI的辅助治疗方面有很好的发展前景,可以为开发个体化精准饮食辅助防治CDI提供新的参考价值。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Balsells E, Shi T, Leese C, et al. Global burden of Clostridium difficile infections: a systematic review and Meta-analysis[J]. J Glob Health, 2019, 9(1): 010407. |
| [2] |
Rao K, Malani PN. Diagnosis and treatment of Clostridioides (Clostridium) difficile infection in adults in 2020[J]. JAMA, 2020, 323(14): 1403-1404. DOI:10.1001/jama.2019.3849 |
| [3] |
Wen X, Shen C, Xia JY, et al. Whole-genome sequencing reveals the high nosocomial transmission and antimicrobial resistance of Clostridioides difficile in a single center in China, a four-year retrospective study[J]. Microbiol Spectr, 2022, 10(1): e0132221. DOI:10.1128/spectrum.01322-21 |
| [4] |
Vasilescu IM, Chifiriuc MC, Pircalabioru GG, et al. Gut dysbiosis and Clostridioides difficile infection in neonates and adults[J]. Front Microbiol, 2021, 12: 651081. |
| [5] |
胡莹, 曾珍, 单斌. 《中国成人艰难梭菌感染诊断和治疗专家共识》解读[J]. 西部医学, 2020, 32(1): 5-8. Hu Y, Zeng Z, Shan B. Interpretation of expert consensus on the diagnosis and treatment of Clostridium difficile infection in adults[J]. Medical Journal of West China, 2020, 32(1): 5-8. DOI:10.3969/j.issn.1672-3511.2020.01.002 |
| [6] |
Saha S, Kapoor S, Tariq R, et al. Increasing antibiotic resis-tance in Clostridioides difficile: a systematic review and Meta-analysis[J]. Anaerobe, 2019, 58: 35-46. DOI:10.1016/j.anaerobe.2019.102072 |
| [7] |
易婷, 刘海鸿, 白琪, 等. 粪便菌群移植治疗现状及其应用前景[J]. 中国微生态学杂志, 2016, 28(3): 356-359. Yi T, Liu HH, Bai Q, et al. The current situation and application prospect of fecal microbiota transplantation[J]. Chinese Journal of Microecology, 2016, 28(3): 356-359. DOI:10.13381/j.cnki.cjm.201603030 |
| [8] |
Suskind DL, Lee D, Solan P, et al. Dietary therapy for Clostridium difficile colonization: a case series[J]. Anaerobe, 2019, 57: 1-3. DOI:10.1016/j.anaerobe.2019.02.016 |
| [9] |
Mefferd CC, Bhute SS, Phan JR, et al. A high-fat/high-protein, atkins-type diet exacerbates Clostridioides (Clostridium) difficile infection in mice, whereas a high-carbohydrate diet protects[J]. mSystems, 2020, 5(1): e00765-19. DOI:10.1128/mSystems.00765-19 |
| [10] |
Zackular JP, Skaar EP. The role of zinc and nutritional immunity in Clostridium difficile infection[J]. Gut Microbes, 2018, 9(5): 469-476. |
| [11] |
Pickering DS, Vernon JJ, Freeman J, et al. Investigating the effect of supplementation on Clostridioides (Clostridium) difficile spore recovery in two solid agars[J]. Anaerobe, 2018, 50: 38-43. DOI:10.1016/j.anaerobe.2018.01.010 |
| [12] |
Trippen B, Hammes WP, Schleifer KH, et al. Mode of action of D-amino acids on the biosynthesis of peptidoglycan (author's transl)[J]. Arch Microbiol, 1976, 109(3): 247-261. DOI:10.1007/BF00446636 |
| [13] |
Hryckowian AJ, Van Treuren W, Smits SA, et al. Microbiota-accessible carbohydrates suppress Clostridium difficile infection in a murine model[J]. Nat Microbiol, 2018, 3(6): 662-669. DOI:10.1038/s41564-018-0150-6 |
| [14] |
Hofmann JD, Biedendieck R, Michel AM, et al. Influence of L-lactate and low glucose concentrations on the metabolism and the toxin formation of Clostridioides difficile[J]. PLoS One, 2021, 16(1): e0244988. DOI:10.1371/journal.pone.0244988 |
| [15] |
Zhang YM, Shaikh N, Ferey JL, et al. Lactotrehalose, an ana-log of trehalose, increases energy metabolism without promoting Clostridioides difficile infection in mice[J]. Gastroenterology, 2020, 158(5): 1402-1416. e2. DOI:10.1053/j.gastro.2019.11.295 |
| [16] |
Pacifici S, Song J, Zhang C, et al. Intra amniotic administration of raffinose and stachyose affects the intestinal brush border functionality and alters gut microflora populations[J]. Nutrients, 2017, 9(3): 304. DOI:10.3390/nu9030304 |
| [17] |
康颖, 李先平, 宋利琼, 等. 水苏糖对艰难梭菌在小鼠肠道内定植与菌群的影响[J]. 疾病监测, 2020, 35(3): 256-263. Kang Y, Li XP, Song LQ, et al. Effect of stachyose on colonization of Clostridium difficile and intestinal flora in intestinal tract of mice[J]. Disease Surveillance, 2020, 35(3): 256-263. |
| [18] |
Schnizlein MK, Vendrov KC, Edwards SJ, et al. Dietary xanthan gum alters antibiotic efficacy against the murine gut microbiota and attenuates Clostridioides difficile colonization[J]. mSphere, 2020, 5(1): e00708-19. DOI:10.1128/mSphere.00708-19 |
| [19] |
陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学, 2006, 24(1): 38-40, 69. Chen Y, Cao YS, Liu XH. Short chain fatty acids and intestinal microflora[J]. Jiangxi Science, 2006, 24(1): 38-40, 69. |
| [20] |
Fachi JL, Sécca C, Rodrigues PB, et al. Acetate coordinates neutrophil and ILC3 responses against C. difficile through FFAR2[J]. J Exp Med, 2020, 217(3): jem.20190489. DOI:10.1084/jem.20190489 |
| [21] |
Nagao-Kitamoto H, Leslie JL, Kitamoto S, et al. Interleukin-22-mediated host glycosylation prevents Clostridioides difficile infection by modulating the metabolic activity of the gut microbiota[J]. Nat Med, 2020, 26(4): 608-617. DOI:10.1038/s41591-020-0764-0 |
| [22] |
Fachi JL, Felipe JDS, Pral LP, et al. Butyrate protects mice from Clostridium difficile-induced colitis through an HIF-1-dependent mechanism[J]. Cell Rep, 2019, 27(3): 750-761. e7. DOI:10.1016/j.celrep.2019.03.054 |
| [23] |
McDonald JAK, Mullish BH, Pechlivanis A, et al. Inhibiting growth of Clostridioides difficile by restoring valerate, produced by the intestinal microbiota[J]. Gastroenterology, 2018, 155(5): 1495-1507. e15. DOI:10.1053/j.gastro.2018.07.014 |
| [24] |
邹标, 舒赛男, 黄志华. 粪菌移植治疗艰难梭菌感染的研究进展[J]. 中国微生态学杂志, 2020, 32(1): 112-116. Zou B, Shu SN, Huang ZH. Treatment of Clostridium difficile infection with fecal microbiota transplantion: research progress[J]. Chinese Journal of Microecology, 2020, 32(1): 112-116. |
| [25] |
Park SW, Lee YJ, Ryoo E. Difference in vitamin D levels between children with Clostridioides difficile enteritis and those with other acute infectious enteritis[J]. Pediatr Gastroenterol Hepatol Nutr, 2021, 24(1): 81-89. DOI:10.5223/pghn.2021.24.1.81 |
| [26] |
van der Wilden GM, Fagenholz PJ, Velmahos GC, et al. Vitamin D status and severity of Clostridium difficile infections: a prospective cohort study in hospitalized adults[J]. JPEN J Parenter Enteral Nutr, 2015, 39(4): 465-470. DOI:10.1177/0148607113519129 |
| [27] |
Wong KK, Lee R, Watkins RR, et al. Prolonged Clostridium difficile infection may be associated with vitamin D deficiency[J]. JPEN J Parenter Enteral Nutr, 2016, 40(5): 682-687. DOI:10.1177/0148607114568121 |
| [28] |
Talsness CE, Penders J, Jansen EHJM, et al. Influence of vitamin D on key bacterial taxa in infant microbiota in the KOALA birth cohort study[J]. PLoS One, 2017, 12(11): e0188011. DOI:10.1371/journal.pone.0188011 |
| [29] |
Cowan MM. Plant products as antimicrobial agents[J]. Clin Microbiol Rev, 1999, 12(4): 564-582. DOI:10.1128/CMR.12.4.564 |
| [30] |
Julliard W, De Wolfe TJ, Fechner JH, et al. Amelioration of Clostridium difficile infection in mice by dietary supplementation with indole-3-carbinol[J]. Ann Surg, 2017, 265(6): 1183-1191. DOI:10.1097/SLA.0000000000001830 |
| [31] |
Mooyottu S, Flock G, Upadhyay A, et al. Protective effect of carvacrol against gut dysbiosis and Clostridium difficile associated disease in a mouse model[J]. Front Microbiol, 2017, 8: 625. DOI:10.3389/fmicb.2017.00625 |
| [32] |
余美荣, 蒋福升, 丁志山. 姜黄素的研究进展[J]. 中草药, 2009, 40(5): 828-831. Yu MR, Jiang FS, Ding ZS. Advances in studies on curcumin[J]. Chinese Traditional and Herbal Drugs, 2009, 40(5): 828-831. |
| [33] |
Mody D, Athamneh AIM, Seleem MN. Curcumin: a natural derivative with antibacterial activity against Clostridium difficile[J]. J Glob Antimicrob Resist, 2020, 21: 154-161. DOI:10.1016/j.jgar.2019.10.005 |
| [34] |
Roshan N, Riley TV, Knight DR, et al. Natural products show diverse mechanisms of action against Clostridium difficile[J]. J Appl Microbiol, 2019, 126(2): 468-479. DOI:10.1111/jam.14152 |
| [35] |
Lakes JE, Richards CI, Flythe MD. Inhibition of bacteroidetes and firmicutes by select phytochemicals[J]. Anaerobe, 2020, 61: 102145. |
| [36] |
Wang SW, Setlow B, Setlow P, et al. Uptake and levels of the antibiotic berberine in individual dormant and germinating Clostridium difficile and Bacillus cereus spores as measured by laser tweezers Raman spectroscopy[J]. J Antimicrob Chemother, 2016, 71(6): 1540-1546. |
| [37] |
Lv Z, Peng GL, Liu WH, et al. Berberine blocks the relapse of Clostridium difficile infection in C57BL/6 mice after standard vancomycin treatment[J]. Antimicrob Agents Chemother, 2015, 59(7): 3726-3735. |
| [38] |
Liu IX, Durham DG, Richards RM. Baicalin synergy with beta-lactam antibiotics against methicillin-resistant Staphylococcus aureus and other beta-lactam-resistant strains of S. aureus[J]. J Pharm Pharmacol, 2000, 52(3): 361-366. |
| [39] |
Pellissery AJ, Vinayamohan PG, Venkitanarayanan K. In vitro antivirulence activity of baicalin against Clostridioides difficile[J]. J Med Microbiol, 2020, 69(4): 631-639. |
| [40] |
Sukumar MR, König B. Pomegranate extract specifically inhibits Clostridium difficile growth and toxin production without disturbing the beneficial bacteria in vitro[J]. Infect Drug Resist, 2018, 11: 2357-2362. |
| [41] |
VAN Knippenberg YMW, Laheij RJF. Microbiota diversity and bacterial load after successful treatment of Clostridioides difficile infection with honey lavage in 4 patients[J]. Biosci Microbiota Food Health, 2022, 41(1): 1-3. |
| [42] |
Roshan N, Riley TV, Hammer KA. Effects of natural produ-cts on several stages of the spore cycle of Clostridium difficile in vitro[J]. J Appl Microbiol, 2018, 125(3): 710-723. |



