2. 国家老年疾病临床医学研究中心(湘雅医院), 湖南 长沙 410008;
3. 中南大学湘雅医学院医学检验系, 湖南 长沙 410013
2. National Clinical Research Center for Geriatric Disorders[Xiangya Hospital], Central South University, Changsha 410008, China;
3. Faculty of Laboratory Medicine, Xiangya School of Medicine, Central South University, Changsha 410013, China
变栖克雷伯菌(Klebsiella variicola)是克雷伯菌属肺炎克雷伯菌复合群的一员,在植物生态系统中发挥重要作用,近年来也发现变栖克雷伯菌可引起人和动物的感染[1-2]。由于临床微生物实验室检测方法的局限性,变栖克雷伯菌与肺炎克雷伯菌两者的菌落特点、镜下形态和传统的生化反应相似,导致临床上变栖克雷伯菌经常被错误地鉴定为肺炎克雷伯菌[2-4]。研究[5-6]显示,肺炎克雷伯菌的临床分离株中,约20%的菌株实际为变栖克雷伯菌和类肺炎克雷伯菌。变栖克雷伯菌和肺炎克雷伯菌均是机会性病原菌,可导致血流感染、呼吸道感染和尿路感染等[7-9]。黄洪等[2]采用MALDI-TOF MS对1 323株肺炎克雷伯菌(经生化鉴定)进行检测,质谱鉴定结果显示有1.97%为变栖克雷伯菌,且菌株来源包括痰、肺泡灌洗液、脑脊液、尿等多种标本。该团队研究发现变栖克雷伯菌携带多种耐药基因,耐碳青霉烯变栖克雷伯菌ST型别与耐碳青霉烯类肺炎克雷伯菌国内主要流行克隆型别并不相同[2]。关于变栖克雷伯菌携带毒力因子是否与肺炎克雷伯菌相似,不同报道仍存在争议[2-3]。研究[7]表明,变栖克雷伯菌感染患者的病死率高于肺炎克雷伯菌感染患者。因此,变栖克雷伯菌感染的临床重要性及临床意义被低估,其真实流行率被不精确检测方法所掩盖。目前国内关于临床分离变栖克雷伯菌感染患者临床特征的研究尚未见报道,本课题组前期对中国中部某大型三级教学医院连续六年临床鉴定为肺炎克雷伯菌的2 193株菌株进行全基因组测序,结果发现有70株是变栖克雷伯菌[10],本研究拟进一步探索变栖克雷伯菌感染患者的临床特征,为临床上该病原菌的防控提供理论依据。
1 对象与方法 1.1 研究对象回顾性选取2013年1月—2018年7月中南大学湘雅医院临床分离的非重复肺炎克雷伯菌2 193株,经全基因组学测序显示,包括变栖克雷伯菌70株,以70株变栖克雷伯菌感染患者作为试验组研究对象,并以随机数字法选取同期70例肺炎克雷伯菌感染患者作为对照。全基因组学测序采用BGISEQ-500(MGI,深圳,中国)高通量测序平台完成。本研究符合《世界医学协会赫尔辛基宣言》中关于人类医学科研伦理原则的条款,已被中南大学湘雅医院医学伦理委员会批准(批准号:2020101028)。
1.2 临床资料收集收集两组患者的基本人口学资料(性别、年龄、基础疾病),感染来源,感染部位,感染前[吸烟史、1年内是否入住重症监护病房(ICU)、是否使用过侵入性导管、是否气管插管或切开、是否接受手术治疗、90 d内抗菌药物暴露史、90 d内住院(超过2 d)史、30 d内血液净化治疗史、机体免疫低下或抑制(是否接受肿瘤放射治疗、化学治疗、糖皮质激素、免疫抑制剂等治疗)]情况,感染后抗菌药物使用情况,住院日数,预后情况(30天不良预后包含死亡和放弃生命支持治疗)等信息。
1.3 药物敏感性试验采用Vitek 2 Compact细菌药敏分析仪检测细菌对氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢曲松、头孢吡肟、氨曲南、亚胺培南、庆大霉素、左氧氟沙星、环丙沙星、呋喃妥因、复方磺胺甲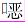
应用SPSS 26.0软件进行统计分析。非正态分布的计量资料采用中位数(四分位间距)[M(IQR)]表示,两组间比较采用非参数Mann-Whitney U检验;对于分类变量两组间数据比较,则应用χ2检验进行统计分析。P≤0.05为差异有统计学意义。
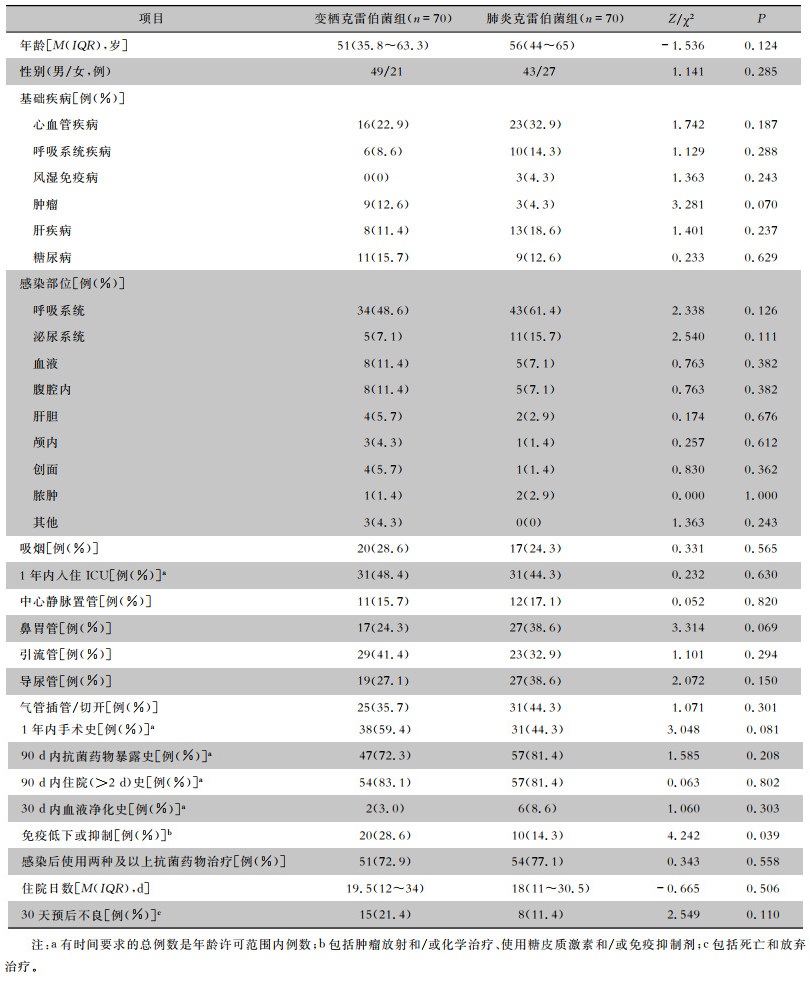
2 结果 2.1 一般资料及基础疾病变栖克雷伯菌组患者男性49例(70%),女性21例(30.0%),男女比例2.3∶1;年龄1 d~95岁,中位年龄51岁,1岁以内的婴儿期患者6例(8.6%);肺炎克雷伯菌组患者男性43例(61.4%),女性27例(38.6%),男女比例1.6∶1;年龄3~86岁,中位年龄56岁;两组间患者性别及总体年龄比较,差异均无统计学意义(均P>0.05)。见表 1。变栖克雷伯菌组患者心血管疾病(22.9%)最多见,其次是糖尿病(15.7%)、肿瘤(12.6%);肺炎克雷伯菌组患者心血管疾病(32.9%)最多见,其次是肝疾病(18.6%)、呼吸系统疾病(14.3%),两组比较差异无统计学意义(P>0.05)。
2.2 感染部位分布变栖克雷伯菌感染部位主要来自呼吸系统(48.6%),其次是血流(8例,11.4%)、腹腔内(8例,11.4%);肺炎克雷伯菌感染部位主要来自呼吸系统(61.4%),其次是泌尿系统(15.7%)。两组患者感染部位比较,差异无统计学意义(P>0.05)。
2.3 感染前临床特征变栖克雷伯菌组患者因接受过肿瘤放射和/或化学治疗、糖皮质激素或免疫抑制剂治疗而导致免疫力低下或抑制的患者比例高于肺炎克雷伯菌组,差异具有统计学意义(P=0.039);而其他指标如一年内入住ICU、中心静脉置管、鼻胃管、引流管、尿管、气管插管/切开、1年内手术史、90 d内抗菌药物暴露史、90 d内住院(>2 d)史、30 d内血液净化史比较,差异均无统计学意义(均P>0.05),见表 1。
| 表 1 变栖克雷伯菌感染患者和肺炎克雷伯菌感染患者临床特征比较 Table 1 Comparison of clinical characteristics between patients with K. variicola infection and K. pneumoniae infection |
|
感染后使用抗菌药物治疗方面,两组比较差异无统计学意义。70例变栖克雷伯菌感染患者预后不良15例(21.4%),其中1例患者死亡,14例患者放弃治疗;肺炎克雷伯菌组预后不良8例(11.4%),其中1例患者死亡,7例患者放弃治疗。
2.5 药敏结果比较变栖克雷伯菌组菌株与肺炎克雷伯菌对常见抗菌药物耐药情况比较结果见表 2。变栖克雷伯菌对常见抗菌药物的耐药率均<40%,变栖克雷伯菌对抗菌药物的耐药率均低于肺炎克雷伯菌(均P < 0.001)。
| 表 2 变栖克雷伯菌与肺炎克雷伯菌对常用抗菌药物耐药性的比较 Table 2 Comparison of antimicrobial resistance between K. variicola and K. pneumoniae |

|
变栖克雷伯被认为是一种新的细菌物种,通过传统的生化反应很难将变栖克雷伯菌与肺炎克雷伯菌区分开,在临床微生物实验室通常会将变栖克雷伯菌错误地鉴定为肺炎克雷伯菌[2],目前国内关于变栖克雷伯菌感染特点的研究未见报道。本研究基于高通量测序技术,对国内某医院连续6年非重复患者的非重复标本分离的2 193株肺炎克雷伯菌进行全基因组学测序,准确区分出变栖克雷伯菌与肺炎克雷伯菌[10],此为国内首次大规模采用全基因组测序筛选并研究变栖克雷伯菌感染的临床特征,为研究该病原菌感染提供数据。
近年来,国内外关于高毒力肺炎克雷伯菌的报道层出不穷[12-14],该菌可以引起免疫力正常个体发生严重的侵袭性社区获得性感染,并扩散性转移,引起了全球学者的广泛研究[12-14]。本研究结果显示,变栖克雷伯菌感染与肺炎克雷伯菌感染人群年龄相比,差异无统计学意义。本研究发现变栖克雷伯菌导致6例1岁以内的婴儿感染,与Farzana等[15]研究结果吻合,该团队在2019年分析了一起由变栖克雷伯菌引起的新生儿败血症暴发,发现变栖克雷伯菌导致了新生儿病死率显著升高[15],提示应该警惕该菌在婴儿群体中的流行传播。
本研究结果显示,接受过肿瘤放射和/或化学治疗、糖皮质激素和/或免疫抑制剂治疗而导致免疫力低下或抑制的患者更容易感染变栖克雷伯菌,与肺炎克雷伯菌组相比差异具有统计学意义,这些患者由于肿瘤或其他基础疾病,需长期接受各种放射和/或化学治疗或使用糖皮质激素或免疫抑制剂,使得自身免疫力低下,体内条件致病菌感染的可能性增加,成为医院感染的重点人群[16],变栖克雷伯菌是否更易侵犯免疫力低下患者,需要更多数据支撑,但本研究结果提示这类人群需重点关注。
研究[7]表明,变栖克雷伯菌是瑞典斯德哥尔摩地区血流感染的常见原因,且比肺炎克雷伯菌血流感染的病死率更高。Dahl等[17]报道了1例全胰切除术后由变栖克雷伯菌引起的严重败血症。本研究中变栖克雷伯菌主要分离自肺部感染患者,其次则来源于血流感染和腹腔内感染,与肺炎克雷伯菌引起的感染分布比较差异无统计学意义。本研究中变栖克雷伯菌感染组患者预后情况与肺炎克雷伯菌组比较,差异无统计学意义。鉴于高毒力肺炎克雷伯菌在血流感染中的报道逐渐增多[18-19],而变栖克雷伯菌是否也存在高毒力侵袭性菌株尚不明确,因此后续需多中心大样本的研究来明确变栖克雷伯菌引起的血流感染流行情况。
药敏检测结果显示,变栖克雷伯菌对多种临床常用抗菌药物的耐药率均低于肺炎克雷伯菌,与研究[6-7]一致。可能是由于肺炎克雷伯菌在临床上的流行率高,长期的医院内感染以及多种抗菌药物的选择压力下菌株的耐药性增加,再加上多种携带耐药基因的质粒在肺炎克雷伯菌株之间的转移传播[20-21],加重了肺炎克雷伯菌的耐药性。虽然变栖克雷伯菌的药敏检测结果显示该菌对多种抗菌药物敏感性高,但仍需加强对抗菌药物使用的管控,根据药敏结果合理使用抗菌药物,防止多重耐药变栖克雷伯菌株的产生和传播。
综上所述,本研究在国内首次大规模采用全基因组测序筛选并研究变栖克雷伯菌感染的临床特征,该菌作为一种新的病原体已经在临床出现,感染后大部分临床特征与肺炎克雷伯菌感染类似,因接受过肿瘤放射和/或化学治疗、糖皮质激素和/或免疫抑制剂治疗而导致免疫力低下或抑制的患者更易感染变栖克雷伯菌,同时需警惕该菌在1岁以内婴儿群体的流行传播。此外,虽然变栖克雷伯菌目前耐药率较低,仍应加强对该菌的药敏监控,规范临床合理使用抗菌药物,以防耐药性菌株的产生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Martínez-Romero E, Rodríguez-Medina N, Beltrán-Rojel M, et al. Genome misclassification of Klebsiella variicola and Klebsiella quasipneumoniae isolated from plants, animals and humans[J]. Salud Publica Mex, 2018, 60(1): 56-62. |
| [2] |
黄洪, 黄永禄, 顾丹霞, 等. 耐碳青霉烯类变栖克雷伯菌的耐药基因和分子分型研究[J]. 中华微生物学和免疫学杂志, 2019, 39(3): 197-201. Huang H, Huang YL, Gu DX, et al. Analysis of drug resistance genes and molecular typing of carbapenem-resistant Klebsiella variicola strains[J]. Chinese Journal of Microbiology and Immunology, 2019, 39(3): 197-201. DOI:10.3760/cma.j.issn.0254-5101.2019.03.007 |
| [3] |
Rodríguez-Medina N, Barrios-Camacho H, Duran-Bedolla J, et al. Klebsiella variicola: an emerging pathogen in humans[J]. Emerg Microbes Infect, 2019, 8(1): 973-988. DOI:10.1080/22221751.2019.1634981 |
| [4] |
Hazen TH, Zhao LC, Sahl JW, et al. Characterization of Klebsiella sp. strain 10982, a colonizer of humans that contains novel antibiotic resistance alleles and exhibits genetic similarities to plant and clinical Klebsiella isolates[J]. Antimicrob Agents Chemother, 2014, 58(4): 1879-1888. DOI:10.1128/AAC.01605-13 |
| [5] |
Rosenblueth M, Martínez L, Silva J, et al. Klebsiella variicola, a novel species with clinical and plant-associated isolates[J]. Syst Appl Microbiol, 2004, 27(1): 27-35. DOI:10.1078/0723-2020-00261 |
| [6] |
Brisse S, van Himbergen T, Kusters K, et al. Development of a rapid identification method for Klebsiella pneumoniae phylogenetic groups and analysis of 420 clinical isolates[J]. Clin Microbiol Infect, 2004, 10(10): 942-945. DOI:10.1111/j.1469-0691.2004.00973.x |
| [7] |
Maatallah M, Vading M, Kabir MH, et al. Klebsiella variicola is a frequent cause of bloodstream infection in the Stockholm area, and associated with higher mortality compared to K. pneumoniae[J]. PLoS One, 2014, 9(11): e113539. DOI:10.1371/journal.pone.0113539 |
| [8] |
Long SW, Linson SE, Ojeda Saavedra M, et al. Whole-genome sequencing of human clinical Klebsiella pneumoniae isolates reveals misidentification and misunderstandings of Klebsiella pneumoniae, Klebsiella variicola, and Klebsiella quasipneumoniae[J]. mSphere, 2017, 2(4): e00290-17. |
| [9] |
Potter RF, Lainhart W, Twentyman J, et al. Population structure, antibiotic resistance, and uropathogenicity of Klebsiella variicola[J]. mBio, 2018, 9(6): e02481-18. |
| [10] |
Pei N, Li YM, Liu CJ, et al. Large-scale genomic epidemiology of Klebsiella pneumoniae identified clone divergence with hypervirulent plus antimicrobial-resistant characteristics causing within-ward strain transmissions[J]. Microbiol Spectr, 2022, 10(2): e0269821. DOI:10.1128/spectrum.02698-21 |
| [11] |
Clinical and Laboratory Standards Institute. M100: performance standards for antimicrobial susceptibility testing: 28th edition[EB/OL]. [2022-07-15]. https://shop.clsi.org/media/1930/m100ed28_sample.pdf.
|
| [12] |
Choby JE, Howard-Anderson J, Weiss DS. Hypervirulent Klebsiella pneumoniae-clinical and molecular perspectives[J]. J Intern Med, 2020, 287(3): 283-300. DOI:10.1111/joim.13007 |
| [13] |
Walker KA, Miller VL. The intersection of capsule gene expression, hypermucoviscosity and hypervirulence in Klebsiella pneumoniae[J]. Curr Opin Microbiol, 2020, 54: 95-102. DOI:10.1016/j.mib.2020.01.006 |
| [14] |
Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19. |
| [15] |
Farzana R, Jones LS, Rahman MA, et al. Outbreak of hypervirulent multidrug-resistant Klebsiella variicola causing high mortality in neonates in Bangladesh[J]. Clin Infect Dis, 2019, 68(7): 1225-1227. DOI:10.1093/cid/ciy778 |
| [16] |
Liu Y, Liu YC, Dai JY, et al. Klebsiella pneumoniae pneumonia in patients with rheumatic autoimmune diseases: clinical characteristics, antimicrobial resistance and factors associated with extended-spectrum β-lactamase production[J]. BMC Infect Dis, 2021, 21(1): 366. DOI:10.1186/s12879-021-06055-1 |
| [17] |
Dahl SS, Thorsteinsson M, Lambine TL, et al. Severe sepsis caused by a gas-forming Clostridium perfringens and Klebsiella variicola liver abscess following total pancreatectomy[J]. BMJ Case Rep, 2020, 13(10): e238896. DOI:10.1136/bcr-2020-238896 |
| [18] |
Cienfuegos-Gallet AV, Zhou Y, Ai WX, et al. Multicenter genomic analysis of carbapenem-resistant Klebsiella pneumoniae from bacteremia in China[J]. Microbiol Spectr, 2022, 10(2): e0229021. DOI:10.1128/spectrum.02290-21 |
| [19] |
Wu XB, Shi QY, Shen SM, et al. Clinical and bacterial characteristics of Klebsiella pneumoniae affecting 30-day mortality in patients with bloodstream infection[J]. Front Cell Infect Microbiol, 2021, 11: 688989. DOI:10.3389/fcimb.2021.688989 |
| [20] |
Li X, Wang WZ, Jin X, et al. Emergence of plasmids co-harboring carbapenem resistance genes and tmexCD2-toprJ2 in sequence type 11 carbapenem resistant Klebsiella pneumoniae strains[J]. Front Cell Infect Microbiol, 2022, 12: 902774. DOI:10.3389/fcimb.2022.902774 |
| [21] |
Jia XM, Jia PY, Zhu Y, et al. Coexistence of blaNDM-1 and blaIMP-4 in one novel hybrid plasmid confers transferable carbapenem resistance in an ST20-K28Klebsiella pneumoniae[J]. Front Microbiol, 2022, 13: 891807. DOI:10.3389/fmicb.2022.891807 |



