2. 武汉市疾病预防控制中心纪检监察室, 湖北 武汉 430024;
3. 武汉市医院感染管理质量控制中心, 湖北 武汉 430024
2. Discipline Inspection Division, Wuhan Center for Disease Control and Prevention, Wuhan 430024, China;
3. Wuhan Center for Healthcare-associated Infection Ma-nagement Quality Control, Wuhan 430024, China
近年来,随着碳青霉烯抗生素的广泛应用,耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)呈现出全球蔓延趋势,已成为国内外共同面临的严峻挑战[1]。2013年美国疾病控制与预防中心(CDC)将耐碳青霉烯酶类肠杆菌目细菌列为最高级别“紧迫威胁”。全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System, CARSS)报告[2]结果显示,我国CRKP检出率由2014年的6.4%上升至2019年的10.9%,湖北省从4.4%上升至12.4%,上升速度较快。研究[3-5]表明,碳青霉烯酶敏感肺炎克雷伯菌感染致死率为20%~30%,而CRKP感染致死率为40%~70%,其直接后果是影响抗菌药物治疗效果,缩短新药应用与研发周期,延长患者治疗周期和增加患者治疗成本。消毒是切断传播途径,阻断CRKP传播的重要措施之一,随着各种消毒剂的广泛使用甚至滥用,菌株选择压力加大,细菌对消毒剂的耐药现象逐渐显现,目前常采用耐消毒剂基因检出率判断细菌对消毒剂的耐受性。消毒剂抗性增加与耐消毒剂基因相关。qacEΔ1编码的外排系统广泛存在于革兰阴性菌中,检出率与菌株对消毒剂敏感性下降呈现相关性[6]。肺炎克雷伯菌中cepA外排泵与对氯己定的敏感性降低有关[7],随着氯己定最低抑菌浓度(minimum inhibitory concentration, MIC)的增加,肺炎克雷伯菌cepA的表达也增加[8],且CRKP中携带耐消毒剂基因种类存在较大的地区差异性[7, 9-10]。武汉地区缺乏相关的系统研究,为了解本地区不同医院CRKP中耐药消毒剂基因携带情况及同源性,为预防和控制其克隆传播提供理论依据。本项目采用多中心研究,收集武汉地区3所医院从临床住院患者分离的CRKP菌株,采用MIC测定法进行药敏试验,采用实时荧光定量聚合酶链反应(Real-time PCR, RT-PCR)检测耐消毒剂的qacEΔ1和cepA基因携带情况,采用脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)对同时携带qacEΔ1和cepA基因的CRKP菌株进行同源性分析。现将结果报告如下。
1 材料与方法 1.1 菌株来源收集2018—2019年来自湖北省妇幼保健院(代码Ⅰ)、武汉市第一医院(代码Ⅱ)和黄陂区人民医院(代码Ⅲ)3所三级医院从临床住院患者分离的62株非重复性CRKP。菌株入选标准: (1)为CRKP,即肺炎克雷伯菌对亚胺培南、美罗培南或厄他培南其中的任何一种耐药(亚胺培南或美罗培南MIC≥4 μg/mL,厄他培南MIC≥2 μg/mL);(2)少数患者住院期间多次培养出CRKP,则纳入该患者首次培养的CRKP。3所医院按照要求保存符合纳入标准的CRKP菌株,由研究者单位每两个月收集一次,集中保存于-80℃医用冰箱中。质控菌株为大肠埃希菌ATCC 25922,沙门氏菌H9812,购于中国普通微生物菌种保藏管理中心。本研究通过武汉市疾病预防控制中心伦理委员会批准(WHCDCIRB-K-2021038)。
1.2 主要仪器与试剂全自动细菌鉴定及药敏分析系统(法国生物梅里埃公司,VITEK 2 Compact)、荧光定量PCR仪(瑞士罗氏公司,LightCycler 480)、脉冲场凝胶电泳仪(美国Bio-Rad公司,CHEF Mapper XA)、凝胶成像系统(美国UVP公司,ESSENTIAL V6)、细菌DNA提取试剂盒(北京康为世纪公司)、PCR反应试剂盒(日本Takara公司)、PCR引物(上海生工生物工程股份有限公司)。
1.3 菌株复核与药敏试验采用全自动细菌鉴定及药敏分析系统对CRKP菌株进行复核鉴定及药敏试验,检测18种抗菌药物的MIC,包括亚胺培南、美罗培南、厄他培南、氨苄西林、哌拉西林、阿莫西林/克拉维酸、头孢唑林、头孢他啶、头孢曲松、头孢吡肟、氨曲南、阿米卡星、庆大霉素、左氧氟沙星、环丙沙星、呋喃妥因、复方磺胺甲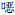
采用RT-PCR扩增CRKP中耐消毒剂的qacEΔ1、cepA基因,根据GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中基因序列(qacEΔ1:DQ489717.1,cepA: AB073019.1),利用Primer Premier 5软件合理设计qacEΔ1、cepA基因引物,见表 1。参照细菌DNA提取试剂盒说明书提取DNA,设定PCR反应条件,PCR反应体系共20 μL,包括PCR反应试剂mix 10 μL,上、下游引物各0.8 μL,探针0.4 μL,DNA模板1 μL,加双蒸H2O补足体积。扩增条件为94℃,10 min;95℃ 10 s,58℃ 30 s,72℃ 1 s,40个循环。通过荧光扩增曲线观察结果。
| 表 1 耐消毒剂基因的RT-PCR引物序列 Table 1 Real-time PCR primers for disinfectant resistance genes |

|
采用PFGE对同时携带qacEΔ1和cepA耐消毒剂基因的CRKP菌株进行同源性分析。参考中国疾病预防控制中心Pulse Net提供的PFGE相关标准化操作程序,调整相关电泳参数。试验方法:菌株包埋入胶块后,经裂解和清洗,使用限制性内切酶XbaI进行酶切,酶切后的胶块置入0.5×TBE缓冲液和1%凝胶中电泳。电泳参数为电压6 V/cm,夹角120度,温度14℃,初始脉冲为6 s,最终脉冲为36 s,电泳时间18.5 h。电泳结束后,在凝胶成像仪上读取图像。
1.6 数据分析应用WHONET 5.6和SPSS 25.0软件进行数据分析。采用BioNumerics 7.6软件对PFGE条带进行聚类分析,用非加权配对算术平均法(unweighted pair group average method, UPGAM)和Dice系数分析菌株间的同源性,将具有80%以上相同条带的菌株归入同一型别[11]。
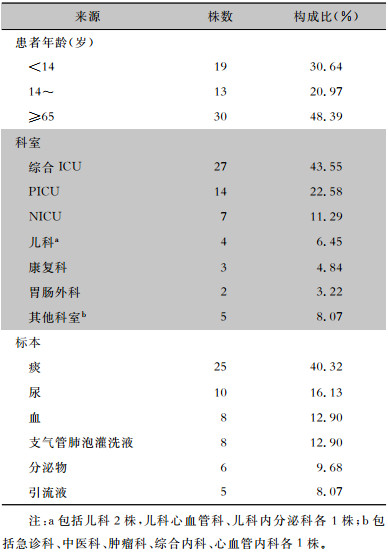
2 结果 2.1 基本情况62株CRKP来源于3所医院13个不同的临床科室,主要分布在重症监护病房(ICU),占77.42%,其中综合ICU、儿科ICU(PICU)、神经内科ICU(NICU)分别占43.55%、22.58%、11.29%。按照年龄分组,老年人(≥65岁)组占比最高,为48.39%,其次为儿童(<14岁)组和成人(14~65岁)组,分别占30.64%、20.97%。62株CRKP主要来源于痰(占40.32%),其次为尿标本(占16.13%)。见表 2。
| 表 2 62株CRKP来源情况 Table 2 Sources of 62 CRKP strains |
|
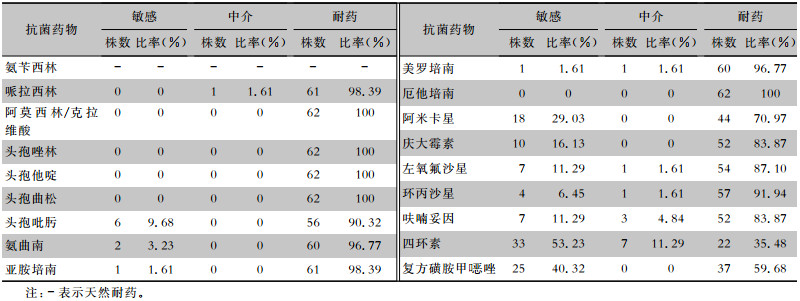
62株CRKP均为多重耐药菌,对阿莫西林/克拉维酸、头孢唑林、头孢他啶、头孢曲松和厄他培南5种抗生素的耐药率均为100%,对四环素的耐药率最低(为35.48%),对临床其他常见抗菌药物也呈现高度耐药,耐药率为59.68%~98.39%。见表 3。
| 表 3 62株CRKP药敏试验结果 Table 3 Antimicrobial susceptibility testing results of 62 CRKP strains |
|
62株CRKP,59株(95.16%)检出耐消毒剂基因,其中40株(64.52%)qacEΔ1基因阳性,57株(91.94%)cepA基因阳性,38株(61.29%)同时检出qacEΔ1和cepA基因。
2.4 同源性分析PFGE结果显示,38株同时检出qacEΔ1和cepA的CRKP可分为A~K共11个型别。其中5个型别包含菌株数>1株,以E型为主,占42.11%(16株),分布在2所医院的5个科室;C型占15.79%(6株),分布在1所医院的3个科室;I型占10.53%(4株),分布于同一医院的同一科室;H型和K型,均占7.89%(各3株),分布于同一医院的不同科室。见图 1。
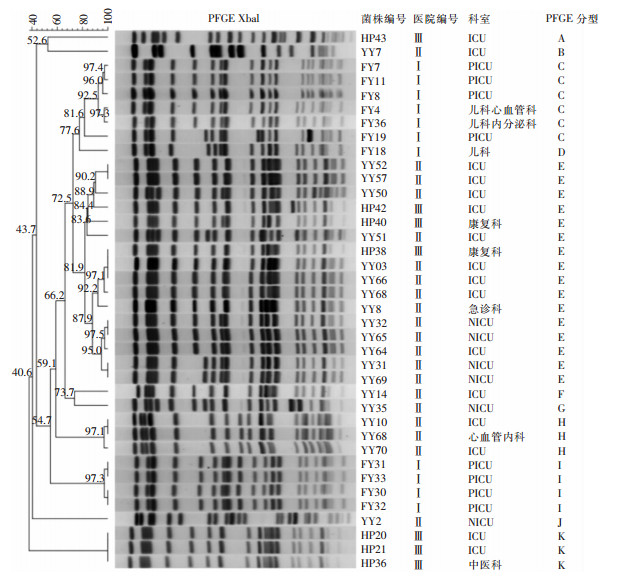 |
| 图 1 38株CRKP菌株PFGE分型结果 Figure 1 PFGE typing result of 38 CRKP strains |
本研究收集来自武汉地区3所三级医院临床住院患者分离的62株CRKP,首次分析本地区CRKP耐消毒剂基因的携带情况及耐消毒剂基因阳性菌株的同源性,是对国内CRKP菌株多中心分子流行病学研究的有力补充。该研究收集的CRKP,主要来源于ICU,包括综合ICU和专科ICU,占77.42%,可能与ICU患者大多数免疫力低下、基础性疾病较多、住院时间长、插管或机械通气等侵入性操作较多有关。应重点加强ICU抗菌药物应用的管理及医院感染防控工作。62株CRKP,40.32%来源于痰标本,可能与人体的呼吸道与外界相通,自身免疫屏障作用较弱,再加上空气污染等因素相关,病原体更容易入侵定植,从而引起呼吸系统感染,提示临床医生应重点加强患者的气道管理。
本研究显示,所有CRKP均为多重耐药菌,对厄他培南的耐药率达100%,对美罗培南、亚胺培南的耐药率分别为96.77%、98.39%,对青霉素类、β-内酰胺类/β-内酰胺抑制剂复合物、头孢菌素类、单环内酰胺类和喹诺酮类等多种抗菌药物表现出高水平耐药,仅对四环素的耐药率低于40%,说明武汉地区CRKP耐药形势十分严峻,与北京[12]、广东[13]、江西[14]等地情况一致,应加强细菌耐药监测,在抗菌药物使用前进行病原学送检及药敏试验,为临床合理用药提供参考。
目前研究显示,肺炎克雷伯菌对各种消毒剂的耐受程度存在差异。李祥等[15]研究报道,部分CRKP已对“84”消毒剂产生了轻度的抗性,耐消毒剂基因qacEΔ1-sul1与“84”消毒剂的抗性之间存在一定的相关性。qacEΔ1基因广泛存在于革兰阴性菌中,由整合子介导,与消毒剂的低水平耐药有关。Abuzaid等[8]研究报道,87.5%的肺炎克雷伯菌分离株携带cepA基因;Chen等[16]研究报道2016—2018年一所国内三级医院的36株CRKP,qacEΔ1阳性率为41.7%,cepA阳性率为80.6%;雷新云等[17]报道,肺炎克雷伯菌中qacEΔ1检出率为62.50%。而在伊朗的一项研究[10]报道,肺炎克雷伯菌中qacEΔ1和cepA基因检出率仅分别为30.6%、22.4%。本研究显示61.29%的CRKP同时携带qacEΔ1和cepA基因,其中qacEΔ1和cepA基因检出率分别为64.52%、91.94%,cepA基因检出率远高于qacEΔ1,提示qacEΔ1和cepA基因在医疗机构分离的CRKP中广泛存在,且携带cepA基因情况比携带qacEΔ1更为普遍。以上结果说明武汉地区CRKP菌株广泛携带qacEΔ1和cepA耐消毒剂基因,因此,应加强本地区耐消毒剂基因的监测,建立消毒剂耐药性监测网,定期监测和报告耐药情况,以期指导医疗机构科学选择消毒剂。
根据《医院感染暴发控制指南》(WS/T 524—2016)[18]规定,医院感染暴发是指在医疗机构或其科室的患者中,短时间内发生3例以上同种同源感染病例的现象。在实际工作中,由于大多数医疗机构缺乏分子生物学监测技术手段,很难确认“同种同源”,可能导致出现耐药菌株的流行或暴发。PFGE分型技术是分子分型中最常采用的方法,具有分辨力高、重复性好的特点,被认为是暴发感染溯源中分型的“金标准”[11]。本研究采用PFGE对38株同时携带qacEΔ1和cepA基因的CRKP进行同源性分析,结果显示,38株CRKP可分为A~K共11个型,以E型为主(42.11%),主要分布于2所医院的5个科室,一所医院的ICU和康复科,另一所医院的ICU、NICU和急诊科,表明CRKP菌株存在跨医院水平克隆传播的可能。另外,C型、H型、K型主要分布在同一所医院的几个科室,提示CRKP菌株在3所医院均存在不同科室间的克隆传播。I型分布在一所医院的同一科室,进一步分析发现,此4例患者于2018年11月5—22日在PICU住院,1例患者因重症肺炎于11月5日最早入住PICU,其余3例患者因脓毒症、惊厥等疾病,分别于11月10日、15日、22日陆续入住该科室,结果提示CRKP存在同一科室内不同患者间的克隆传播,说明该院PICU可能存在CRKP医院感染暴发。当医疗机构内出现CRKP菌株后,如果缺乏及时有效的消毒措施,易于发生CRKP感染暴发流行。因此,当医疗机构出现感染性病例,尤其是疑似医院感染暴发时,应提高警惕,及时收集菌株,采用PFGE等分子流行病学方法快速查明感染源,有助于从切断感染途径方面入手,控制多重耐药菌的传播[19]。
综上所述,武汉地区CRKP耐药形势严峻,广泛携带耐消毒剂基因,存在不同医院、不同科室间的克隆传播,应采取有效的消毒隔离措施,科学使用消毒剂,切断传播途径,从而有效控制医院感染的发生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Munoz-Price LS, Poirel L, Bonomo RA, et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J]. Lancet Infect Dis, 2013, 13(9): 785-796. DOI:10.1016/S1473-3099(13)70190-7 |
| [2] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年耐碳青霉烯类肺炎克雷伯菌流行病学变迁[J]. 中国感染控制杂志, 2021, 20(2): 175-179. China Antimicrobial Resistance Surveillance System. Epidemio-logical change in carbapenem-resistant Klebsiella pneumoniae: surveillance report from China Antimicrobial Resistance Surveillance in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(2): 175-179. |
| [3] |
Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria[J]. Lancet Infect Dis, 2009, 9(4): 228-236. DOI:10.1016/S1473-3099(09)70054-4 |
| [4] |
Iredell J, Brown J, Tagg K. Antibiotic resistance in Entero-bacteriaceae: mechanisms and clinical implications[J]. BMJ, 2016, 352: h6420. |
| [5] |
Xu LF, Sun XX, Ma XL. Systematic review and Meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae[J]. Ann Clin Microbiol Antimicrob, 2017, 16(1): 18. DOI:10.1186/s12941-017-0191-3 |
| [6] |
吴舜, 周燕. 细菌对消毒剂的检测方法与耐药机制研究进展[J]. 海南医学, 2018, 29(8): 1142-1145. Wu S, Zhou Y. Research progress of detection methods and drug resistance mechanism in bacterial resistance to disinfec-tants[J]. Hainan Medical Journal, 2018, 29(8): 1142-1145. DOI:10.3969/j.issn.1003-6350.2018.08.031 |
| [7] |
Fang CT, Chen HC, Chuang YP, et al. Cloning of a cation efflux pump gene associated with chlorhexidine resistance in Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2002, 46(6): 2024-2028. DOI:10.1128/AAC.46.6.2024-2028.2002 |
| [8] |
Abuzaid AA, Amyes SGB. The genetic environment of the antiseptic resistance genes qacEΔ1 and cepA in Klebsiella pneumoniae[J]. J Chemother, 2015, 27(3): 139-144. DOI:10.1179/1973947814Y.0000000181 |
| [9] |
Abuzaid A, Hamouda A, Amyes SGB. Klebsiella pneumoniae susceptibility to biocides and its association with cepA, qacΔE and qacE efflux pump genes and antibiotic resistance[J]. J Hosp Infect, 2012, 81(2): 87-91. DOI:10.1016/j.jhin.2012.03.003 |
| [10] |
Azadpour M, Nowroozi J, Goudarzi GR, et al. Presence of qacEΔ1 and cepA genes and susceptibility to a hospital biocide in clinical isolates of Klebsiella pneumoniae in Iran[J]. Trop Biomed, 2015, 32(1): 109-115. |
| [11] |
Neoh HM, Tan XE, Sapri HF, et al. Pulsed-field gel electrophoresis (PFGE): a review of the "gold standard" for bacteria typing and current alternatives[J]. Infect Genet Evol, 2019, 74: 103935. DOI:10.1016/j.meegid.2019.103935 |
| [12] |
张凡, 李耘, 甘露, 等. 北京市2016—2017年耐碳青霉烯类肺炎克雷伯菌分子流行病学和遗传特征调查[J]. 中国抗生素杂志, 2020, 45(6): 610-620. Zhang F, Li Y, Gan L, et al. Investigation on molecular epidemiology and genetic characteristics of carbapenem-resistant Klebsiella pneumoniae in Beijing from 2016 to 2017[J]. Chinese Journal of Antibiotics, 2020, 45(6): 610-620. DOI:10.3969/j.issn.1001-8689.2020.06.013 |
| [13] |
黄静敏, 柯碧霞, 何冬梅, 等. 广东地区耐碳青霉烯类肺炎克雷伯菌耐药性及分子流行病学特征[J]. 中华医院感染学杂志, 2022, 32(6): 813-818. Huang JM, Ke BX, He DM, et al. Drug resistance and molecu-lar epidemiological characteristics of carbapenem-resistant Klebsiella pneumoniae in Guangdong[J]. Chinese Journal of Nosocomiology, 2022, 32(6): 813-818. |
| [14] |
刘岩, 曾凌, 卢才菊, 等. 2018—2020年江西省高毒力耐碳青霉烯类肺炎克雷伯菌分子流行病学特征[J]. 中华医院感染学杂志, 2023, 33(11): 1601-1606. Liu Y, Zeng L, Lu CJ, et al. Molecular epidemiological chara-cteristics of highly virulent carbapenem-resistant Klebsiella pneumoniae in Jiangxi Province from 2018 to 2020[J]. Chinese Journal of Nosocomiology, 2023, 33(11): 1601-1606. |
| [15] |
李祥, 鲁辛辛. 耐碳青霉烯类肺炎克雷伯菌对84消毒液抗性的试验研究[J]. 中国消毒学杂志, 2020, 37(8): 564-566. Li X, Lu XX. Experimental study on the resistance of carbape-nem-resistant Klebsiella pneumoniae to 84 disinfectant[J]. Chinese Journal of Disinfection, 2020, 37(8): 564-566. |
| [16] |
Chen YL, Liao K, Huang YX, et al. Determining the susceptibility of carbapenem-resistant Klebsiella pneumoniae and Escherichia coli strains against common disinfectants at a ter-tiary hospital in China[J]. BMC Infect Dis, 2020, 20(1): 88. |
| [17] |
雷新云, 金正江. 消毒剂耐药基因qacEΔ1对新生儿科常见革兰阴性菌耐药性的影响[J]. 中国感染控制杂志, 2015, 14(1): 20-22, 34. Lei XY, Jin ZJ. Effect of disinfectant resistance gene qacEΔ1 on the drug resistance of commonly isolated Gram-negative bacteria in neonatal intensive care unit[J]. Chinese Journal of Infection Control, 2015, 14(1): 20-22, 34. |
| [18] |
中华人民共和国国家卫生和计划生育委员会. 医院感染暴发控制指南: WS/T 524—2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China. Guideline of control of healthcare associated infection outbreak: WS/T 524-2016[S]. Beijing: Standards Press of China, 2017. |
| [19] |
贺文芳, 周柯, 周磊, 等. MLST和PFGE在耐碳青霉烯类肺炎克雷伯菌医院感染监测中的应用[J]. 中国感染控制杂志, 2020, 19(6): 533-538. He WF, Zhou K, Zhou L, et al. Application of MLST and PFGE in the monitoring of carbapenem-resistant Klebsiella pneumoniae healthcare-associated infection[J]. Chinese Journal of Infection Control, 2020, 19(6): 533-538. |



