2. 上海交通大学附属第一人民医院医院感染管理科, 上海 201620
2. Department of Healthcare-associated Infection Management, First People's Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 201620, China
多重耐药菌(multidrug-resistant organism, MDRO)主要是指对临床使用的3类或3类以上抗菌药物同时呈现耐药的细菌[1],近年来MDRO感染已成为一个全球性的卫生问题[2]。重症监护病房(intensive care unit, ICU)收治的患者病情危重,自身免疫差,频繁使用多种广谱抗菌药物,侵入性诊疗操作多,是医院MDRO感染的高危人群[3-4]。研究[5-6]显示,积极的MDRO入院筛查有助于早期识别MDRO感染或定植患者,从而尽早采取相关措施,对MDRO感染的预防和控制有重要价值。目前ICU大多数MDRO感染为社区感染,应加强对MDRO来源的识别,采取更为精准和及时的感染防控措施[7];但也有研究[8-9]认为,MDRO主动筛查的灵敏度和特异度较低,存在大量的假阴性结果,临床预测价值不高,且医务人员会疏于标准预防而增加医院感染发生率[10]。因此在临床工作中,根据医院所在地区MDRO分布特点,选择灵敏度和特异度较高的筛查方法对降低MDRO医院感染发病率非常重要。
目前,笔者所在医院MDRO入院筛查方法为咽拭子采样,病原菌的来源部位集中在呼吸道,缺乏对部分革兰阴性菌的针对性筛查。因此,本研究对入住该院ICU患者进行咽拭子联合肛拭子的MDRO入院筛查,对检出阳性的患者及时进行接触隔离。通过分析入院筛查前后同期的MDRO入院筛查阳性率与医院感染发病率,并通过比较肛拭子与咽拭子MDRO入院筛查阳性率、MDRO种类、入院筛查的灵敏度和特异度,为ICU MDRO入院筛查的选择提供参考依据。
1 对象与方法 1.1 研究对象本研究选取上海地区某院2021年8月1日—12月31日入住ICU 24 h内进行咽拭子MDRO入院筛查的患者作为对照组;选取2022年8月1日—12月31日入住ICU 24 h内进行咽拭子联合肛拭子MDRO入院筛查的患者作为试验组。对于同期同一患者多次入住ICU,且入院筛查有≥2次相同结果时,仅统计第1次筛查结果。排除标准:①采集咽拭子或肛拭子不能配合的患者;②治疗不足48 h出院或死亡的患者。
1.2 研究方法 1.2.1 干预方法对两组MDRO入院筛查阳性的患者及时采取接触隔离措施,未进行去定植。两组MDRO入院筛查阳性的患者,需连续2次病原学检查结果均为阴性(间隔需>24 h),方可解除隔离。两组患者如在入院48 h后出现感染症状,则采集痰液/粪便或其他存在活动性感染部位(如伤口渗出、引流物及导管部位)的标本进行细菌学培养。
1.2.2 MDRO入院筛查方法两组患者入院后24 h内由院感科统一培训的护士采集咽拭子或/和肛拭子标本。将正确采集的拭子封闭后插入运送培养基,并于2 h内将标本送至微生物实验室检测。
1.2.3 MDRO的定义按照《MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议》[1]对MDRO进行判定。
1.2.4 MDRO的种类按照国家卫生与计划生育委员会颁布的《医院感染管理质量控制指标(2015版)》[11]监测的重点MDRO种类,包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)、耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii, CRAB)、耐碳青霉烯类铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa, CRPA)、耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)等。
1.2.5 诊断标准患者入院筛查检出MDRO,并符合MDRO感染诊断标准判定为社区感染;患者入院筛查检出MDRO,但无感染症状判定为定植。患者入院48 h后发生的MDRO感染判定为MDRO医院感染。MDRO感染诊断依据为2001年《医院感染诊断标准(试行)》[12]和2011年版《多重耐药菌医院感染预防与控制技术指南(试行)》[13],同一患者相同部位分离的相同菌株不重复计数。
1.3 统计分析应用SPSS 26.0统计软件对数据进行处理分析。计量资料比较采用t检验,计数资料比较采用χ2检验,其中对1<理论频数<5,采用χ2校正检验;对理论频数<1,采用Fisher确切概率法。以P≤0.05为差异有统计学意义。
2 结果 2.1 患者基本特征共纳入917例患者,其中试验组442例,对照组475例。两组患者在性别、年龄、是否留置三管(导尿管、中心静脉导管、呼吸机导管)、主要疾病种类比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 两组患者基本特征比较 Table 1 Comparison of general conditions between two groups of patients |

|
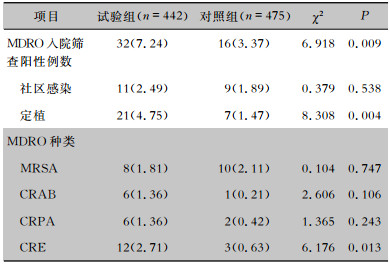
试验组与对照组患者分别有32例(7.24%)、16例(3.37%)至少检出1种MDRO,差异有统计学意义(P<0.05)。试验组与对照组患者MDRO社区感染发病率分别为2.49%、1.89%,差异无统计学意义(P>0.05)。试验组与对照组患者MDRO定植率分别为4.75%、1.47%,差异有统计学意义(P<0.05)。MDRO入院筛查种类中,试验组患者入院筛查CRE检出率高于对照组,差异有统计学意义(P<0.05)。两组患者入院筛查MRSA、CRPA、CRAB的检出率比较,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 两组患者MDRO入院筛查情况[例(%)] Table 2 MDRO admission screening for two groups of patients (No. of cases [%]) |
|
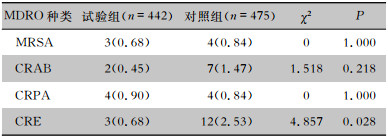
试验组与对照组患者MDRO医院感染发病率分别为2.71%(12例)、5.68%(27例),差异有统计学意义(χ2=4.957,P=0.026);其中试验组CRE医院感染发病率低于对照组,差异有统计学意义(P<0.05)。见表 3。
| 表 3 两组患者不同MDRO医院感染情况[例(%)] Table 3 HAI with various MDRO in two groups of patients (No. of cases [%]) |
|
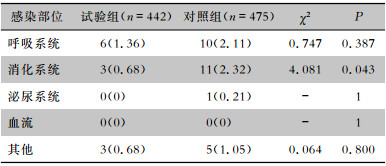
试验组与对照组患者消化系统MDRO医院感染发病率分别为0.68%、2.32%,差异有统计学意义(P<0.05)。试验组与对照组患者的呼吸系统、泌尿系统、血流以及其他部位MDRO医院感染发病率比较,差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 两组患者MDRO医院感染部位情况[例(%)] Table 4 Sites of HAI with MDRO in two groups of patients (No. of cases [%]) |
|
以试验组中2种筛查方式结果作为检验变量,试验组患者是否发生MDRO医院感染作为状态变量,绘制受试者工作特征(ROC)曲线。如图 1所示,咽拭子入院筛查ROC曲线下面积为0.697(P<0.01,95%CI:0.558~0.836),面积标准误为0.071;肛拭子入院筛查ROC曲线下面积为0.814(P<0.01,95%CI:0.689~0.938),面积标准误为0.063;咽拭子联合肛拭子入院筛查ROC曲线下面积为0.897(P<0.01,95%CI:0.802~0.993),面积标准误为0.049。
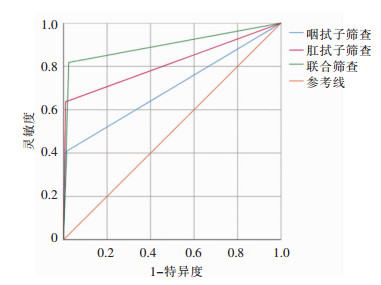 |
| 图 1 不同MDRO入院筛查方式的ROC曲线 Figure 1 ROC curves of different admission screening me-thods for MDRO |
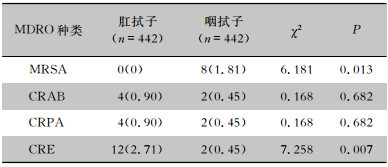
试验组442例患者均采集了咽拭子和肛拭子标本,共884份标本分离出34株MDRO,其中肛拭子标本CRE筛查的阳性率高于咽拭子标本,咽拭子标本MRSA筛查阳性率高于肛拭子标本,差异均有统计学意义(均P<0.05)。见表 5。
| 表 5 试验组患者咽拭子和肛拭子MDRO筛查阳性情况[例(%)] Table 5 Positive result of MDRO screening by pharyngeal swabs and anal swabs in patients in the experimental group (No. of cases [%]) |
|
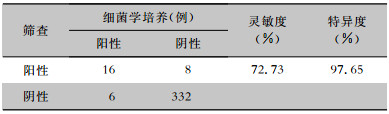
试验组442例患者中,有362例留取了细菌学培养,将结果作为金标准与入院筛查结果进行比对。咽拭子入院筛查MDRO检出灵敏度为31.82%,特异度为98.53%;肛拭子入院筛查MDRO检出灵敏度为63.64%,特异度为99.12%;咽拭子联合肛拭子入院筛查MDRO检出灵敏度72.73%,特异度为97.65%,见表 6。
| 表 6 试验组咽拭子联合肛拭子入院筛查MDRO检出灵敏度和特异度 Table 6 Sensitivity and specificity of admission screening for MDRO by pharyngeal swabs combined with anal swabs in the experimental group |
|
MDRO医院感染不仅延长患者的住院日数,还会增加患者的住院费用[14-15]。根据医院所在地区MDRO的流行情况,进行针对性的入院筛查,及时检出定植或感染患者进行接触隔离,对控制医院内MDRO传播极为重要。粪便、痰、胃液等标本,由于留取难度较大且成本较高,故不适合作为常规入院筛查手段,可作为高风险人群的主动筛查。肛拭子与咽拭子留取标本的难度较小且留取标本所需的时间也较短,从操作角度适合作为MDRO入院筛查。同时本研究结果显示,肛拭子与咽拭子入院筛查的MDRO种类不同,其中肛拭子对CRE筛查的阳性率较高,但对MRSA筛查的阳性率低;而咽拭子对MRSA筛查的阳性率较高,但对CRE筛查的阳性率较低,提示2种方法联合有很好的互补作用,且可以提高MDRO入院筛查阳性率。
根据2020年全国细菌耐药监测报告,在纳入分析的3 249 123株细菌中,革兰阴性菌占71.1%,革兰阳性菌占28.9%;其中分离率居前5位的革兰阴性菌分别为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和阴沟肠杆菌,且上海地区肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌对碳青霉烯类药物耐药率均明显高于全国平均水平[16]。因此,对患者进行针对性的入院筛查,及时对定植或感染的患者进行接触隔离,对降低MDRO医院感染发病率有很大的意义[17-18]。本研究发现,咽拭子联合肛拭子的MDRO入院筛查与单纯的咽拭子比较,可以提高对CRE的检出率;与研究[19-20]结果基本一致。同时肛拭子入院筛查对CRAB和CRPA的检出率也有一定提升,这可能和肛拭子的采样准确性高于咽拭子有关。因此对于医院感染的重点科室使用肛拭子作为MDRO入院筛查可以有效提高对革兰阴性菌的检出率,从而对此类患者进行及时的接触隔离。
本研究的患者疾病种类以神经系统为主。神经系统的患者大多数存在自主神经功能性障碍、机械通气操作、糖皮质激素药物使用以及胃肠功能障碍等因素,是MDRO医院感染的高发人群[21]。在国内不同MDRO菌种的分布上,一项研究[21]显示,CRE主要分布在神经外科;而孙景熙等[22]研究显示,MRSA主要分布在神经外科(23.7%)、ICU(19.8%)和呼吸内科(13.3%);龙盛双等[23]研究显示,CRE主要分布在新生儿科和ICU,而MSRA主要分布在烧伤整形科与皮肤科。因此从医院感染管理的角度来讲,根据医院所在地区情况,以及不同科室的MDRO分布特点设立具有针对性的MDRO入院筛查是很有必要的。
同时本研究发现,咽拭子联合肛拭子作为ICU MDRO入院筛查方法具有良好的灵敏度与特异度,可以作为本院ICU患者常规MDRO入院筛查项目。对照组与试验组在CRE的入院筛查率和医院感染发病率上有差别,其原因可能是对照组单纯咽拭子的入院筛查对CRE的筛查率较低,导致CRE定植患者漏筛,没有及时对其进行接触隔离,从而可能发生CRE医院内传播;而CRE社区感染患者,是否可能由于咽拭子入院筛查的假阴性,导致CRE在后续被检出,从而成为“医院感染”患者,也是一个值得探索的问题。因此,对医院感染管理而言,降低MDRO入院筛查的假阴性率不仅可以减少患者医院感染的发生,更能提高相关数据的准确性,为下一步制定措施提供参考依据。
本研究具有一定局限性。首先在研究周期和样本量上,由于上海地区2022年上半年的管控措施,住院患者数量下降,使这一阶段的数据参考价值降低,故没有纳入本次研究之中。其次,本研究并未分析经济效益。目前仍有研究[9]表明,MDRO主动筛查的经济效益不足。造成这一结果的原因可能是多方面的,如主动筛查的次数、方式,以及目标人群的差异等。未来还有待进一步延长研究周期并进行经济效益分析。
综上所述,咽拭子联合肛拭子MDRO入院筛查可以作为上海地区ICU患者MDRO定植的有效筛查手段;肛拭子与咽拭子的入院筛查MDRO种类有明显差异性,设立MDRO的联合入院筛查,可有效提高MDRO定植患者的筛查阳性率,有利于医院感染相关管理。而关于MDRO联合入院筛查所带来的经济收益需要后续研究进一步证实。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64. Li CH, Wu AH. Interim standard definition for MDR, XDR, and PDR multidrug-resistant bacteria-International expert recommendations[J]. Chinese Journal of Infection Control, 2014, 13(1): 62-64. |
| [2] |
王力红, 赵霞. 我国医疗机构多重耐药菌防控的管理要求与实践[J]. 中国护理管理, 2019, 19(8): 1135-1138. Wang LH, Zhao X. Management and practice in prevention and control of multidrug-resistant organism in medical institutions in China[J]. Chinese Nursing Management, 2019, 19(8): 1135-1138. |
| [3] |
Masson-Roy S, Saito H, Pittet D. The WHO 2018 hand hygiene campaign: make a difference-prevent sepsis in health care[J]. Am J Respir Crit Care Med, 2018, 197(8): 985-986. DOI:10.1164/rccm.201802-0362ED |
| [4] |
Sultan AM, Seliem WA. Identifying risk factors for healthcare-associated infections caused by carbapenem-resistant Acinetobacter baumannii in a neonatal intensive care unit[J]. Sultan Qaboos Univ Med J, 2018, 18(1): e75-e80. DOI:10.18295/squmj.2018.18.01.012 |
| [5] |
曾秀玉, 张华平, 陈夏容, 等. 多药耐药菌主动筛查在ICU医院感染预防控制中的价值[J]. 中华医院感染学杂志, 2016, 26(10): 2373-2375. Zeng XY, Zhang HP, Chen XR, et al. Value of active scree-ning of multidrug-resistant organisms in control of nosocomial infections in ICU[J]. Chinese Journal of Nosocomiology, 2016, 26(10): 2373-2375. |
| [6] |
祝丽君, 陈上仲, 林晨. 隔离干预对控制重症监护病房多重耐药菌定植的研究[J]. 中国消毒学杂志, 2020, 37(10): 744-747. Zhu LJ, Chen SZ, Lin C. Study on isolation intervention to control multi-drug resistance colonization in ICU[J]. Chinese Journal of Disinfection, 2020, 37(10): 744-747. |
| [7] |
李占结, 刘波, 李惠芬, 等. ICU多重耐药菌感染分布与来源研究[J]. 中华医院感染学杂志, 2019, 29(8): 1165-1170. Li ZJ, Liu B, Li HF, et al. Study on distribution and source of multi-drug resistant bacteria infection in ICUs[J]. Chinese Journal of Nosocomiology, 2019, 29(8): 1165-1170. |
| [8] |
Strich JR, Palmore TN. Preventing transmission of multidrug-resistant pathogens in the intensive care unit[J]. Infect Dis Clin North Am, 2017, 31(3): 535-550. |
| [9] |
Robotham JV, Deeny SR, Fuller C, et al. Cost-effectiveness of national mandatory screening of all admissions to English National Health Service hospitals for meticillin-resistant Staphylococcus aureus: a mathematical modelling study[J]. Lancet Infect Dis, 2016, 16(3): 348-356. |
| [10] |
Lemmen SW, Lewalter K. Antibiotic stewardship and horizontal infection control are more effective than screening, isolation and eradication[J]. Infection, 2018, 46(5): 581-590. |
| [11] |
中华人民共和国国家卫生与计划生育委员会医政管理局. 国家卫生计生委办公厅关于印发麻醉等6个专业质控指标(2015年版)的通知: 国卫办医函〔2015〕252号[EB/OL]. (2015-04-10)[2018-12-01]. http://www.nhc.gov.cn/yzygj/s3585/201504/5fa7461c3d044cb6a93eb6cc6eece087.shtml. Administration Bureau of the National Health Commission of the People's Republic of China. Notice of the General Office of the National Health and Family Planning Commission on the issuance of six professional quality control indicators for anesthesia and other aspects (2015 Edition): Guo Wei Ban Yi Han[2015] No. 252[EB/OL]. (2015-04-10)[2018-12-01]. http://www.nhc.gov.cn/yzygj/s3585/201504/5fa7461c3d044cb6a93eb6cc6eece087.shtml. |
| [12] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the People's Republic of China. Diagnostic criteria for nosocomial infections(proposed)[J]. Natio-nal Medical Journal of China, 2001, 81(5): 314-320. |
| [13] |
中华人民共和国卫生部. 多重耐药菌医院感染预防与控制技术指南(试行)[J]. 中国危重病急救医学, 2011, 23(2): 2095-4352. Ministry of Health of the People's Republic of China. Technical guidelines for the prevention and control of multidrug resistant bacterial nosocomial infections(trial)[J]. Chinese Critical Care Medicine, 2011, 23(2): 2095-4352. |
| [14] |
郭轶斌, 郭威, 邱佩琪, 等. 多药耐药与非耐药鲍曼不动杆菌院内感染的归因住院费用与住院时长研究[J]. 中国卫生统计, 2017, 34(3): 378-381. Guo YB, Guo W, Qiu PQ, et al. Study of attributive hospita-lized cost and length of stay for hospital acquired infection due to multidrug resistance and none-resistance Acinetobacter baumannii[J]. Chinese Journal of Health Statistics, 2017, 34(3): 378-381. |
| [15] |
Kollef MH, Bassetti M, Francois B, et al. The intensive care medicine research agenda on multidrug-resistant bacteria, antibiotics, and stewardship[J]. Intensive Care Med, 2017, 43(9): 1187-1197. |
| [16] |
全国细菌耐药监测网. 2020年全国细菌耐药监测报告[J]. 中华检验医学杂志, 2022, 45(2): 122-136. China Antimicrobial Resistance Surveillance System. 2020 national antimicrobial resistance surveillance report[J]. Chinese Journal of Laboratory Medicine, 2022, 45(2): 122-136. |
| [17] |
Coppéré Z, Voiriot G, Blayau C, et al. Disparity of the "screen-and-isolate" policy for multidrug-resistant organisms: a national survey in French adult ICUs[J]. Am J Infect Control, 2018, 46(12): 1322-1328. |
| [18] |
Jones M, Nielson C, Gupta K, et al. Collateral benefit of screening patients for methicillin-resistant Staphylococcus aureus at hospital admission: isolation of patients with multidrug-resistant Gram-negative bacteria[J]. Am J Infect Control, 2015, 43(1): 31-34. |
| [19] |
贺法强. 肛拭子主动筛查对耐碳青霉烯类肠杆菌感染的预测效能评估[D]. 唐山: 华北理工大学, 2019. He FQ. Predictive efficacy of anal swab screening for carbape-nem-resistant Enterobacteriaceae infection[D]. Tangshan: North China University of Science and Technology, 2019. |
| [20] |
徐春晖, 宿扬, 吕燕霞, 等. 肛周皮肤拭子细菌培养对血液病患者耐碳青霉烯类肠杆菌血流感染的预警价值[J]. 中华血液学杂志, 2018, 39(12): 1021-1025. Xu CH, Su Y, Lv YX, et al. Perianal swabs surveillance cultures of carbapenem-resistant Enterobacteriaceae(CRE) can be hints for CRE bloodstream infection in patients with hematological diseases[J]. Chinese Journal of Hematology, 2018, 39(12): 1021-1025. |
| [21] |
文江力, 易竟, 梅涛, 等. 神经外科耐碳青霉烯类肠杆菌医院感染耐药特征及危险因素[J]. 中华医院感染学杂志, 2022, 32(21): 3273-3277. Wen JL, Yi J, Mei T, et al. Drug resistance characteristics of carbapenem-resistant Enterobacteriaceae causing nosocomial infection in neurosurgery department patients and risk factors[J]. Chinese Journal of Nosocomiology, 2022, 32(21): 3273-3277. |
| [22] |
孙景熙, 王福斌, 王广芬, 等. 2013—2016年医院金黄色葡萄球菌分布特点及耐药性分析[J]. 中华医院感染学杂志, 2017, 27(12): 2680-2682. Sun JX, Wang FB, Wang GF, et al. Clinical distribution chara-cteristics and drug resistance analysis of Staphylococcus aureus of our hospital from 2013 to 2016[J]. Chinese Journal of Nosocomiology, 2017, 27(12): 2680-2682. |
| [23] |
龙盛双, 胡潇云, 张啟鹏, 等. 多重耐药菌的科室分布及院内感染控制[J]. 中国消毒学杂志, 2016, 33(10): 986-988. Long SS, Hu XY, Zhang QP, et al. Department distribution of multidrug-resistant organisms and the infection control of some hospital[J]. Chinese Journal of Disinfection, 2016, 33(10): 986-988. |



