2. 安徽医科大学附属阜阳医院检验科, 安徽 阜阳 236000;
3. 安徽医科大学第二附属医院检验科, 安徽 合肥 230601
2. Department of Laboratory Medicine, Fuyang Hospital of Anhui Medical University, Fuyang 236000, China;
3. Department of Laboratory Medicine, The Second Affiliated Hospital of Anhui Medical University, Hefei 230601, China
随着抗生素、糖皮质激素、抗肿瘤药物在临床广泛应用及创伤手术增加,耐碳青霉烯类肠杆菌(carbapenem-resistant Enterobacterales, CRE)临床检出逐年增加[1],CRE引起的感染发病率和病死率也不断增高,给临床带来严重挑战,已威胁全球公共健康。新抗菌药物的开发需要时间,重新组合失效的抗菌药物成为另一种解决方案,有研究[2]报道联合治疗比单一治疗病死率更低。临床很少单独使用碳青霉烯类抗生素治疗CRE感染,多见碳青霉烯类联合多粘菌素类、替加环素、磷霉素(FOS)[3]。头孢他啶/阿维巴坦(CZA)单独或联合氨曲南(ATM)治疗CRE也是一种好的选择[4]。本文采用棋盘稀释法联合药敏试验,探讨以亚胺培南(IPM)、美罗培南(MEM)为代表的碳青霉烯类抗生素分别与其他5种抗生素联合的方案,及CZA联合ATM方案对CRE的体外活性,为临床治疗提供试验依据。
1 资料与方法 1.1 菌株收集2017年8月—2021年3月安徽某医院检验科临床标本分离的非重复CRE 128株,其中,肺炎克雷伯菌(KP)93株,弗氏柠檬酸杆菌(CFR)2株,阴沟肠杆菌(ECL)5株(IPM与MEM敏感4株),黏质沙雷菌(SMA)4株,产气肠杆菌(EAE)1株,产酸克雷伯菌(KOX)2株,大肠埃希菌(ECO)21株(IPM与MEM敏感10株)。从中选取KP 25株、ECO 9株、ECL 1株、CFR 2株、KOX 1株,共38株CRE。基因型分类为KPC 22株、NDM 15株、IMP 1株。质控菌株为大肠埃希菌ATCC 25922、大肠埃希菌ATCC BAA-1705、大肠埃希菌ATCC BAA-2146。
1.2 培养基和抗菌药物药敏试验用英国OXOID公司阳离子调节Mueller-Hinton肉汤。抗菌药物纸片为英国OXOID公司商品。抗菌药物粉剂IPM、头孢他啶(CAZ)、阿米卡星(AK)、左氧氟沙星(LEV)、MEM、舒巴坦、FOS、阿维巴坦、ATM、头孢哌酮均为标准品,购自合肥诺卓生物公司。96孔无菌培养板购自五中区郭巷华瑞聚合网店。碳青霉烯酶检测试剂盒(NG-Test® CARBA 5),批号W20040311,购自长沙中生众捷生物技术有限公司。
1.3 碳青霉烯酶检测(胶体金免疫层析法)将样本与提取缓冲液在EP管中均匀混合,放置10 min,加入该混合液到检测卡样本孔中,室温放置15 min后读取结果。
1.4 微量肉汤稀释法测定最低抑菌浓度(MIC)将系列稀释的抗菌药物中加入一定浊度肉汤稀释的细菌共同孵育16~24 h,96孔平皿无菌生长孔中最低药物浓度为该菌MIC。试验操作及药敏结果判定参照美国临床和实验室标准协会(CLSI)2020年M100s-30th的标准,头孢哌酮/舒巴坦(SCF)参照CLSI中头孢哌酮折点。FOS微量肉汤稀释法在CLSI中无折点,本文仅就联合药敏试验前后MIC变化判断联合效果。
1.5 棋盘稀释法采用微量肉汤稀释法测定38株CRE的MIC,药敏试验质控菌株为大肠埃希菌ATCC 25922。IPM、MEM、CAZ、ATM、AK、LEV浓度范围为0.25~128 μg/mL, FOS为0.5~256 μg/mL,SCF(头孢哌酮与舒巴坦配比2∶1)浓度范围(0.25/0.125~128/64) μg/mL, CZA(阿维巴坦浓度固定4 μg/mL)浓度范围(128/4~0.06/4) μg/mL。每孔分别加入联合用药的抗菌药物共100 μL,及浓度为106 CFU/mL的菌悬液100 μL(新鲜菌落制备0.5麦氏单位的接种菌液,再用2倍MH肉汤稀释102倍),微孔板最终接种浓度为5×105 CFU/mL。35℃培养16~20 h,读取结果并记录单药和两药联合时MIC值,具体棋盘稀释法操作步骤参考文献[5]。
部分抑菌浓度(fractional inhibitory concentration,FIC)指数作为联合药敏试验结果的判断依据(FIC=MIC甲药联合/MIC甲药单药+MIC乙药联合/MIC乙药单药),FIC≤0.5为协同作用,0.5<FIC≤1为相加作用,1<FIC≤2为无关作用,FIC>2为拮抗作用[5-6]。MIC甲药联合和MIC乙药单药的MIC折点参照甲与乙药单药MIC的CLSI 2020年M100s-30th的判断标准读取结果。FOS的微量肉汤稀释法在CLSI中无折点, 联合后MIC读取同单药MIC读取,仅就联合药敏试验前后MIC变化判断联合效果。
1.6 耐药菌株等定义CRE定义为IPM、MEM等任一碳青霉烯类抗生素耐药[7]。“11种联合方案”即CZA联合ATM,IPM、MEM分别联合CAZ、SCF、AK、LEV、FOS共11种联合药敏试验方案。
2 结果 2.1 抗菌药物对各CRE菌株的MIC结果微量肉汤稀释法对选取的38株菌进行联合药敏试验,CZA对产KPC酶菌株的MIC值均≤4 μg/mL, 为敏感,但对产B类金属酶NDM、IMP菌株的MIC值均>128 μg/mL, 为耐药;IPM的MIC值均≥4 μg/mL,MEM的MIC值均≥8 μg/mL,SCF的MIC值均≥64 μg/mL,CAZ的MIC值均≥32 μg/mL,为耐药;LEV对34株菌的MIC值≥2 μg/mL, 为耐药;ATM对3株菌MIC值≤4 μg/mL,为敏感,对35株菌的MIC值≥64 μg/mL,为耐药;AK对26株的MIC≤16 μg/mL,为敏感,对12株的MIC≥128 μg/mL,为耐药;FOS只有1株MIC为16 μg/mL,其余37株均≥256 μg/mL。见表 1。
| 表 1 38株CRE对不同抗菌药物的MIC值 Table 1 MIC values of different antimicrobial agents against 38 CRE strains |
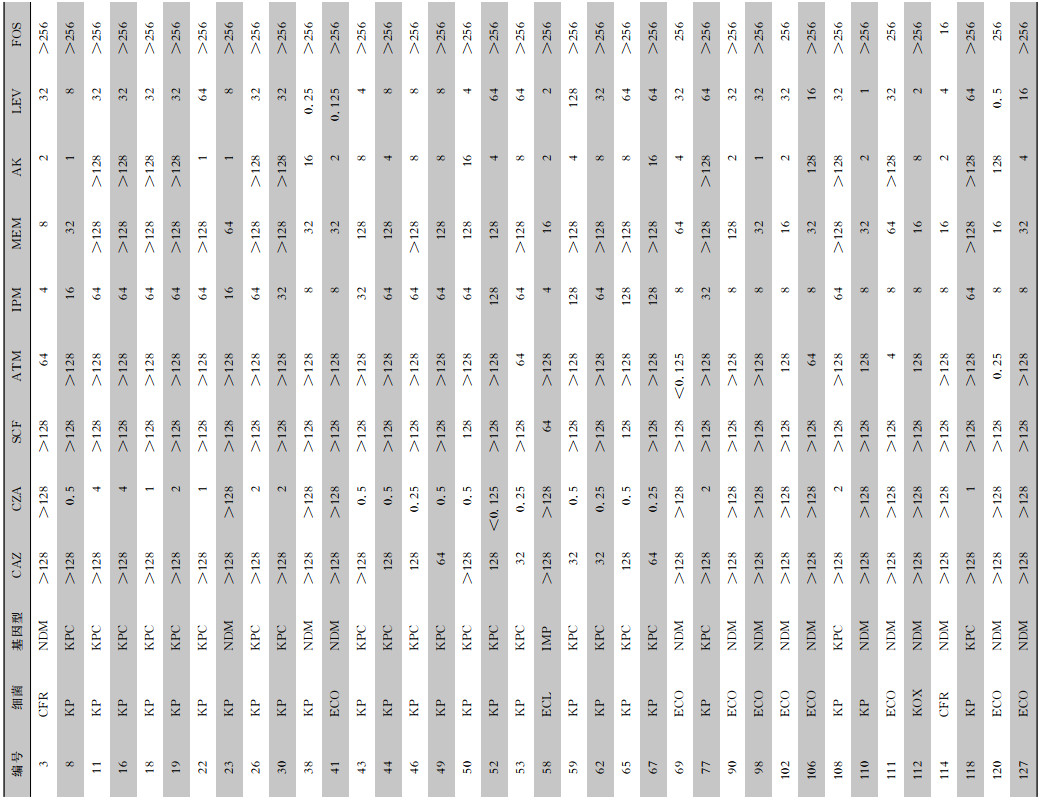
|
联合药敏试验的每种方案所选取的2种药物在独立药敏试验中均判断为耐药(除FOS)。联合药敏试验结果显示,11种联合方案均无拮抗作用。CZA联合ATM协同率为100%,IPM、MEM联合SCF协同率分别为63.2%、68.4%, 协同率与相加率之和为100%,MEM联合FOS的协同与相加率之和为56.8%, IPM联合FOS的协同率与相加率之和最低,为40.5%。其余联合试验结果见表 2。
| 表 2 11种联合方案对38株CRE菌株协同、相加、无关、拮抗作用情况 Table 2 Synergic, addition, irrelevant and antagonistic effects of 11 combined regimens on 38 CRE strains |
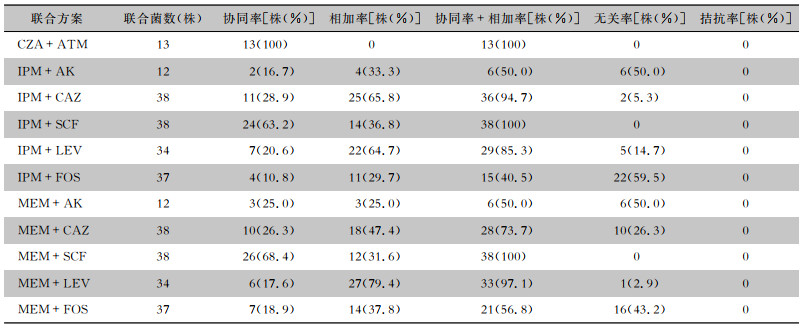
|
CZA联合ATM在ECO和KP中协同率为100%。在KP中, IPM与MEM联合SCF协同率均为68%,协同率与相加率之和均为100%, MEM联合FOS的协同与相加率之和为40%, IPM联合FOS的协同率与相加率之和最低,为24%。在ECO中,IPM与MEM联合SCF协同率分别为44.4%、77.8%,协同率与相加率之和为100%, MEM联合FOS的协同率与相加率之和为88.9%, IPM联合FOS的协同率与相加率之和最低,为66.7%。其余详见表 3。
| 表 3 11种联合方案在KP与ECO中协同、相加、无关、拮抗作用情况 Table 3 Synergic, addition, irrelevant and antagonistic effects of 11 combined regimens on KP and ECO |
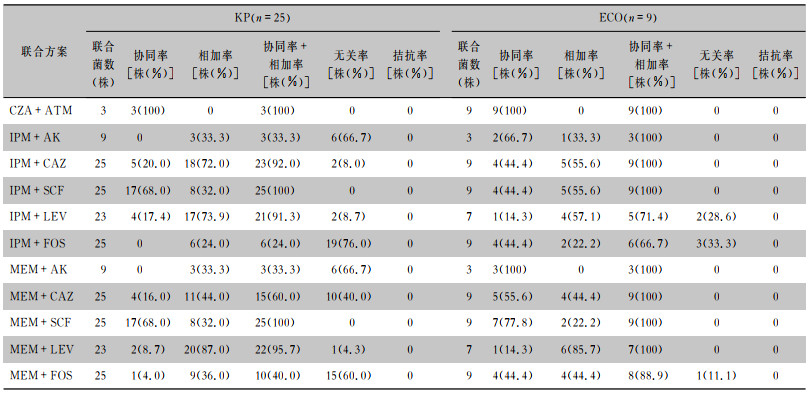
|
CZA联合ATM在产B类金属酶NDM、IMP菌株中协同率均为100%;基因型KPC菌株中,IPM、MEM联合SCF协同率均60%以上,分别为72.7%、63.6%,协同率与相加率之和均为100%, MEM联合FOS的协同率与相加率之和为31.8%,IPM联合FOS的协同率与相加率之和最低,为22.7%;基因型NDM菌株中,IPM与MEM联合SCF协同率40%以上,分别为46.7%、80.0%,协同率与相加率之和为100%, MEM联合FOS的协同率与相加率之和为92.9%,IPM联合FOS的协同率与相加率之和最低,为64.3%。其余详见表 4。
| 表 4 11种联合方案在不同基因型菌株中的协同、相加、无关、拮抗作用情况 Table 4 Synergic, addition, irrelevant and antagonistic effects of 11 combined regimens on strains with different genotypes |
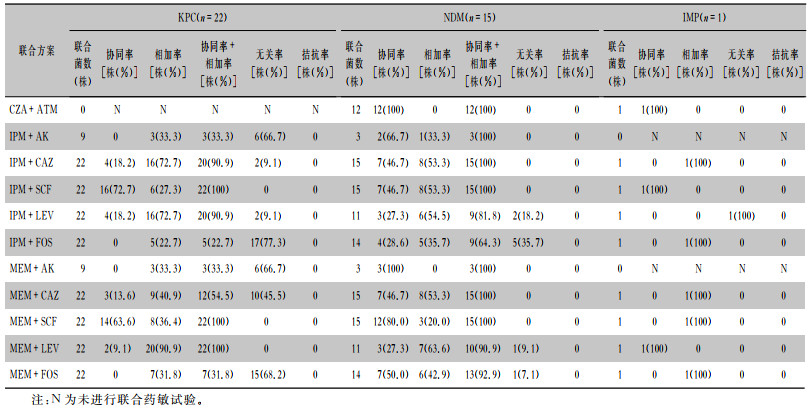
|
随着抗菌药物的广泛应用,细菌耐药形势十分严峻。据2014—2019年全国细菌耐药检测网(CARSS)[8]报道,CRE检出率逐年升高。在CRE耐药性增高甚至出现全耐药的背景下,联合用药治疗是潜在的解决方法。联合药敏试验目前没有统一定论与标准,使用最多的是替加环素与多粘菌素同时或分别与其他抗菌药物联合[9-12],更多药的联合药敏试验研究可为临床提供更广泛的选择。
研究显示,CZA联合ATM的药敏试验协同作用为97.5%;IPM与CAZ的联合药敏试验对20%菌株有协同作用;IPM和FOS联合用药治疗4周,临床改善;IPM和MEM分别与FOS联合药敏试验协同作用率为42%、33%;MEM联合SCF用药可改善新生儿多药耐药肺炎的免疫功能[3, 5, 13-15]。另有研究[16]证实MEM和AK联合用药治疗耐碳青霉烯肺炎克雷伯菌小鼠肺炎模型的体内疗效有效。尽管组合治疗疗效可期,但选择理想的抗菌药物组合方案耗时,每种潜在联合方案的有效性取决于菌株的反应,使得确定最佳抗菌药物联合方案变得困难。
本研究对CZA联合ATM,及IPM、MEM分别与其他常用抗菌药物的联合进行药敏试验,未发现有拮抗作用。CZA对产KPC菌株敏感,但对产B类金属酶NDM、IMP菌株耐药,联合ATM后,具有很好的协同作用,与文献[13, 17]报道一致。在基因型KPC菌株和KP中,IPM、MEM联合SCF协同率均60%以上,协同率与相加率之和为100%;在NDM菌株和ECO中,IPM、MEM联合SCF协同率均40%以上,协同率与相加率之和均为100%,MEM+SCF协同率均高于IPM+SCF。研究[18-20]显示,碳青霉烯类抗生素联合FOS对铜绿假单胞菌具有协同杀菌作用,但对CRE菌株的联合药敏情况未知。本研究中,IPM+FOS对KPC与NDM菌株的协同率与相加率之和分别为22.7%、64.3%,MEM+FOS在KPC、NDM菌株中协同率与相加率之和分别为31.8%、92.9%。在联合治疗效果不佳、病情较重、或经济条件允许的情况下,可以推荐提前使用CZA治疗KPC型CRE菌株感染,CZA联合ATM治疗B类金属酶型CRE感染。
本试验选取了KPC、NDM、IMP三种基因型菌株进行联合药敏试验,均收到很好的联合作用效果。IPM、MEM分别与各抗菌药物的联合药敏试验在不同酶型中作用结果稍有差异,NDM菌株的IPM+LEV和MEM+LEV协同率与相加率之和低于KPC菌株,IPM+SCF和MEM+SCF协同率与相加率之和与KPC菌株相同,其余联合方案协同率与相加率之和均高于KPC菌株。KP与ECO联合药敏试验结果比较,KP中的IPM+LEV协同率与相加率之和高于ECO,CZA+ATM、IPM+SCF和MEM+SCF协同率与相加率之和与ECO相同,其余联合方案协同率与相加率之和均低于ECO。
此外,不同菌株的两药最佳MIC配比不尽相同。配比发现,联合药敏试验的MIC从低到高,可能联合无效。临床需依据具体的联合药敏试验,也需考虑患者的身体状况、细菌MIC值、感染部位等,在具体两药MIC配比试验基础上,根据患者综合情况选择适合的配比。例如患者有出血倾向,而SCF可引起凝血功能障碍和出血[21],碳青霉烯类与SCF联合时,应选前者剂量大后者剂量小的最佳配比,并实时监测凝血功能。
本试验中收集的产金属酶型NDM、IMP菌株相对少,特别是IMP菌株仅1株,由于IMP菌株数量有限,结果未具体分析。另外CRE菌株除KP外其他种类的细菌数量较少。本文主要做了碳青霉烯类抗生素IPM、MEM分别与其他5种抗菌药物的联合药敏试验,厄他培南和多立培南分别与其他抗菌药物联合药敏试验暂时未做,待后续有更多酶型和不同类型细菌后再补充研究。
综上所述,本试验选取了NDM、KPC和IMP基因型菌株和不同种类细菌,比较11种联合方案对不同基因型和菌株类型的效果,证实了不是所有联合方案都有效,同一菌株不同联合方案效果不同,同一联合方案对不同菌株效果也不同,两药间的剂量配比也很重要,提示临床治疗时最好依据具体的联合药敏试验结果选择和联合抗菌药物。但该方法试验操作繁琐,费时费力,一般实验室难以常规开展进行。目前临床大多采用定性的纸片或E-test条进行联合药敏试验[22],且无判断标准,只能大致观察是否有联合作用。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Hu FP, Guo Y, Yang Y, et al. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2275-2281. DOI:10.1007/s10096-019-03673-1 |
| [2] |
宋晓蕾, 王明贵. 预测产碳青霉烯酶肺炎克雷伯菌所致血流感染病死率的有关因素: 联合治疗的重要性[J]. 中国感染与化疗杂志, 2014, 14(2): 141. Song XL, Wang MG. Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniae carbapenemase-producing K.pneumoniae: importance of combination therapy[J]. Chinese Journal of Infection and Chemotherapy, 2014, 14(2): 141. |
| [3] |
曹玲, 肖斌, 陈丽丹, 等. 碳青霉烯类药物联合用药治疗广泛耐药肺炎克雷伯菌的研究进展[J]. 中国感染控制杂志, 2017, 16(12): 1195-1200. Cao L, Xiao B, Chen LD, et al. Advances in combined use of carbapenem antibiotics for the treatment of extensively drug-resistant Klebsiella pneumoniae[J]. Chinese Journal of Infection Control, 2017, 16(12): 1195-1200. DOI:10.3969/j.issn.1671-9638.2017.12.021 |
| [4] |
Yasmin M, Fouts DE, Jacobs MR, et al. Monitoring ceftazidime-avibactam and aztreonam concentrations in the treatment of a bloodstream infection caused by a multidrug-resistant Enterobacter sp. carrying both Klebsiella pneumoniae carbapenemase-4 and New Delhi metallo-β-lactamase-1[J]. Clin Infect Dis, 2020, 71(4): 1095-1098. DOI:10.1093/cid/ciz1155 |
| [5] |
郝敏, 秦晓华. 亚胺培南联合8种抗菌药物对产KPC-2酶肺炎克雷伯菌的体外联合药敏试验[J]. 中国感染与化疗杂志, 2019, 19(4): 410-416. Hao M, Qin XH. In vitro antibacterial activity of imipenem combined with another antimicrobial agent against KPC-2-producing Klebsiella pneumoniae[J]. Chinese Journal of Infection and Chemotherapy, 2019, 19(4): 410-416. DOI:10.16718/j.1009-7708.2019.04.014 |
| [6] |
Zhang WX, Guo Y, Li JY, et al. In vitro and in vivo bactericidal activity of ceftazidime-avibactam against carbapenemase-producing Klebsiella pneumoniae[J]. Antimicrob Resist Infect Control, 2018, 7: 142. DOI:10.1186/s13756-018-0435-9 |
| [7] |
胡付品, 郭燕, 朱德妹, 等. 2018年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2020, 20(1): 1-10. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance in China: 2018 report[J]. Chinese Journal of Infection and Chemotherapy, 2020, 20(1): 1-10. |
| [8] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-30. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 15-30. |
| [9] |
左同坤, 汤庆, 惠亮亮, 等. 替加环素联合头孢哌酮舒巴坦治疗多重耐药菌致重症肺炎的效果[J]. 中国当代医药, 2021, 28(3): 80-82, 94. Zuo TK, Tang Q, Hui LL, et al. Effect of tigecycline combined with cefoperazone sulbactam in the treatment of severe pneumonia caused by multi-drug resistant bacteria[J]. China Modern Medicine, 2021, 28(3): 80-82, 94. DOI:10.3969/j.issn.1674-4721.2021.03.024 |
| [10] |
李燕菊, 汪海涛, 马新萍, 等. 多粘菌素B联合头孢哌酮钠舒巴坦钠和替加环素治疗多重耐药鲍曼不动杆菌肺炎的疗效观察[J]. 药物评价研究, 2021, 44(2): 376-380. Li YJ, Wang HT, Ma XP, et al. Efficacy of polymyxin B combined with cefoperazone sodium and sulbactam sodium and tigecycline in treatment of multidrug-resistant Acinetobacter baumannii pneumonia[J]. Drug Evaluation Research, 2021, 44(2): 376-380. |
| [11] |
崔跃. 不同剂量头孢哌酮舒巴坦钠联合替加环素对肺部多重耐药菌感染患者凝血功能的影响[J]. 中国现代医药杂志, 2021, 23(2): 57-59. Cui Y. Effects of different doses of cefoperazone sulbactam sodium combined with tigecycline on coagulation function in patients with pulmonary multidrug-resistant bacteria infection[J]. Modern Medicine Journal of China, 2021, 23(2): 57-59. |
| [12] |
胡帮芹, 杨忆, 赵洪琼, 等. 替加环素与多黏菌素单药或联合治疗碳青霉烯类耐药肺炎克雷伯菌血流感染有效性的Meta分析[J]. 临床药物治疗杂志, 2019, 17(2): 39-45. Hu BQ, Yang Y, Zhao HQ, et al. Efficacy of combination therapy for the treatment of carbapenem-resistant Klebsiella pneumoniae bloodstream infections: a systematic review and Meta-analysis[J]. Clinical Medication Journal, 2019, 17(2): 39-45. |
| [13] |
Maraki S, Mavromanolaki VE, Moraitis P, et al. Ceftazidime-avibactam, meropenen-vaborbactam, and imipenem-relebactam in combination with aztreonam against multidrug-resis-tant, metallo-β-lactamase-producing Klebsiella pneumoniae[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(8): 1755-1759. |
| [14] |
Nakamura I, Yamaguchi T, Aoki K, et al. Imipenem plus fosfomycin as salvage therapy for vertebral osteomyelitis[J]. Antimicrob Agents Chemother, 2020, 65(1): e01746-20. |
| [15] |
Lin MJ, Zhu SX, Weng HM, et al. Effect of cefoperazone sulbactam sodium combined with meropenem on the immune function in the treatment of neonatal pneumonia caused by multidrug-resistant bacteria[J]. Am J Transl Res, 2021, 13(6): 6342-6351. |
| [16] |
Ota K, Kaku N, Yanagihara K. Efficacy of meropenem and amikacin combination therapy against carbapenemase-producing Klebsiella pneumoniae mouse model of pneumonia[J]. J Infect Chemother, 2020, 26(12): 1237-1243. |
| [17] |
Cairns KA, Hall V, Martin GE, et al. Treatment of invasive IMP-4 Enterobacter cloacae infection in transplant recipients using ceftazidime/avibactam with aztreonam: a case series and literature review[J]. Transpl Infect Dis, 2021, 23(2): e13510. |
| [18] |
刘云宁, 李小凤, 汤建华, 等. 磷霉素与其他抗菌药物对多重耐药铜绿假单胞菌的联合药敏试验研究[J]. 中国感染控制杂志, 2021, 20(12): 1149-1152. Liu YN, Li XF, Tang JH, et al. Combination antimicrobial susceptibility testing of fosfomycin and other antimicrobial agents against multidrug-resistant Pseudomonas aeruginosa[J]. Chinese Journal of Infection Control, 2021, 20(12): 1149-1152. |
| [19] |
Albiero J, Mazucheli J, Barros JPDR, et al. Pharmacodynamic attainment of the synergism of meropenem and fosfomycin combination against Pseudomonas aeruginosa producing meta-llo-β-lactamase[J]. Antimicrob Agents Chemother, 2019, 63(6): e00126-19. |
| [20] |
Drusano GL, Neely MN, Yamada WM, et al. The combination of fosfomycin plus meropenem is synergistic for Pseudomonas aeruginosa PAO1 in a hollow-fiber infection model[J]. Antimicrob Agents Chemother, 2018, 62(12): e01682-18. |
| [21] |
Wang W, Liu YM, Yu C, et al. Cefoperazone-sulbactam and risk of coagulation disorders or bleeding: a retrospective cohort study[J]. Expert Opin Drug Saf, 2020, 19(3): 339-347. |
| [22] |
郎磊, 李娜, 陈露, 等. 替加环素联合5种抗菌药物对耐碳青霉烯的肺炎克雷伯菌体外抗菌作用的研究[J]. 天津医科大学学报, 2020, 26(3): 276-279. Lang L, Li N, Chen L, et al. In vitro antibacterial activity study of tigecycline combined with 5 antibacterial agents against CRKP[J]. Journal of Tianjin Medical University, 2020, 26(3): 276-279. |



