2. 南通大学附属医院微生物实验室, 江苏 南通 226001;
3. 南通市疾病预防控制中心, 江苏 南通 226001
2. Microbiology Laboratory, Affiliated Hospital of Nantong University, Nangtong 226001, China;
3. Nantong Center for Disease Control and Prevention, Nantong 226001, China
近年来,耐碳青霉烯类肺炎克雷伯菌(carbape-nem-resistant Klebsiella pneumoniae,CRKP)、多重耐药鲍曼不动杆菌(multidrug-resistant Acinetobacter baumannii,MDR-AB)及耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)等多重耐药菌(multidrug-resistant organism,MDRO)的检出率不断升高,在全球多个国家出现散发和(或)流行[1-4]。MDRO成为人类健康的巨大威胁,给公共卫生带来了重大挑战。重症监护病房(intensive care unit,ICU)是医院危重症患者实施特殊治疗和监护的场所,患者普遍存在合并多种基础疾病、感染程度较重、免疫功能低下,同时接受有创检查和治疗操作较多,患者感染的风险高于其他普通科室。研究表明,MDRO是ICU主要的感染菌;医务工作者的各种不规范行为均可能导致MDRO在医疗机构环境中定植或传播[5-7];环境中MDRO定植情况可作为评价消毒过程效率的指标[6]。脉冲场凝胶电泳(plused-field gel electrophoresis,PFGE)是判断微生物是否同一来源的“金标准”[8]。但目前的研究多为患者周围环境和医疗器械的研究,医务人员工作生活区域MDRO污染情况未引起关注。本研究采用PFGE对某院ICU患者和病区(包括生活区区域)环境中分离的MDRO进行同源性分析,了解MDRO医院内传播的可能路径,以及与医院感染之间的关系,为进一步加强MDRO医院感染防控提供依据,现将结果报告如下。
1 对象与方法 1.1 菌株来源收集2021年11月17日—12月17日江苏省某三级甲等综合医院ICU患者及环境标本分离的22株MDRO,其中CRKP 6株,MDR-AB 11株,MRSA 5株。患者来源菌株均为患者入院后同类标本首次分离获得。环境标本检出菌株参照临床标本相应病原菌进行菌株鉴定及药敏试验。质控菌株大肠埃希菌ATCC 25922和标准菌株沙门菌H9812,均由江苏省疾病预防控制中心提供。
1.2 试验试剂 1.2.1 PFGE试验试剂Seakem Gold Agarose购自Lonza公司,EDTA、TBE及Tris-Hcl均购自北京索莱宝科技有限公司,Gel Red购自Bio-Rad公司,蛋白酶K、Sma I酶切系统、Xba I酶切系统以及Apa I酶切系统均购自TaKaRa公司。
1.2.2 菌株鉴定及药敏试验试剂菌株鉴定卡片及药物敏感性试验卡片购自生物梅里埃公司,药物敏感性纸片购自英国Oxoid公司。所有菌株经VITEK 2全自动微生物鉴定药敏分析系统鉴定。
1.3 试验仪器电泳仪为购自Bio-Rad公司的CHEF MapperTM脉冲场电泳系统,电泳成像使用Bio-Rad公司Molercular Imager○R Gel DocTM XR+及Image LabTM成像软件,采用Applied Maths NV公司Bionumerics软件对电泳图像进行分析,VITEK 2全自动微生物鉴定及药敏分析系统购自法国生物梅里埃公司。
1.4 判断标准 1.4.1 药敏试验参照美国临床实验室标准化协会(CLSI)2021版进行判断,结果分别以敏感(S)、中介(I)、耐药(R)表示。
1.4.2 MDRO依据《MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议》对MDRO进行判断[9]。
1.4.3 菌株同源性参考美国疾病预防控制中心(CDC)推荐的标准化PulseNet分子分型方法,用Xba I酶切H9812产生的片段作为分子质量标准。依据文献[10]对PFGE结果进行判断,菌株之间DNA条带数及相应条带大小相同认为相同,存在1~3个条带差异的认为紧密相关,出现4~6个条带差异认为可能相关,7个以上条带差异菌株认为不相关;对PFGE图谱进行聚类分析,电泳条带相似系数用Dice系数表示,相似系数>80%的菌株认为存在同源性,>90%认为高度同源,100%认为完全同源。
1.4.4 医院感染参照《医院感染诊断标准(试行)》(2001版)进行医院感染判断。
1.5 PFGE试验按照PulseNet Intenational标准操作程序操作,肺炎克雷伯菌采用Xba I酶,鲍曼不动杆菌采用Apa I酶,金黄色葡萄球菌采用Sma I酶。电泳系统为0.5×TBE,电场角度为120°,电压为6.0 V/cm;起始、终止转换时间:肺炎克雷伯菌分别为6、36 s, 鲍曼不动杆菌分别为5、20 s, 金黄色葡萄球菌分别为4、40 s; 肺炎克雷伯菌和金黄色葡萄球菌电泳时间为19 h, 鲍曼不动杆菌电泳时间为18 h 45 min。电泳结束后,立即使用3×Gel Red染液染色30 min。Bio-Rad成像系统拍照后,用BioNumerics软件对电泳图谱进行聚类分析。
2 结果 2.1 病原学检测结果共分离MDRO 22株,包括CRKP 6株,MDR-AB 11株,MRSA 5株。其中同期住院患者分离MDRO 11株(CRKP 4株,MDR-AB 5株,MRSA 2株),主要来源于呼吸道、腹腔、血标本,见表 1。共采集ICU环境、工作人员手、诊疗用品标本44份,分离MDRO 11株(CRKP 2株,MDR-AB 6株,MRSA 3株),见表 2。
| 表 1 ICU患者常见MDRO检出情况 Table 1 Detection of common MDROs in ICU patients |
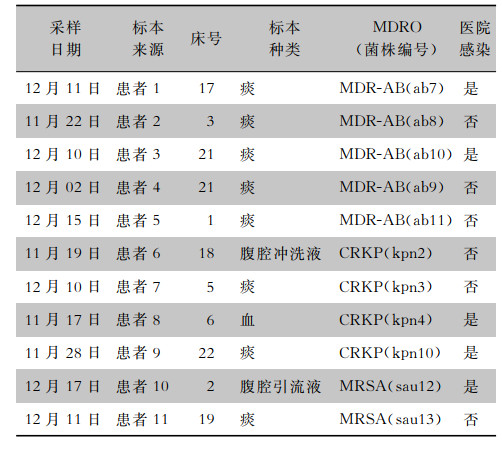
|
| 表 2 ICU病区环境标本常见MDRO检出情况 Table 2 Detection of common MDROs in ICU environmental specimens |
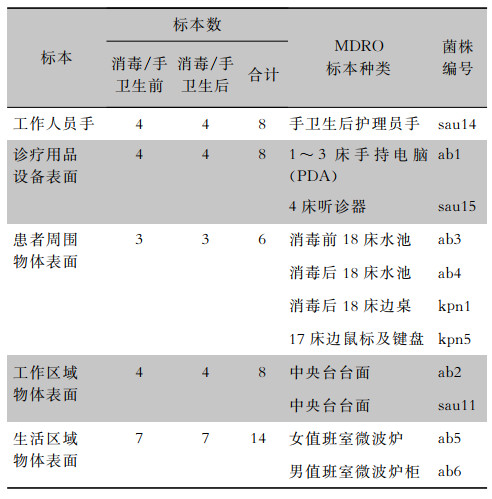
|
6株CRKP对常用抗菌药物的药敏试验结果完全一致,除对头孢他啶/阿维巴坦敏感外,对其他常用抗菌药物体外试验均耐药。
2.2.2 MDR-AB药敏试验结果11株MDR-AB,3株对米诺环素耐药;环境株对头霉素类均耐药,对复方磺胺甲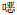
| 表 3 11株MDR-AB药敏试验结果 Table 3 Antimicrobial susceptibility test results of 11 MDR-AB strains |
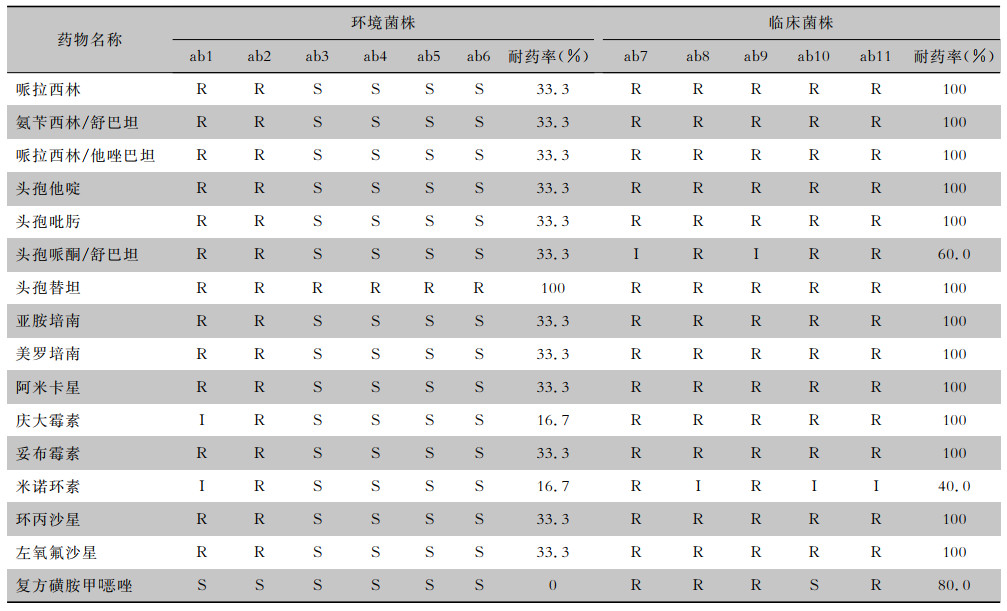
|
5株MRSA,其中2株为临床株(sau12、sau13号株)。MRSA菌株对红霉素及氟喹诺酮类药物(环丙沙星、左氧氟沙星、莫西沙星等)耐药率为60.0%,对四环素耐药率为40.0%。见表 4。
| 表 4 5株MRSA药敏试验结果 Table 4 Antimicrobial susceptibility test results of 5 MRSA strains |
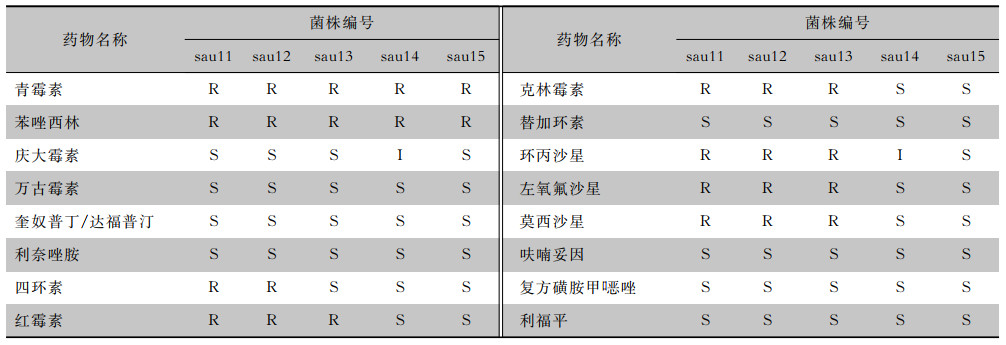
|
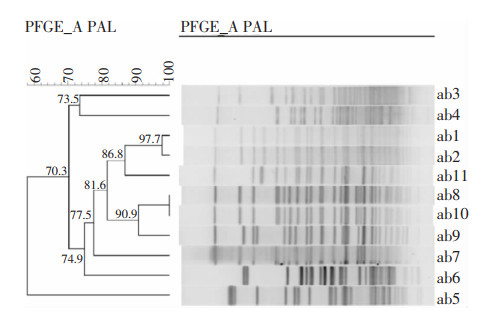
对CRKP菌株电泳条带进行聚类分析显示,6株CRKP相似系数为92.5%,高度同源,属于同一分型。其中,环境株标本kpn1(18床旁桌)与标本kpn5(17床边键盘及鼠标)完全同源,相似系数达100%,17床及18床分布于ICU同一房间,所在房间为双人间;临床株标本kpn4(患者8)与标本kpn10(患者9)分离的CRKP完全同源。PFGE同源性分析结果见图 1。4株临床株中2株为患者携带定植菌株(患者6、患者7),2株为患者医院内获得感染菌株(患者8、患者9);患者8最先(11月17日)分离出CRKP,接着依次为患者6(11月19日)、患者9(11月28日)、患者7(12月10日);患者8和患者6在住院期间曾多次更换床位,床位变更时间分布见图 2。患者6为肠破裂继发腹腔感染患者,其与患者9在ICU住院期间时间和空间分布上存在交叉。
 |
| 图 1 CRKP PFGE分型结果 Figure 1 PFGE typing results of CRKP |
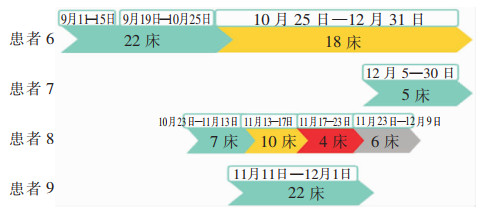 |
| 图 2 4株CRKP临床分离株对应患者床位分布情况 Figure 2 Distribution of patients' beds of the 4 correspon-ding CRKP clinical strains |
11株MDR-AB中7株相似系数>80%,存在同源性关系。2株(ab1:1~3床共用PDA;ab2:护士站中央台工作电脑覆盖区域表面)为环境株,相似系数高达97.7%;5株为临床株,其中ab8(患者2)、ab10(患者3)相似度100%,完全同源。见图 3。ab7(患者1)以及ab10(患者3)为患者医院内获得感染病原菌,ab8(患者2)、ab9(患者4)及ab11(患者5)为患者携带或定植病原菌。5例患者ICU内床位变化分布情况见图 4,患者4分别与患者1、患者3在住院时间和空间分布上存在交叉。
 |
| 图 3 MDR-AB PFGE分型结果 Figure 3 PFGE typing results of MDR-AB |
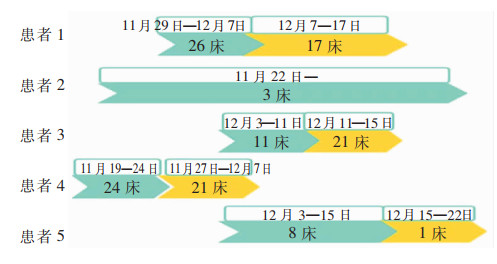 |
| 图 4 5株MDR-AB临床分离株对应患者床位分布情况 Figure 4 Distribution of patients' beds of the 5 correspon-ding MDR-AB clinical strains |
ICU检出MRSA共5株,其中sau14(ICU护理员洗手后手)及sau15(4床听诊器)聚类分析相似系数为100%,完全同源;菌株sau11(ICU护士站中央台工作电脑覆盖区域物体表面)与菌株sau12(患者10分离株)高度同源(相似系数:93.8%),见图 5。
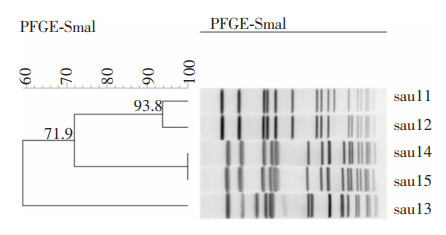 |
| 图 5 MRSA PFGE分型结果 Figure 5 PFGE typing result of MRSA |
金黄色葡萄球菌、肺炎克雷伯菌和鲍曼不动杆菌广泛分布在医院环境内,是引起医院感染的主要病原菌,更是ICU患者感染的重要机会致病菌。由于ICU主要接收急重症患者,多数患者涉及转院、转科、接受侵入性治疗等情况,该病区是医院感染的高发区域,也是MDRO主要流行的区域,CRKP、MRSA、MDR-AB检出率远高于门急诊和住院其他病区[11]。本研究显示, ICU患者及环境分离的CRKP、患者分离MDR-AB耐药率高于全国平均水平[11],环境株耐药率相对低于临床分离株,与宛传丹等[12]报道一致,与细菌耐药诱导机制、广谱抗菌药物的大量使用密切相关。在大量广谱抗菌药物的选择性压力下,来源于环境的同源性菌株可在感染患者过程中发生耐药机制传导,从而导致临床标本中细菌的耐药率普遍呈升高趋势[13]。
本研究结果显示,ICU患者周围环境及设备表面,工作人员频繁接触的中央台、电脑键盘、鼠标,甚至工作人员生活区域的物体表面、微波炉按键和开关等均不同程度检出与患者感染相关的MDRO,在患者床旁桌和水池消毒处理前后均分别检出CRKP、MDR-AB,且PFGE显示部分环境分离株与临床分离株高度同源,表明受污染的医疗环境可能是造成耐药菌在医院内传播的重要模式。无生命的高频接触物体表面的病原菌污染,大多由于工作人员执行接触行为后的手卫生执行不规范导致[14]。该病区护理员手卫生后手部检出MRSA与4床听诊器表面检出MRSA完全同源,提示护工所使用的手卫生设施遭到污染或手卫生后采样前接触被MRSA污染的患者周围环境或诊疗用品等可能。文献[15-17]报道,工作人员手是病原菌医院传播的重要媒介。本研究也进一步证实受污染的物体表面以及医务人员的手等是造成MDRO医院感染的重要因素,因此,加强病区环境清洁消毒措施的落实,提高医务人员手卫生意识和手卫生执行依从性,能有效切断病原菌医院内传播途径,减少医院感染的发生。
多项研究[18-20]报道,在医院环境表面检出与患者同源的MDRO,但环境标本局限于病房家具和医疗器械,未对医务人员值班室等生活区域MDRO污染情况进行调查研究。本研究环境物体表面采样覆盖面广,对工作人员操作后、手卫生前及手卫生后手部,消毒前及消毒湿巾规范消毒处理后物体表面分别进行采样,直观评价该病区消毒隔离和手卫生措施落实效果。同源性分析结果显示, 部分环境分离株与临床分离株高度同源,提示该病区存在患者感染病原菌污染患者周围环境并可能导致医院感染。但本研究标本量不多,环境采样时间点单一,研究结果仅能说明该病区短期内的情况,有一定的局限性,后续将开展大样本量、多时间点覆盖的持续性研究,以及针对具体诊疗设备与感染部位(如呼吸机与呼吸机相关肺炎)、物体表面及不同工作人员,以及相应措施及其落实效果评价的探讨性研究,为临床感染与环境的关系提供有力证据。
综上所述,该院ICU患者周围环境、工作人员工作和生活区域高频接触表面均不同程度被MDRO污染。部分环境株与临床株同源,存在MDRO传播以及导致新发医院感染的风险。重视MDRO和环境微生物监测,对分离菌株及时进行同源性分析,对临床了解医院感染流行/暴发的来源及传播模式具有现实指导意义。同时,进一步规范抗菌药物合理使用, 加强环境表面的清洁消毒措施的落实及其效果评价, 强化工作人员尤其是护理员的手卫生培训,提高手卫生依从性, 能有效减少医院感染的发生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Satlin MJ, Chen L, Patel G, et al. Multicenter clinical and molecular epidemiological analysis of bacteremia due to carbapenem-resistant Enterobacteriaceae (CRE) in the CRE epicenter of the United States[J]. Antimicrob Agents Chemo-ther, 2017, 61(4): e02349-16. DOI:10.1128/AAC.02349-16 |
| [2] |
Tadese BK, Nutt A, Chaudhary I, et al. Regional outbreak of multidrug-resistant Klebsiella pneumoniae carbapenemase-producing Pseudomonas Aeruginosa[J]. Infect Control Hosp Epidemiol, 2023, 44(1): 96-98. DOI:10.1017/ice.2021.394 |
| [3] |
Gu DX, Dong N, Zheng ZW, et al. A fatal outbreak of ST11 carbapenem-resistant hypervirulent Klebsiella pneumoniae in a Chinese hospital: a molecular epidemiological study[J]. Lancet Infect Dis, 2018, 18(1): 37-46. DOI:10.1016/S1473-3099(17)30489-9 |
| [4] |
Baier C, Ebadi E, Mett TR, et al. Epidemiologic and molecular investigation of a MRSA outbreak caused by a contaminated bathtub for carbon dioxide hydrotherapy and review of the lite-rature[J]. Can J Infect Dis Med Microbiol, 2020, 2020: 1613903. |
| [5] |
Gontjes KJ, Gibson KE, Lansing B, et al. Contamination of common area and rehabilitation gym environment with multidrug-resistant organisms[J]. J Am Geriatr Soc, 2020, 68(3): 478-485. DOI:10.1111/jgs.16284 |
| [6] |
Lin JL, Lin DX, Xu P, et al. Non-hospital environment contamination with Staphylococcus aureus and methicillin-resis-tant Staphylococcus aureus: proportion Meta-analysis and features of antibiotic resistance and molecular genetics[J]. Environ Res, 2016, 150: 528-540. DOI:10.1016/j.envres.2016.06.040 |
| [7] |
Mody L, Washer LL, Kaye KS, et al. Multidrug-resistant organisms in hospitals: what is on patient hands and in their rooms?[J]. Clin Infect Dis, 2019, 69(11): 1837-1844. DOI:10.1093/cid/ciz092 |
| [8] |
Krawczyk B, Kur J, Stojowska-Swędrzyńska K, et al. Principles and applications of ligation mediated PCR methods for DNA-based typing of microbial organisms[J]. Acta Biochim Pol, 2016, 63(1): 39-52. |
| [9] |
李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64. Li CH, Wu AH. Interim standard definition of MDR, XDR and PDR multidrug-resistant bacteria-recommendations of international experts[J]. Chinese Journal of Infection Control, 2014, 13(1): 62-64. DOI:10.3969/j.issn.1671-9638.2014.01.018 |
| [10] |
Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233-2239. DOI:10.1128/jcm.33.9.2233-2239.1995 |
| [11] |
全国细菌耐药监测网. 2020年全国细菌耐药监测报告[J]. 中华检验医学杂志, 2022, 45(2): 122-136. China Antimicrobial Resistance Surveillance System. 2020 National antimicrobial resistance surveillance report[J]. Chinese Journal of Laboratory Medicine, 2022, 45(2): 122-136. |
| [12] |
宛传丹, 周金保, 邹学军, 等. ICU环境细菌学监测结果与医院感染病原菌耐药谱同源性分析[J]. 现代预防医学, 2016, 43(17): 3235-3240. Wan CD, Zhou JB, Zou XJ, et al. Analysis on the homology of environmental bacteriological monitoring results and drug resistance spectrum of pathogenic bacteria in ICU[J]. Modern Preventive Medicine, 2016, 43(17): 3235-3240. |
| [13] |
鲍群丽, 汪宏良, 柯俊. 耐碳青霉烯类鲍曼不动杆菌临床分布及耐药谱动态观察[J]. 中国感染控制杂志, 2015, 14(5): 311-313, 316. Bao QL, Wang HL, Ke J. Distribution characteristics and dynamic observation of antimicrobial resistant spectrum of carbapenem-resistant Acinetobacter baumannii[J]. Chinese Journal of Infection Control, 2015, 14(5): 311-313, 316. DOI:10.3969/j.issn.1671-9638.2015.05.006 |
| [14] |
汪洋, 吴晓松, 黄立业, 等. 一起鲍氏不动杆菌医院感染暴发的调查[J]. 中华医院感染学杂志, 2017, 27(9): 1940-1943. Wang Y, Wu XS, Huang LY, et al. Investigation of an outbreak of nosocomial infection caused by Acinetobacter baumannii[J]. Chinese Journal of Nosocomiology, 2017, 27(9): 1940-1943. |
| [15] |
杨惠英, 余红, 刘银梅. 手卫生干预对降低重症监护室医院感染率的影响[J]. 中国感染控制杂志, 2014, 13(10): 612-615. Yang HY, Yu H, Liu YM. Hand hygiene intervention to reduce healthcare-associated infection rate in an intensive care unit[J]. Chinese Journal of Infection Control, 2014, 13(10): 612-615. DOI:10.3969/j.issn.1671-9638.2014.10.009 |
| [16] |
常文燕, 陈晓兵, 李烨, 等. 多重耐药菌感染患者陪护人员手部接触行为的调查研究[J]. 中国感染控制杂志, 2021, 20(12): 1088-1093. Chang WY, Chen XB, Li Y, et al. Hand contact behaviors among caregivers of patients with multidrug-resistant organism infection[J]. Chinese Journal of Infection Control, 2021, 20(12): 1088-1093. DOI:10.12138/j.issn.1671-9638.20211273 |
| [17] |
董明驹, 史莉, 杨富强, 等. 医务人员洗手依从性管理与医院感染[J]. 中华医院感染学杂志, 2011, 21(3): 508-509. Dong MJ, Shi L, Yang FQ, et al. Administration of hand-washing compliance of medical staff and nosocomial infections[J]. Chinese Journal of Nosocomiology, 2011, 21(3): 508-509. |
| [18] |
Ye D, Shan JL, Huang YB, et al. A gloves-associated outbreak of imipenem-resistant Acinetobacter baumannii in an intensive care unit in Guangdong, China[J]. BMC Infect Dis, 2015, 15: 179. DOI:10.1186/s12879-015-0917-9 |
| [19] |
杨峰, 吴毅凌, 杨丽华, 等. 住院患者与医院环境中耐甲氧西林金黄色葡萄球菌PFGE分子分型研究[J]. 老年医学与保健, 2018, 24(2): 167-170. Yang F, Wu YL, Yang LH, et al. PFGE analysis of methicillin-resistant Staphylococcus aureus isolated from inpatients and hospital environment[J]. Geriatrics & Health Care, 2018, 24(2): 167-170. |
| [20] |
Zeng LY, Yang CR, Zhang JS, et al. An outbreak of carbape-nem-resistant Klebsiella pneumoniae in an intensive care unit of a major teaching hospital in Chongqing, China[J]. Front Cell Infect Microbiol, 2021, 11: 656070. |



