2. 长沙市艾滋病研究所 长沙市第一医院, 湖南 长沙 410000
2. The Institute of HIV/AIDS, The First Hospital of Changsha, Changsha 410000, China
联合国艾滋病规划署(UNAIDS)官网数据显示,截至2021年,全球共存活3 840万人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染者,其中2 870万例正在接受抗病毒治疗(antiretroviral therapy, ART)[1]。ART可以抑制HIV复制,重建患者的免疫功能,延缓艾滋病(acquired immunodeficiency syndrome, AIDS)进程,显著降低HIV/AIDS相关疾病的发病率及病死率[2]。自2003年“四免一关怀”政策在我国逐渐实施以来,越来越多的1型HIV(HIV-1)感染者接受了正规检测与治疗,抗逆转录病毒治疗覆盖范围不断扩大,但在药物选择压力作用下,HIV的耐药突变(drug resistance mutations, DRMs)不断产生,造成一线ART效果下降,出现更多的治疗失败[3]。已发生耐药的HIV-1毒株可以在人群中传播,导致新确诊的HIV-1感染者在进行ART前就存在耐药毒株感染,即原发性耐药(primary drug resistance, PDR),又称为传播性耐药(transmitted drug resistance, TDR)。目前湖南省AIDS新发病例数逐年升高(2020年轻微下降除外),主要传播途径仍然为性传播,但该省的PDR情况仍未被评估及分析。因此,本文旨在调查湖南省2021—2022年新确诊的HIV-1感染者其原发耐药现况及亚型分布,为该地AIDS防控及ART提供参考依据。
1 对象与方法 1.1 研究对象2021年1月—2022年8月在长沙市第一医院HIV门诊新确诊并且未接受ART的HIV-1感染者。获得患者同意后,通过面对面交流收集其人口学及流行病学相关数据,采集血清,并保存于-80℃冰箱中。
1.2 实验室方法 1.2.1 HIV-1 RNA提取、扩增及产物测序取300 μL血浆,采用提取试剂盒QIAamp Viral RNA Isolation Kit(Qiagen, Hilden, Germany)提取病毒RNA。以此RNA为模板,将其反转录为cDNA,采用In-House的方法,进行2次聚合酶链式反应对产物进行扩增,并对产物进行提纯、鉴定。采用Sanger法进行DNA测序,测序前对序列进行剪切及拼接,保证测序质量>95%,序列分析采用Sequencher 5.4.6(Gene Codes Corp, Ann Arbor, MI, USA)软件。样本均送至广州海力特生物科技有限公司进行产物扩增、测序及基因亚型和耐药位点分析。基因型耐药检测具体流程遵循《HIV-1基因型耐药检测及质量保证指南(2013年版)》[4]。
1.2.2 基因亚型及耐药分析获得序列后,将序列提交至美国斯坦福大学HIV db Program数据库9.0版本序列分析软件(https://hivdb.stanford.edu/hivdb/by-sequences/)以同时进行基因亚型及耐药程度分析。根据数据库系统评分将耐药程度分为敏感(S)、潜在低度耐药(P)、低度耐药(L)、中度耐药(I)和高度耐药(H)5个水平,其中后3个水平判定毒株为耐药毒株。耐药率=对抗病毒药物发生低度及以上耐药的样本数/测序成功的样本数×100%。
1.3 统计学方法应用Excel 2007对数据进行录入整理,SPSS 25.0对人口学特征、HIV-1亚型分布以及HIV-1的PDR情况进行统计分析。计数资料采用例数、构成比进行描述,卡方检验进行比较,P≤0.05表示差异具有统计学意义。
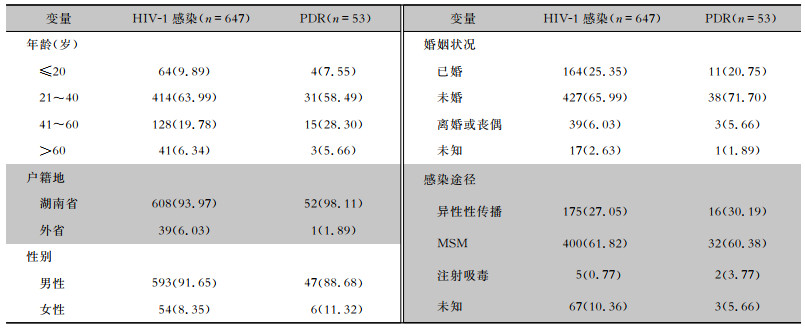
2 结果 2.1 基础资料及PDR发生情况本研究共纳入患者667例,基因型耐药检测失败患者20例,检测成功率97.00%,将检测成功的647例新确诊的HIV-1感染者纳入研究分析。647例HIV-1感染者年龄15~78岁,平均中位年龄为31岁。户籍所在地以湖南省本地患者为主(93.97%),外省患者仅占6.03%。男性病例数(91.65%)多于女性病例数(8.35%),比例为10.98 ∶1。患者集中于21~40岁年龄组(63.99%);婚姻状况以未婚居多(65.99%),经男男性行为(men who have sex with men,MSM)感染的病例数(61.82%)多于经异性性传播感染的病例数(27.05%)。
53例患者感染的HIV-1株出现PDR,发生率为8.19%,主要集中于男性(88.68%)、未婚(71.70%)、MSM(60.38%)、21~40岁的群体(58.49%)。见表 1。
| 表 1 647例新确诊HIV-1感染者基础资料及PDR发生情况[例(%)] Table 1 Basic data and PDR of 647 newly diagnosed HIV-1 infected individuals (No. of cases [%]) |
|
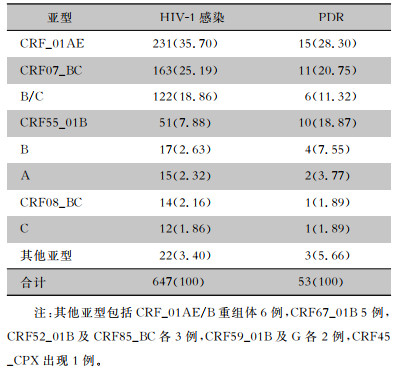
本研究共发现15种HIV-1基因亚型,其中主要流行亚型为CRF_01AE(231例,35.70%)、CRF07_BC(163例,25.19%)、B/C(122例,18.86%)、CRF55_01B(51例,7.88%),另外A(15例,2.32%)、B(17例,2.63%)、C(12例,1.86%)、CRF08_BC(14例,2.16%)及其他亚型(22例,3.40%)占比较小。其他亚型包括6例CRF_01AE/B重组体,其中5例均经MSM途径感染,1例经静脉吸毒途径感染,1例出现PDR。CRF45_CPX出现1例(0.15%),其是由A、K及U亚型混合重组而成。不同HIV-1亚型患者的PDR发生率比较,差异有统计学意义(χ2=18.62,P=0.017)。见表 2。
| 表 2 647例新确诊HIV-1感染者亚型分布情况[例(%)] Table 2 Subtype distribution of 647 newly diagnosed HIV-1 infected individuals (No. of cases[%]) |
|
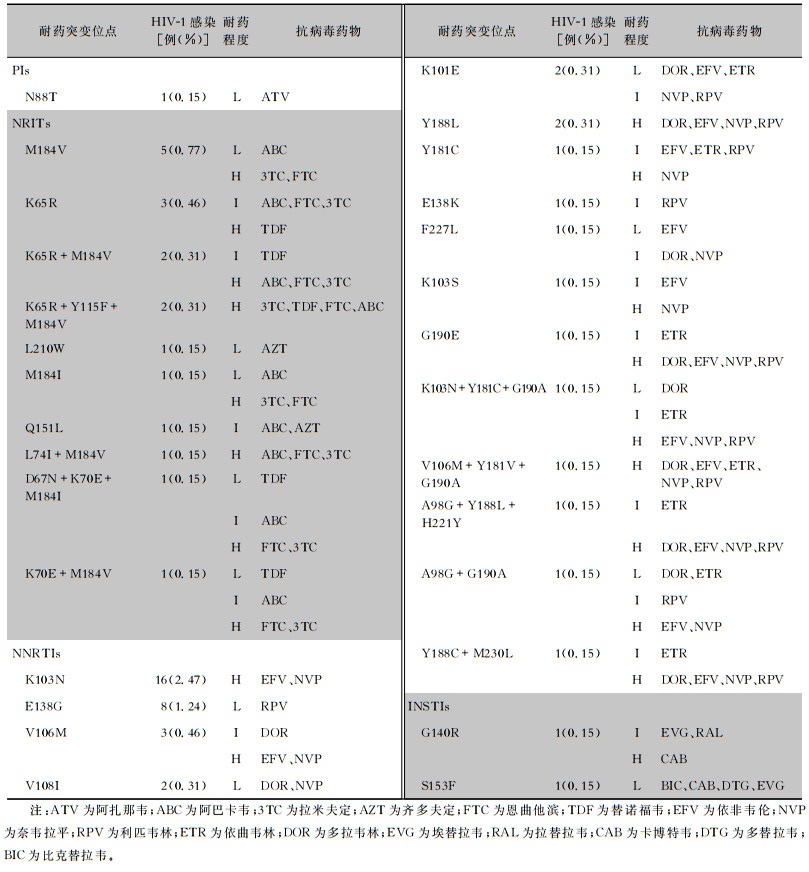
647例HIV-1感染患者中蛋白酶抑制剂(protease inhibitors, PIs)耐药率为0.15%(1例),核苷酸类逆转录酶抑制剂(nucleotide reverse transcriptase inhibitors, NRTIs)耐药率为2.78%(18例),非核苷酸类逆转录酶抑制剂(non-nucleotide reverse transcriptase inhibitors, NNRTIs)耐药率为6.65%(43例),整合酶抑制剂(integrase strand transfer inhibitors, INSTIs)耐药率为0.31%(2例)。PIs仅检出1个低度耐药位点N88T,该位点对阿扎那韦低度耐药;NRTIs常见的耐药位点为M184V(5例,0.77%)、K65R(3例,0.46%),7例(1.08%)检出多位点耐药突变;NNRTIs常见的耐药突变位点为K103N(16例,2.47%),其中5例(0.77%)检出多位点耐药突变,INSTIs检出的耐药突变位点为G140R(1例,0.15%)、S153F(1例,0.15%)。见表 3。
| 表 3 647例新确诊HIV-1感染者ART前HIV-1耐药突变位点分析 Table 3 HIV-1 drug resistance mutation loci of 647 newly diagnosed HIV-1 infected individuals before ART |
|
本研究发现发生PDR的人群主要集中于男性、未婚、MSM群体、21~40岁年龄组中,应对以上人群定期随访,避免使用耐药率较高的含NNRTIs的ART方案。湖南省HIV-1主要流行亚型为CRF_01AE、CRF07_BC、B/C和CRF55_01B,Zou等[5]在2012—2017年一项回顾性调查中发现,湖南省最常见的HIV-1亚型为CRF01_AE(64.14%)、B/C(17.91%)和B(11.50%),也报道了其他一些罕见的循环重组体。当前湖南省HIV-1优势亚型仍然以A/E重组体及B/C重组体为主,同时CRF55_01B已经成为湖南省排在第4位流行的HIV-1亚型。2013年Han等[6]首次报道在广东省东莞市和湖南省长沙市MSM人群中发现此种亚型;后经Zhao等[7]调查发现该亚型起源于广东省深圳市,通过MSM人群迅速向外扩散。该毒株致病性强,可以与其他毒株混合重组为新毒株,且更易发生耐药突变,因此应该采取手段遏制该亚型毒株在我省的传播[8]。本研究共发现15种HIV-1亚型,包括一些罕见的亚型如CRF45_CPX、CRF_01AE/B、CRF52_01B等,随着不同省市人群在湖南省流动,HIV-1毒株不断交叉重组形成新亚型,新出现的亚型可逃避宿主免疫,降低抗病毒药物的效能,故须持续强化HIV亚型监测。
本研究发现湖南省HIV-1型新确诊感染者PDR发生率为8.19%,已超过世界卫生组织(WHO)制定的低水平耐药预警线(<5%),我省PDR发生率低于浙江省(11.1%)[9]以及宁夏(12.1%)[10],但较北京市(3.4%)[11]及上海市(2.7%)[12]高,这可能与各地经济发展水平以及抗病毒药物使用不同有关。本研究发现1例(0.15%)对PIs低度耐药的突变位点,PIs具有较高的基因屏障,不易产生耐药突变,应注意观察该患者的治疗结局。NNRTIs(6.65%)和NRTIs(2.78%)作为一线ART药物时间长,基因屏障低,易发生耐药。M184V是NRTIs最常见的耐药突变位点,主要是对3TC及FTC高度耐药。当M184V单独出现时,3TC仍可存在残留的抗病毒活性,AZT的耐药发生可能会延迟,AZT、司他夫定(D4T)及TDF的敏感性会增加,并且逆转录酶的合成能力降低,因此尽管出现了M184V突变,3TC的使用仍可使临床获益[13]。K103N为NNRTIs最常见的耐药突变位点,报道[14]显示该位点突变的概率高于其他NNRTIs的耐药位点突变,可增强病毒的耐药性及适应性。而根据《中国艾滋病诊疗指南(2021年版)》[15],EFV及NVP均为初治成人及青少年患者的一线ART药物,建议关注湖南省K103N高比例情况,评估其对一线ART的影响。本研究也发现了对NRTIs及NNRTIs存在多个耐药位点突变的情况,对《中国艾滋病诊疗指南(2021年版)》[15]推荐的一线甚至二线抗病毒药物均存在不同程度的耐药,严重限制了抗病毒药物的选择,在临床实践中需要对此类患者选择个性化的ART方案。为了使患者获得更好的治疗效果,2019版欧洲学会指南建议如果需要在缺少基因型耐药检测结果的情况下启动ART,含INSTI的方案可以迅速降低病毒载量,使患者获得更好的治疗效果[16]。INSTIs具有高基因屏障,通常被认为是最安全有效的抗病毒药物。然而,本研究也发现了2例(0.31%) 对INSTIs耐药的病例,耐药突变位点分别为G140R和S153F,这与云南省在进行ART前HIV-1感染者中发现的耐药位点突变相似[17]。这些耐药位点突变导致对一系列的INSTIs出现不同程度的耐药,其中G140R对CAB呈现了高度耐药,CAB是一种长效的整合酶抑制剂,其与RPV的联合制剂已在一些国家使用,如果在治疗前发现此耐药位点突变,对于患者其可能并非是一种具有完全活性的ART药物。
综上所述,目前湖南省亚型分布复杂,CRF55_01B已成为排名第4位的优势基因亚型,此型毒株致病性强,耐药风险高,应加强研究,遏制其在湖南省内的传播;湖南省新确诊HIV-1感染者的PDR发生率(8.19%)已超过WHO设定的低水平耐药预警线(<5%)。其中多是针对NNRTI和NRTIs耐药,HIV-1耐药株感染患者多为MSM群体,需要避免在此群体中使用NNRTIs,防止病毒学失败的发生。在临床实践中,应完善治疗前HIV的耐药检测,根据检测结果为患者选择有效的ART方案,使患者获得更好治疗结果和预后,同时应加大预防与控制感染力度,阻断耐药毒株的传播。本研究的局限性:(1)由于试验条件限制,该院的耐药检测标本均送至其他机构检验,未能进一步获取到HIV-1感染者亚型其基因序列,从而未构建系统进化树。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
WHO. HIV/AIDS[EB/OL]. [2022-09-12]. https://www.who.int/health-topics/hiv-aids/.
|
| [2] |
van Zyl GU, Bedison MA, van Rensburg AJ, et al. Early antiretroviral therapy in South African children reduces HIV-1-infected cells and cell-associated HIV-1 RNA in blood mononuclear cells[J]. J Infect Dis, 2015, 212(1): 39-43. DOI:10.1093/infdis/jiu827 |
| [3] |
Luo XL, Mo LD, Su GS, et al. Incidence and types of HIV-1 drug resistance mutation among patients failing first-line antiretroviral therapy[J]. J Pharmacol Sci, 2019, 139(4): 275-279. DOI:10.1016/j.jphs.2018.11.016 |
| [4] |
中国疾病预防控制中心. HIV-1基因型耐药检测及质量保证指南(2013年版)[EB/OL]. (2013-03-20)[2022-09-12]. https://max.book118.com/html/2018/0203/151708174.shtm. Chinese Center for Disease Control and Prevention. Guidelines for HIV-1 genotyping drug resistance testing and quality assurance[EB/OL]. (2013-03-20)[2022-09-12]. https://max.book118.com/html/2018/0203/151708174.shtm. |
| [5] |
Zou XB, He JM, Zheng J, et al. Prevalence of acquired drug resistance mutations in antiretroviral-experiencing subjects from 2012 to 2017 in Hunan Province of central South China[J]. Virol J, 2020, 17(1): 38. DOI:10.1186/s12985-020-01311-3 |
| [6] |
Han XX, An MH, Zhang WQ, et al. Genome sequences of a novel HIV-1 circulating recombinant form, CRF55_01B, identified in China[J]. Genome Announc, 2013, 1(1): e00050-12. |
| [7] |
Zhao J, Cai WD, Zheng CL, et al. Origin and outbreak of HIV-1 CRF55_01B among MSM in Shenzhen, China[J]. J Acquir Immune Defic Syndr, 2014, 66(3): e65-e67. DOI:10.1097/QAI.0000000000000144 |
| [8] |
梁淑家, 辛若雷. HIV-1 CRF55_01B毒株流行特征的研究进展[J]. 实用预防医学, 2022, 29(6): 766-769. Liang SJ, Xin RL. Research progress on the epidemic characteristics of HIV-1 CRF55_01B[J]. Practical Preventive Medicine, 2022, 29(6): 766-769. |
| [9] |
Xu YF, Peng XR, Peng XM, et al. Characterization of HIV-1 subtypes and transmitted drug resistance among treatment-naive HIV-infected individuals in Zhejiang, China, 2014-2017[J]. Arch Virol, 2018, 163(8): 2233-2237. DOI:10.1007/s00705-018-3839-1 |
| [10] |
赵立华, 赵建华, 杨东智, 等. 宁夏HIV-1感染者原发性耐药及基因变异型研究[J]. 现代预防医学, 2020, 47(5): 893-897. Zhao LH, Zhao JH, Yang DZ, et al. HIV-1 genetic characteri-stics and primary drug resistance in Ningxia[J]. Modern Preventive Medicine, 2020, 47(5): 893-897. |
| [11] |
孙伟东, 姜天俊, 黄辉煌, 等. 北京地区HIV-1感染者治疗前耐药特征及2年抗病毒治疗效果研究[J]. 国际病毒学杂志, 2020, 27(3): 224-227. Sun WD, Jiang TJ, Huang HH, et al. Characteristics of pretreatment drug resistance in HIV-1 infected patients in Beijing and the efficacy of two-year antiretroviral therapy[J]. International Journal of Virology, 2020, 27(3): 224-227. |
| [12] |
盖晶, 吴健, 王绪琴, 等. 上海地区艾滋病病毒感染者/艾滋病患者原发性耐药基因调查及抗病毒治疗效果观察[J]. 疾病监测, 2017, 32(2): 162-167. Ge J, Wu J, Wang XQ, et al. Observation of HIV primary drug resistance effect of highly active antiretroviral therapy in Shanghai[J]. Disease Surveillance, 2017, 32(2): 162-167. |
| [13] |
Miller V, Stark T, Loeliger AE, et al. The impact of the M184V substitution in HIV-1 reverse transcriptase on treatment response[J]. HIV Med, 2002, 3(2): 135-145. DOI:10.1046/j.1468-1293.2002.00101.x |
| [14] |
Bacheler LT, Anton ED, Kudish P, et al. Human immunodeficiency virus type 1 mutations selected in patients failing efavirenz combination therapy[J]. Antimicrob Agents Chemo-ther, 2000, 44(9): 2475-2484. DOI:10.1128/AAC.44.9.2475-2484.2000 |
| [15] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2021年版)[J]. 中国艾滋病性病, 2021, 27(11): 1182-1201. Chinese Medical Association Infectious Diseases Branch of the AIDS Hepatitis C Group, Chinese Center for Disease Control and Prevention. Chinese guidelines for diagnosis and treatment of HIV/AIDS (2021 edition)[J]. Chinese Journal of AIDS & STD, 2021, 27(11): 1182-1201. |
| [16] |
EACS. EACS guidelines: version 10.0[EB/OL]. (2019-11)[2022-09-12]. https://www.eacsociety.org/media/guidelines-10.0_final_chinese.pdf.
|
| [17] |
邓雪媚, 刘家法, 张米, 等. 云南省HIV/AIDS病人原发性整合酶基因耐药突变情况[J]. 中国艾滋病性病, 2019, 25(4): 327-330, 341. Deng XM, Liu JF, Zhang M, et al. Mutations of primary integrase gene resistance of HIV/AIDS patients in Yunnan pro-vince[J]. Chinese Journal of AIDS & STD, 2019, 25(4): 327-330, 341. |



