2. 华中科技大学同济医学院附属同济医院检验科, 湖北 武汉 430030
2. Department of Laboratory Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
肺炎克雷伯菌(Klebsiella pneumoniae,KP) 属于肠杆菌目细菌,是医院感染常见的致病菌,可导致肺炎、脑膜炎、泌尿系统感染、肝脓肿、血流感染等[1]。近年来,由于抗菌药物的过度使用,碳青霉烯耐药质粒在菌种间快速传播[2],耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)检出率呈快速上升趋势。CRKP是重症监护病房(ICU)常见的感染病原菌之一,尤其是神经内科ICU患者,由于病情重、住院时间长、侵入性操作多,更容易发生CRKP感染。CRKP所致感染病死率高,且耐药程度日趋严峻,可能面临无药可用的困境[3-4]。因此,如何控制CRKP在医院内的传播引起了广泛的关注和研究[5-6]。2021年6月27日—7月14日某院神经内科ICU相继检出CRKP感染病例7例,医院感染管理科立即进行现场流行病学调查和环境卫生学监测,查找原因并采取相应的控制措施,最终得到有效控制。
1 对象与方法 1.1 研究对象2021年6月27日—7月14日入住医院神经内科ICU的57例患者,排除同期入住的2例院外转入的CRKP病例和1例引流液CRKP定植或污染病例, 最终纳入的7例均为医院感染病例。
1.2 方法 1.2.1 流行病学调查医院感染管理科启动医院感染暴发控制应急预案,通过医院感染监测系统回顾性收集相关病例资料,进行现场调查,与科室医院感染控制小组,以及主管医生、护士、保洁员采取现场访谈等方式进行流行病学调查。病例资料包括患者性别、年龄等人口学资料,以及入院时间、入院诊断、侵入性操作、用药情况、病情转归等。现场调查包括CRKP患者是否进行集中隔离,各项隔离措施实施情况,随机监测医务人员无菌操作及手卫生,随机监测保洁人员环境清洁消毒操作。
1.2.2 诊断标准依据《医院感染诊断标准(试行)》[7]诊断医院感染病例。根据《医院感染暴发控制指南》[8],疑似医院感染暴发定义为在医疗机构或其科室的患者中,短时间内出现3例以上临床症候群相似、怀疑有共同感染源的感染病例的现象。
1.2.3 环境卫生学监测医院感染管理科于7月15日对神经内科ICU工作状态中的15名医务人员手(包括医生、护士、保洁员),以及可疑污染的物体表面进行采样,包括床单元(床栏、床头柜、床帘、输液泵、监护仪面板、呼吸机面板、治疗车、降温毯旋钮、床周地面)、公共区域(工作站计算机鼠标、键盘,以及门把手、开关面板)及公用设备[手持电脑(PDA)]等共55个位点。用浸有生理盐水的无菌棉拭子对物体表面进行涂抹采样,然后涂布于耐碳青霉烯肠杆菌科检测用培养基(CRE显色鉴定培养基,郑州点石生物技术有限公司),立即送至37℃温箱培养,48 h后观察菌落情况,并对可疑菌落进行菌株鉴定和药敏试验。
1.2.4 病原学鉴定及药敏试验使用VITEK 2 Compact全自动微生物分析系统和Clin -To F-Ⅱ飞行时间质谱仪进行菌株鉴定,药敏试验采用K-B纸片扩散法,以美罗培南或亚胺培南MIC≥4 μg/L判定为耐药,质控菌株为肺炎克雷伯菌ATCC 700603,按照2020年美国临床实验室标准化协会(CLSI)标准[9]进行结果判读。
1.3 统计分析应用SPSS 21.0进行数据分析,计数资料以例数或百分比表示,采用χ2检验或Fisher确切概率法进行比较,计量资料以M(P25,P75)表示,检验水准α=0.05。
2 结果 2.1 医院感染暴发判定2021年6月27日—7月14日神经内科ICU CRKP医院感染罹患率为12.28%(7/57),2019年同期罹患率为2.27%(1/44),2020年同期罹患率0(0/29),各年度比较,差异有统计学意义(P<0.05)。本次可判定为一起CRKP疑似医院感染暴发事件。
2.2 流行病学调查 2.2.1 人群分布7例患者检出CRKP的药敏结果基本一致,仅对替加环素和米诺环素中介或敏感,对其他抗菌药物均耐药。4例男性,3例女性,年龄中位数为67(54,81)岁,入住ICU时间11(7,15)d,气管插管/切开时间4(3,10)d;7例患者在检出前均使用含酶抑制剂或碳青霉烯类抗生素;2例死亡,1例转科治疗,4例自行出院。首例感染CRKP的患者在入院第21天肺部感染耐药铜绿假单胞菌,入院第194天(此次暴发期间)又发生CRKP肺部感染。其余6例患者均为CRKP肺部感染,均有气管插管或气管切开、中心静脉置管和导尿管置管。医院感染诊断均为呼吸机相关肺炎(ventilator-associated pneumonia,VAP),见表 1。
| 表 1 7例CRKP医院感染患者基本信息 Table 1 Basic information of 7 patients with CRKP HAI |
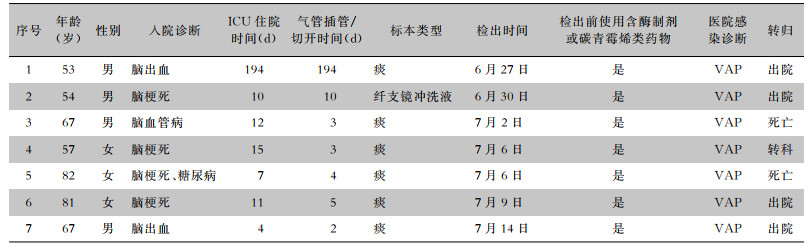
|
2021年6月27日首例患者检出CRKP之后,6月30日、7月2日、7月6日、7月9日、7月14日陆续有6例患者检出CRKP,见图 1。
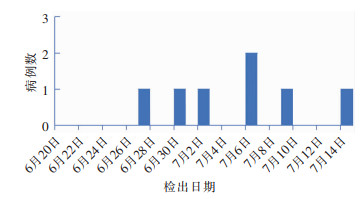 |
| 图 1 CRKP医院感染病例检出时间分布 Figure 1 Detection time distribution of CRKP HAI cases |
7例患者在病区散在分布,均未离开病床活动。医生、护士在病区间诊疗存在交叉,7例患者的保洁员均为同一人,见图 2。
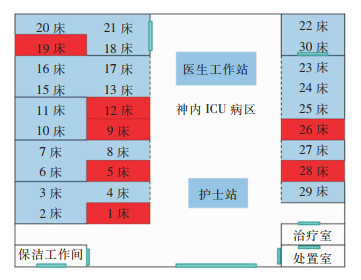 |
| 注:红色标识为CRKP医院感染患者。 图 2 CRKP医院感染病例空间分布 Figure 2 Spatial distribution of CRKP HAI cases |
15份手标本中,1名保洁员手标本检出CRKP,检出率为6.67%;55份物体表面标本中,3份标本检出CRKP,检出率为5.45%,分别为19床床头柜、19床输液泵和1号PDA。4株CRKP药敏结果与患者检出的CRKP药敏结果基本一致,仅对替加环素和米诺环素中介或敏感,对其他抗菌药物均耐药。
2.4 控制措施及效果2021年7月15日医院感染管理科接到报告后,立即到现场调查并集中隔离CRKP感染患者,严格落实各项隔离措施。在集中隔离房间门口张贴明显的标识,限制医生查房人数,固定责任护士,规范诊疗操作,熟练使用隔离防护用品;强化医生对医院感染病例的“早识别、早诊断、早隔离”意识;加强对抗菌药物合理使用及“三管”集束化防控措施的督导。同时,针对环境卫生学检查结果采取如下措施:(1)加强对保洁员的培训与督导,考核合格后才能上岗;(2)对整个病区采用“搬家式”大消毒,保洁公司集中5名保洁员对环境物体表面进行彻底地消毒;(3)对CRKP感染患者床单元,改用消毒湿巾进行擦拭消毒,每日3次;(4)加强对公用设备清洁消毒,责任护士落实“一用一消”;(5)加强手卫生宣教及督导力度,每日上下午随机调取视频观察手卫生指征是否落实,并在科室内部公布。采取以上措施后,随后一个月无新发CRKP感染病例,2021年6月27日—7月14日CRKP感染罹患率与7月15日—8月15日CRKP感染罹患率相比,差异有统计学意义(12.28% VS 0,P=0.001)。
3 讨论CRKP耐药主要机制[6]包括以下四点:(1)碳青霉烯酶的产生(KPC、NDM、OXA等);(2)高产AmpC酶伴外膜孔蛋白丢失;(3)靶位点的改变;(4)主动泵出系统的过量表达。自2001年美国疾病控制与预防中心(CDC)首次报导产KPC-1的KP以来,CRKP很快波及全球,危及医院内的重症患者。近十年,KP对碳青霉烯类抗生素的耐药率呈逐年上升趋势,2021年中国细菌耐药监测网发布肺炎克雷伯菌对亚胺培南耐药率为20.8%,美罗培南耐药率为21.9%[10]。CRKP出现给临床抗感染治疗带来了极大的挑战,多黏菌素普遍被认为是治疗CRKP感染的最后一道防线。然而,随着多黏菌素的应用,耐药问题也随之出现[11]。尤其是mcr基因的发现[12-13],表明不仅可以通过染色体突变导致多黏菌素耐药,也可以通过质粒进行水平传播,使CRKP可能由多重耐药菌转变为泛耐药菌。因此,控制CRKP在医院内传播迫在眉睫。
神经内科ICU在18 d内7例患者检出CRKP,药敏表型基本一致可以初步判断疑似医院感染暴发。通过与前两年同期比较,感染罹患率明显增高,可以判定为疑似医院感染暴发。2例判定为院外带入CRKP感染患者,分别于6月26日、7月3日入院,6月27日、7月5日检出CRKP;1例判定为定植或污染CRKP患者于5月25日入院,7月9日检出CRKP。本次疑似医院感染暴发首例患者于6月27日检出CRKP,与院外带入患者CRKP药敏结果基本一致,推测6月26日入院患者可能为传染源。同时,本次调查观察到7例CRKP感染患者住院时间超过一周,平均年龄为67岁,均有气管插管/气管切开、中心静脉置管和导尿管置管,标本送检前均使用过含酶抑制剂或碳青霉烯类抗生素,与国内外CRKP感染的危险因素研究结果[14-15]相符。临床应减少含酶抑制剂和碳青霉烯类抗生素的使用,减少侵入性操作,尽量缩短住院时间和机械通气时间。
现场调查发现,CRKP感染患者虽然执行了床旁隔离,但未按照《医院隔离技术规范》[16]执行集中隔离。医护人员存在感染与非感染患者诊疗交叉行为,保洁员没有严格分区使用地巾,存在感染与非感染患者共用拖布头的情况。感染管理科督导实施严格集中隔离,固定责任护士,严格限制医生查房人数,各项无菌操作等,CRKP的流行得到有效遏制。控制传染源、严格隔离多重耐药菌检出患者[17]一直是控制多重耐药菌传播的核心措施,人手不足和缺乏足够的隔离室是隔离措施实施最常见的障碍。本次暴发采取分区隔离的管理策略,取得较好的效果,与王娟等[18]研究结果一致。
医院诊疗环境包括以下三个基本要素:患者诊疗单元,使用的医疗器械,患者、工作人员及陪护的管理。每一个基本要素均可能增加病原菌传播的风险。医院是潜在储菌场所[19]。本次环境卫生学调查在保洁员手上、患者床头柜、输液泵及1号PDA检出CRKP,药敏与患者检出的CRKP药敏结果基本一致。通过严格的清洁消毒措施可以阻断医院环境对CRKP的传播,包括:严格执行手卫生措施;对物体表面进行彻底的“搬家式”大消毒,使用消毒湿巾对CRKP定植/感染患者的床单元进行消毒,“一用一弃”,地巾分区使用;加强公用设备的清洁消毒,使用后的PDA、腿部按摩气压泵“一用一消”,医生护士站计算机鼠标、键盘等设备一天进行3次擦拭消毒。本次调查发现环境清洁与消毒是工作中较薄弱的环节,保洁员文化程度较低,年龄偏大,对隔离知识掌握不足[20],保洁公司应当细化标准操作流程,改进培训方式,加强对日常工作的督导检查;病区护士长对保洁员实际操作应加强指导与考核。同时,研究[21]表明,ICU工作人员的手也可能被CRKP污染,介导其传播,应加强保洁员及医务人员的手卫生考核。
综上所述,早期识别医院感染病例,及时查找原因,采取针对性干预措施,能够有效地控制医院感染暴发。严格隔离患者,落实各项隔离措施和规范无菌操作,限制隔离区人员流动,做好手卫生,以及环境物体表面、公用设备设施消毒处理,是预防多重耐药菌感染暴发的关键。本次调查也存在不足的地方,未能对患者及周边环境采样标本进行同源性分析,不能明确此次暴发的最初传染源,仅能对传播途径进行初步推测。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria[J]. Lancet Infect Dis, 2009, 9(4): 228-236. DOI:10.1016/S1473-3099(09)70054-4 |
| [2] |
Gao H, Liu YD, Wang RB, et al. The transferability and evolution of NDM-1 and KPC-2 co-producing Klebsiella pneumo-niae from clinical settings[J]. EBioMedicine, 2020, 51: 102599. DOI:10.1016/j.ebiom.2019.102599 |
| [3] |
Cienfuegos-Gallet AV, Ocampo de Los Ríos AM, Sierra Viana P, et al. Risk factors and survival of patients infected with carbapenem-resistant Klebsiella pneumoniae in a KPC endemic setting: a case-control and cohort study[J]. BMC Infect Dis, 2019, 19(1): 830. DOI:10.1186/s12879-019-4461-x |
| [4] |
Ramos-Castañeda JA, Ruano-Ravina A, Barbosa-Lorenzo R, et al. Mortality due to KPC carbapenemase-producing Klebsiella pneumoniae infections: systematic review and Meta-analy- sis: mortality due to KPC Klebsiella pneumoniae infections[J]. J Infect, 2018, 76(5): 438-448. DOI:10.1016/j.jinf.2018.02.007 |
| [5] |
Magiorakos AP, Burns K, Rodríguez Baño J, et al. Infection prevention and control measures and tools for the prevention of entry of carbapenem-resistant Enterobacteriaceae into healthcare settings: guidance from the European Centre for Disease Prevention and Control[J]. Antimicrob Resist Infect Control, 2017, 6: 113. DOI:10.1186/s13756-017-0259-z |
| [6] |
Chang D, Sharma L, Dela Cruz CS, et al. Clinical epidemiology, risk factors, and control strategies of Klebsiella pneumo-niae infection[J]. Front Microbiol, 2021, 12: 750662. DOI:10.3389/fmicb.2021.750662 |
| [7] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the People's Republic of China. Diagnostic criteria for nosocomial infections(proposed)[J]. Natio-nal Medical Journal of China, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [8] |
中华人民共和国国家卫生和计划生育委员会. 医院感染暴发控制指南: WS/T 524-2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China. Guideline of control of healthcare associated infection outbreak: WS/T 524-2016[S]. Beijing: Standards Press of China, 2017. |
| [9] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing-30th edition[EB/OL]. [2022-11-12]. https://webstore.ansi.org/standards/clsi/clsim100ed30.
|
| [10] |
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of antimicrobial resistance among the bacterial isolates in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. |
| [11] |
Rojas LJ, Salim M, Cober E, et al. Colistin resistance in carbapenem-resistant Klebsiella pneumoniae: laboratory detection and impact on mortality[J]. Clin Infect Dis, 2017, 64(6): 711-718. |
| [12] |
Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168. DOI:10.1016/S1473-3099(15)00424-7 |
| [13] |
Xavier BB, Lammens C, Ruhal R, et al. Identification of a novel plasmid-mediated colistin-resistance gene, mcr-2, in Escherichia coli, Belgium, June 2016[J]. Euro Surveill, 2016, 21(27): 30280. |
| [14] |
张侃, 刘长鑫, 马琳, 等. 呼吸内科患者产OXA-48型碳青霉烯酶肺炎克雷伯菌感染的危险因素及临床特征[J]. 中华医院感染学杂志, 2020, 30(10): 1517-1522. Zhang K, Liu CX, Ma L, et al. Risk factors for OXA-48-producing carbapenem-resistant Klebsiella pneumoniae infection in respiratory medicine department patients and clinical characteristics[J]. Chinese Journal of Nosocomiology, 2020, 30(10): 1517-1522. |
| [15] |
Hsu JY, Chuang YC, Wang JT, et al. Healthcare-associated carbapenem-resistant Klebsiella pneumoniae bloodstream infections: risk factors, mortality, and antimicrobial susceptibi-lity, 2017-2019[J]. J Formos Med Assoc, 2021, 120(11): 1994-2002. DOI:10.1016/j.jfma.2021.04.014 |
| [16] |
中华人民共和国卫生部. 医院隔离技术规范: WS/T 311-2009[S]. 北京: 中国标准出版社, 2009. Ministry of Health of the People's Republic of China. Technique standard for isolation in hospitals: WS/T 311-2009[S]. Beijing: Standards Press of China, 2009. |
| [17] |
Dai YQ, Meng TJ, Wang XL, et al. Validation and extrapolation of a multimodal infection prevention and control intervention on carbapenem-resistant Klebsiella pneumoniae in an epidemic region: a historical control quasi-experimental study[J]. Front Med (Lausanne), 2021, 8: 692813. |
| [18] |
王娟, 宋慧敏, 胡慧芳, 等. 同病种同室隔离对多重耐药菌感染应急处置效果观察[J]. 中国消毒学杂志, 2019, 36(8): 638-639. Wang J, Song HM, Hu HF, et al. Observation on the effect of emergency treatment of multi-drug resistant bacteria infection by the same bacteria and isolation in the same room[J]. Chinese Journal of Disinfection, 2019, 36(8): 638-639. |
| [19] |
Protano C, Cammalleri V, Romano Spica V, et al. Hospital environment as a reservoir for cross transmission: cleaning and disinfection procedures[J]. Ann Ig, 2019, 31(5): 436-448. |
| [20] |
曹洋, 刘坤, 杨雪松, 等. 医院保洁员环境物体表面清洁消毒认知现状调查分析及对策研究[J]. 中国消毒学杂志, 2019, 36(8): 593-597. Cao Y, Liu K, Yang XS, et al. A survey of awareness status of cleaning and disinfection of environmental surface among hospital cleaners and countermeasure research[J]. Chinese Journal of Disinfection, 2019, 36(8): 593-597. |
| [21] |
Wei L, Wu LF, Wen HX, et al. Spread of carbapenem-resis-tant Klebsiella pneumoniae in an intensive care unit: a whole-genome sequence-based prospective observational study[J]. Microbiol Spectr, 2021, 9(1): e0005821. |



