2. 南昌大学玛丽女王学院,江西 南昌 330031
2. Nanchang University Queen Mary School, Nanchang 330031, China
尽管结核病是可以被预防和治疗的,但其仍然是世界上最致命的传染病之一,四分之一的世界人口,近20亿人患过结核病,每年约有1 000万人感染结核分枝杆菌(Mycobacterium tuberculosis, MTB),每年报告超过500 000例耐多药结核病病例,每天超4 100例死亡[1]。任何人都可能患上结核病,但一些人群患结核病的风险较其他人高。人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染者相较其他人群更容易患上结核病,HIV感染者中结核病发病率比一般人群高18倍。艾滋病和肺结核是世界上最致命的两种传染病,且这两种传染病还相互关联。结核病是HIV感染者死亡的主要原因;在潜伏性MTB感染者中,HIV感染是已知发展为结核病的最强风险因素。感染HIV-1后,巨噬细胞中toll样受体2(toll-like receptor 2, TLR2)可直接参与增强细胞对HIV-1感染的抵抗力[2]。同时,MTB在巨噬细胞中诱导肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)也需要TLR。巨噬细胞识别MTB细胞壁成分后可分泌TNF-α和其他细胞因子,这些细胞因子对机体产生保护性炎症反应至关重要。TLR2确定为这种诱导所需的特异性TLR[3]。针对这两种疾病共同的先天免疫系统,进一步检索文献。在小鼠巨噬细胞系中表达的一种髓样分化蛋白88(myeloid differentiation protein 88, MyD88),为TLR信号传导所需的信号成分,可阻断MTB诱导的TNF-α生成。而MTB蛋白Rv3529c与TLR途径衔接蛋白MyD88的死亡结构域(death domain)有高度相似性[4]。Rv3529c蛋白可通过与IL-1受体相关激酶(IL-1 receptor-related kinase, IRAK1)竞争性结合,明显抑制TLR2诱导的MyD88与IRAK1结合,从而抑制TLR2的激活[4]。IRAK1和IRAK4是关键信号的传递介质,在TLR介导的先天性免疫和炎症反应中发挥关键作用。本研究利用多种蛋白质分析工具对Rv3529c蛋白进行生物信息学分析,预测其结构和功能,并在此基础上对其进行原核表达,为进一步了解该蛋白在MTB致病机制中的作用及后续试验提供基础。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株pET-32a质粒载体及大肠埃希菌BL21(DE3)感受态细胞为本实验室保存;pET-32a-Rv3529c重组质粒由生工生物工程(上海)股份有限公司构建。
1.1.2 主要试剂Nco I和Xho I限制性内切酶及Taq酶购自赛默飞世尔科技(中国)有限公司,质粒小提试剂盒、Pro-Light HRP化学发光检测试剂购自天根生化科技(北京)有限公司,氨苄西林、IPTG、脱脂奶粉、小鼠抗His标签抗体、羊抗鼠二抗及BCA蛋白浓度检测试剂盒等试剂购自北京索莱宝科技有限公司,SDS-PAGE凝胶电泳试剂购自上海雅酶生物科技有限公司,Ni Resin FF购自南京金斯瑞生物科技有限公司。
1.2 方法 1.2.1 Rv3529c基因核苷酸序列及编码蛋白氨基酸序列信息的获取通过UniProt知识库(UniProtKB)、NCBI Gene数据库获取MTB(菌株H37Rv)Rv3529c基因的核苷酸序列,以及该基因编码蛋白的氨基酸序列相关信息。
1.2.2 蛋白二、三级结构预测及绘图采用PredictProtein服务[5]分析该蛋白的二级结构,采用AlphaFold系统[6]和SWISS-MODEL服务[7]共同预测该蛋白三级结构并建模。
1.2.3 蛋白特性及信号肽预测分析选择ProtParam工具[8]对该蛋白的分子质量、等电点、氨基酸和原子组成、消光系数、半衰期、不稳定系数、脂肪族氨基酸指数等进行预测分析;运用ProtScale[8]分析蛋白的亲疏水性;通过SignalP-5.0服务[9]预测蛋白的信号肽。
1.2.4 蛋白跨膜结构及亚细胞定位运用DeepTMHMM服务和ProtCompB方法预测分析该蛋白的跨膜结构和亚细胞定位。
1.2.5 重组质粒pET-32a-Rv3529c的鉴定与转化将重组质粒pET-32a-Rv3529c进行Nco I和Xho I双酶切鉴定,并对质粒进行测序验证,将鉴定后的重组质粒转入感受态BL21(DE3)细胞,42℃热激后涂布在含有氨苄西林(50 μg/mL)的平板上,37℃培养。
1.2.6 重组蛋白的诱导表达挑取上述单个菌落至含有氨苄西林(50 μg/mL)的液体培养基中,置于摇床培养,37℃,200 r/min。当OD值达到0.6时,添加0.5 mmol诱导剂IPTG,为探究重组蛋白的优化表达条件,将菌液分别于20℃条件下培养过夜,37℃条件下培养6 h,未添加诱导剂的为阴性对照。培养结束后用离心机3 000 r/min离心10 min,弃上清,收集菌体。
1.2.7 重组蛋白的Western Blot鉴定与纯化将收集的菌体用PBS重悬后超声破碎,4℃,12 500 r/min,离心5 min,分别取上清及沉淀蛋白进行制样,选择12%浓度SDS-PAGE电泳分析,为确定目的蛋白是否表达,按Western Blot步骤进行检测,一抗为鼠抗His标签,二抗为羊抗鼠,用HRP化学发光试剂显色。使用亲和层析Ni柱对超声破碎后的菌体沉淀进行纯化,纯化后使用不同浓度的尿素(8、6、4、2 mol/L)和PBS进行复性,最后用超滤离心管浓缩,收集蛋白质并用BCA法测定浓度。
1.2.8 序列比对分析及构建系统进化树使用UniProtKB中自带的Blast工具,比对Rv3529c基因编码的氨基酸序列,筛选出同源性较高的氨基酸序列,运用MEGA 11软件为筛选后的多条氨基酸序列构建进化树。
1.2.9 蛋白免疫表位分析采用IEDB数据库预测该蛋白的CD4+T细胞免疫原性[10]及B细胞抗原表位[11]。
1.2.10 蛋白相互作用分析通过STRING数据库[12]分析Rv3529c基因编码蛋白的蛋白质相互作用。
2 结果 2.1 Rv3529c基因编码蛋白质的基本信息通过查找和比对,MTB Rv3529c基因编码的蛋白质条目为I6YCC4,氨基酸总数共384个,基因编码为CCP46351.1,Rv3529c基因全长1 155 bp,在基因组NC_000962.3中的位置为3 965 884至3 967 038。
2.2 蛋白的二三级结构Rv3529c基因编码蛋白的二级结构预测结果如图 1第一、三行所示,蓝色表示螺旋结构(helix),主要包括α-螺旋,占蛋白质总长度的51.04%;红色条带显示该蛋白含延展结构(strand)5.21%,主要指β-折叠;其他结构(other)用黄色指示,共占蛋白质总长度的43.75%,该蛋白质可以归类为混合类型(“Mixed”:Helix>45%且Strand>5%)。
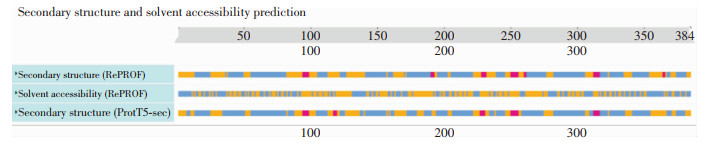 |
| 图 1 Rv3529c蛋白的二级结构预测结果 Figure 1 Prediction results of secondary structure of protein Rv3529c |
该蛋白的三级结构建模如图 2示,SWISS -MODEL服务显示(图 2A)该蛋白与模板2zq5.1.A的序列一致性为99.74%,该模板来自MTB H37Rv磺基转移酶STF1的晶体结构,三级结构的GMQE评分为0.95,QMEANDisCo Global评估分数为0.91±0.05(分数范围为0~1,分数越大模型质量越高)。建模显示该蛋白为单体蛋白,不含具有生物活性的配体。AlphaFold系统建模(图 2B)与其相似度较高,说明该蛋白三级结构较为稳定,预测模型可信度较高。
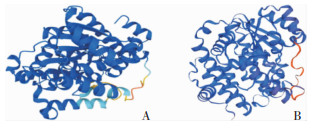 |
| 图 2 Rv3529c蛋白的三级结构建模图 Figure 2 Modeling results of tertiary structure of protein Rv3529c |
该蛋白的分子式为C1930H2959N547O569S13,分子量为43 345.83;理论等电点(pI)为6.04;氨基酸总数为384个,其中丙氨酸(Ala)、亮氨酸(Leu)均为44个,分别占氨基酸总数的11.5%,其余氨基酸含量占比均低于10.0%(结果未列出);带负电荷的残基总数(Asp+Glu)为47个,带正电荷的残基总数(Arg+Lys)为38个。该蛋白在水溶液中吸光度(A280 nm)处测量时,若所有成对的半胱氨酸(Cys)残基都形成胱氨酸,消光系数为74 955/mol · cm;若所有的Cys残基都被还原,消光系数为74 830/mol · cm。该蛋白在大肠埃希菌体内半衰期>10 h;不稳定指数31.89,为稳定蛋白质;脂肪族氨基酸指数(aliphatic index)为79.87,脂肪族氨基酸指数越大则对蛋白质热稳定性提高越有利。蛋白的总平均亲水性(grand average of hydropathicity)为-0.388,在第5位氨基酸处得分最小(-2.756),在240位氨基酸处得分最大(2.000),见图 3。综合分析认为该蛋白质为亲水性蛋白质,进行原核表达时很可能以可溶性形式表达。经SignalP分析后可知,此蛋白不产生信号肽,见图 4。
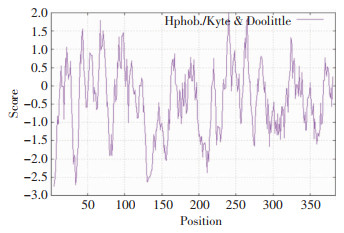 |
| 图 3 Rv3529c蛋白的亲疏水性预测结果 Figure 3 Prediction result of hydrophilicity of protein Rv3529c |
 |
| 图 4 Rv3529c蛋白的信号肽预测结果 Figure 4 Prediction results of signal peptide of protein Rv3529c |
经DeepTMHMM预测后发现,该蛋白跨膜螺旋数为0,说明此蛋白并非跨膜蛋白,见图 5。经ProtComp综合预测分析可知,该蛋白亚细胞定位可能位于细胞质(Cytoplasmic)内或细胞膜(Membrane)上。
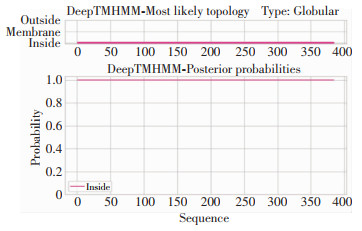 |
| 图 5 Rv3529c蛋白的跨膜区预测结果 Figure 5 Prediction results of transmembrane domain of protein Rv3529c |
将重组质粒采用Nco I和Xho I双酶切后,采用0.8% 琼脂糖凝胶电泳进行检测,大小如图 6所示,凝胶电泳检测在5 000、1 000 bp附近有特异条带,分子量大小与pET-32a空载质粒理论值5 900 bp及Rv3529c基因理论值1 155 bp一致,符合预期,说明重组质粒构建成功。
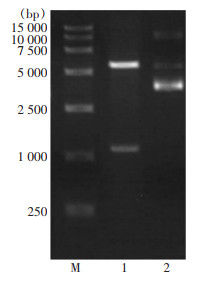 |
| 注:M为DNA Marker,1泳道为Nco I和Xho I消化后的质粒,2泳道为质粒。 图 6 重组质粒酶切图谱 Figure 6 Recombinant plasmid digestion map |
在菌液中添加0.5 mmol诱导剂IPTG,并分别置于20、37℃条件下培养,取离心后菌体重悬,重悬菌液经超声破碎离心后得到上清与沉淀,将各条件下得到的上清与沉淀进行12%SDS-PAGE电泳。在20℃沉淀及37℃沉淀泳道中,约大于60 kDa的位置上出现明显的蛋白条带,条带的分子量大小与预测的Rv3529c蛋白质分子61 kDa大小一致(因连接含有His标签的pET-32a质粒),提示此蛋白可能为Rv3529c。见图 7。
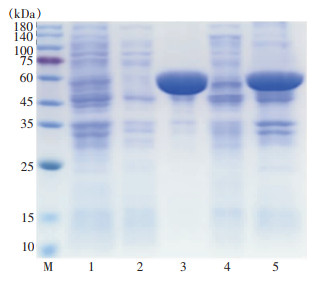 |
| 注:M为Protein Marker,1泳道为诱导前总蛋白,2泳道为20℃上清,3泳道为20℃沉淀,4泳道为37℃上清,5泳道为37℃沉淀。 图 7 Rv3529c蛋白SDS-PAGE电泳结果 Figure 7 SDS-PAGE electrophoresis results of protein Rv3529c |
进行Western Blot鉴定,结果显示重组蛋白能被抗His标签单克隆抗体识别,识别得到条带均在62 kDa附近,与预测分子量61 kDa相符合,表明成功诱导获得Rv3529c蛋白,蛋白以包涵体形式存在于沉淀中,见图 8。纯化并浓缩后经BCA法测蛋白浓度,测得蛋白浓度为0.630 mg/mL,见图 9。
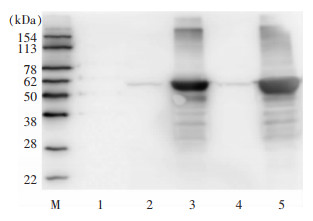 |
| 注:M为Protein Marker,1泳道为诱导前总蛋白,2泳道为20℃上清,3泳道为20℃沉淀,4泳道为37℃上清,5泳道为37℃。 图 8 Rv3529c蛋白的Western Blot鉴定结果 Figure 8 Western Blot identification results of protein Rv3529c |
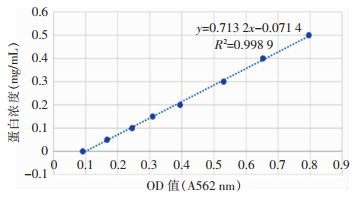 |
| 图 9 BCA蛋白浓度测定标准曲线 Figure 9 Standard curve of protein concentration determinated by BCA method |
经氨基酸序列比对后,MTB H37Rv菌种Rv3529c基因编码的蛋白与Mycobacterium riyadhense、Mycobacterium shinjukuense、嗜血分枝杆菌(Mycobacterium haemophilum)、未分类的分枝杆菌(unclassified Mycobacterium)、副结核分枝杆菌(Mycobacterium paratuberculosis)、鸟分枝杆菌亚种(Mycobacterium avium subsp. avium)均比对出高相似度氨基酸序列,UniProtKB中蛋白质条目分别为A0A1X2CIH0、A0A7I7MV45、A0A0I9TAB 7、A0A1A0MHC8、Q743Q4、X8B0C4,序列相似覆盖区域分别为90.4%、89.6%、86.7%、88.7%、88.7%、88.7%,用MEGA11软件构建系统进化树,结果见图 10,表明该蛋白与多个菌株中的蛋白质起源相近,具有较高的同源性。
 |
| 图 10 Rv3529c蛋白的系统进化树 Figure 10 Phylogenetic tree of protein Rv3529c |
运用IEDB数据库预测CD4+T细胞的免疫原性,最大综合得分阈值默认为50,返回6个可识别性较高的结果。见表 1。
| 表 1 Rv3529c蛋白CD4+T细胞免疫原性预测结果 Table 1 Prediction results of CD4+T cell immunogenicity of protein Rv3529c |
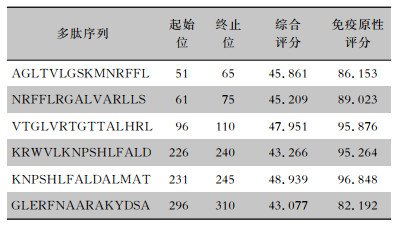
|
通过IEDB分析预测B细胞抗体表位,结果见图 11。其中,4-14、24-38、49-55、80-88、127-145、151-177、183-210、221、273-282、345-346、348-377共11组氨基酸为B细胞优势表位,可作为抗体识别靶点,最大得分0.658。
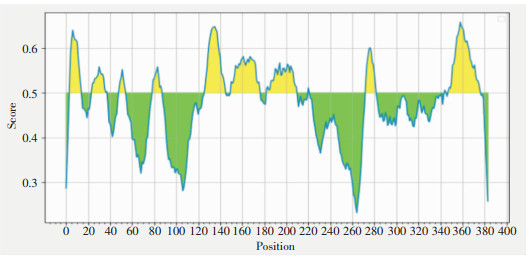 |
| 图 11 Rv3529c蛋白线性抗体表位预测结果 Figure 11 Prediction results of linear antibody epitope of protein Rv3529c |
查询STRING数据库后,获得与Rv3529c蛋白相互作用的蛋白有Rv3531c、Rv3530c、Rv3888c、Rv0310c、kshA、Rv0760c、hsaA、hsaC、Rv3527和kstR(见图 12)。通过分析Rv3529c的相互作用蛋白,推测Rv3529c可能在活化的巨噬细胞内参与氧化还原反应,参与细胞内被吞噬的微生物代谢,调节宿主体内细胞的转录反应。
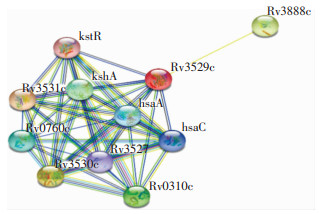 |
| 图 12 与Rv3529c蛋白相互作用的蛋白示意图 Figure 12 Schematic diagram of proteins interacting with protein Rv3529c |
宿主为防御病原体的侵袭演化出多种防御机制,参与抵抗MTB的免疫反应主要为固有免疫反应。体内巨噬细胞接触MTB后,首先是位于这些细胞表面或细胞质溶胶中的模式识别受体(pattern recognition receptors, PRRs)识别微生物相关分子模式(microbe-associated molecular patterns, MAMPs)[13]。不同组巨噬细胞PRRs识别MTB的不同组MAMPs,这些PRRs触发固有免疫应答,对抗被宿主细胞识别为异物的分子。一组称为TLR的PRRs识别MTB,可触发细胞信号传导,推测诱导可控制感染的促炎症反应[14]。
目前在人类和小鼠中共鉴定出13个TLRs,TLR2是其中重要的一员,也被称为CD282。作为一种膜表面受体,TLR2可识别许多细菌、真菌、病毒和某些内源性物质。TLR2在MTB感染期间过度表达,MTB中的脂甘露聚糖(lipomannan)等成分可作为TLR2的激动剂[15]。致病相关分子可与TLRs和MyD88的toll-白细胞介素1受体(toll-interleukin 1 receptor, TIR)结构域结合。MyD88是一种通用衔接蛋白,几乎所有TLRs(TLR3除外)都用其激活核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB)。这种相互作用激活IRAK-1、肿瘤坏死因子α相关因子(tumor necrosis factor α-related factor,TRAF)和干扰素β(interferon β, IFN-β)诱导的TIR携带分子(TIR-carrying molecule, TIRAK),并向细胞核传递TLR的激活信号[16]。TNF-α和IL-1水平升高后在细胞核中启动对MTB的免疫反应[17]。
相对的,MTB也演化出多种自我保护策略,以破坏这些宿主免疫应答,达到在宿主内长期存活的目的。MTB逃避机体免疫的机制主要有融合吞噬溶酶体和产生有毒的活性氮中间体等[18]。MTB免疫逃逸的另一种策略是在其蛋白质中加入与宿主中不同蛋白质结构域相似的结构域。MyD88介导先天免疫中许多重要的信号转导途径。MyD88不仅在产生炎症反应方面发挥着关键作用,而且在诱导调节信号以防止肺部过度炎症和细胞损伤方面发挥着关键作用。许多参与吞噬后续过程的基因都依赖于MyD88。除了在吞噬作用中发挥核心作用外,MyD88对人类单核细胞和小鼠巨噬细胞吞噬体中细菌降解后发生的下游TLR激活和信号传导至关重要。细菌被吞噬后,在吞噬体的酸性环境中被激活的宿主酶和内体TLR受体可以识别其细菌配体。一旦这些细菌衍生配体在内化和降解后被释放,即可从吞噬体启动TLR依赖性反应[16]。MTB中的Rv3529c蛋白与MyD88的死亡结构域显著相似。用Rv3529c孵育巨噬细胞可特异性抑制TLR2介导的促炎症反应,用Rv3529c蛋白培养巨噬细胞可增加巨噬细胞内的细菌负荷[4]。因此,针对Rv3529c蛋白进行研究可进一步了解MTB与TLRs及其相关通路的致病机制。
经生物信息学预测分析后,由MTB Rv3529c基因合成的蛋白分子式为C1930H2959N547O569S13,分子量大小为43 345.83;二级结构以α-螺旋为主,β-折叠占比较低;理论等电点为6.04,连接pET-32a质粒后表达的蛋白分子量有所增加,理论等电点略有增大,对蛋白质的上清表达会产生一定影响;氨基酸总数为384个,丙氨酸、亮氨酸占比较高,同时含有一定量的半胱氨酸,半胱氨酸可影响蛋白质在水溶液中的消光系数。经生信软件预测可知Rv3529c蛋白的脂肪族氨基酸指数较高,不稳定指数较低,可在大肠埃希菌体内长期存在,说明该蛋白稳定性和热稳定性均较高,适合原核表达后长期保存。预测该蛋白的总平均亲水性为-0.388,推测该蛋白为可溶性表达,但实际表达后主要为不溶性形式的蛋白,其原因可能是虽然蛋白总平均亲水性较高,但连接pET-32a质粒后总蛋白亲水性发生改变,后续试验考虑对原核表达后的蛋白进行复性或改变条件,从而诱导蛋白在上清中表达。生信分析可知Rv3529c蛋白无信号肽且非跨膜蛋白。原核表达前需用双酶切验证重组质粒的构建,确保正确表达蛋白,经大量诱导活化后破碎细菌,提取蛋白,将蛋白上样处理后进行SDS-PAGE电泳并做WB验证,确定提取出目的蛋白。多序列比对显示,Rv3529c蛋白与嗜血分枝杆菌等菌种中表达的蛋白有较高的同源性,与鸟分枝杆菌中表达的蛋白可能有共同起源。抗原抗体表位分析结果显示,Rv3529c蛋白有11组B细胞抗体表位,其中127-145、348-377是该蛋白优势表位,预测分析后返回6组高识别度T细胞免疫原性位点。蛋白互作分析结果显示,Rv3529c蛋白与MTB中分泌的多个蛋白有相互作用,预测其相互作用多为基因共现(gene co-occurrence),其中kshA、hsaA、hsaC等蛋白主要参与胆固醇的降解,胆固醇代谢可帮助处于感染早期阶段的细菌繁殖和播散,有助于MTB在宿主中的存活;kstR蛋白则控制利用各种脂质作为能源的基因的表达;综上所述,推测Rv3529c蛋白可参与细胞内及细胞间的氧化还原代谢反应,抑制细胞凋亡,帮助MTB免疫逃逸。
本研究对MTB中Rv3529c基因编码的蛋白进行了多维的生物信息学分析,成功构建了Rv3529c蛋白的原核表达载体,并检测了Rv3529c蛋白的表达特性。生物信息学对蛋白进行分析得出的结论为理论结果,本研究对Rv3529c蛋白的理化性质仅进行初步的预测和分析,蛋白性状在细菌体内进行折叠、磷酸化等过程后会出现一些不可预知的变化。因此,仍有必要运用高端仪器对蛋白进行多方面试验。本研究结果显示,Rv3529c蛋白在离心后的细菌裂解液中主要以沉淀形式存在,说明该蛋白在原核表达过程中易形成包涵体,所以优先考虑从沉淀中纯化该蛋白。从沉淀中纯化的操作步骤相对繁琐,需保持蛋白的活性,为进一步试验做好准备。Rv3529c蛋白是MTB中的重要蛋白,对其作用机体的机制尚不完全明确,深入研究Rv3529c蛋白的免疫学特性及结构功能特征,可为MTB的靶向治疗提供新思路。本研究可为进一步研究Rv3529c蛋白的结构、功能、理化性质明确方向,也可为进一步揭示MTB的致病机制提供参考。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
World Health Organization. Global tuberculosis report 2020[EB/OL]. (2020-10-15)[2022-11-10]. https://www.who.int/publications/i/item/9789240013131.
|
| [2] |
Victoria S, Temerozo JR, Gobbo L, et al. Activation of toll-like receptor 2 increases macrophage resistance to HIV-1 infection[J]. Immunobiology, 2013, 218(12): 1529-1536. DOI:10.1016/j.imbio.2013.06.006 |
| [3] |
Underhill DM, Ozinsky A, Smith KD, et al. Toll-like receptor-2 mediates mycobacteria-induced proinflammatory signaling in macrophages[J]. Proc Natl Acad Sci U S A, 1999, 96(25): 14459-14463. DOI:10.1073/pnas.96.25.14459 |
| [4] |
Bandyopadhyay U, Chadha A, Gupta P, et al. Suppression of toll-like receptor 2-mediated proinflammatory responses by Mycobacterium tuberculosis protein Rv3529c[J]. J Leukoc Biol, 2017, 102(5): 1249-1259. DOI:10.1189/jlb.4A0217-042R |
| [5] |
Rost B, Sander C. Prediction of protein secondary structure at better than 70% accuracy[J]. J Mol Biol, 1993, 232(2): 584-599. DOI:10.1006/jmbi.1993.1413 |
| [6] |
Jumper J, Evans R, Pritzel A, et al. Highly accurate protein structure prediction with AlphaFold[J]. Nature, 2021, 596(7873): 583-589. DOI:10.1038/s41586-021-03819-2 |
| [7] |
Waterhouse A, Bertoni M, Bienert S, et al. SWISS -MODEL: homology modelling of protein structures and complexes[J]. Nucleic Acids Res, 2018, 46(W1): W296-W303. DOI:10.1093/nar/gky427 |
| [8] |
Wilkins MR, Gasteiger E, Bairoch A, et al. Protein identification and analysis tools in the ExPASy server[J]. Methods Mol Biol, 1999, 112: 531-552. |
| [9] |
Almagro Armenteros JJ, Tsirigos KD, Sønderby CK, et al. SignalP 5. 0 improves signal peptide predictions using deep neural networks[J]. Nat Biotechnol, 2019, 37(4): 420-423. DOI:10.1038/s41587-019-0036-z |
| [10] |
Dhanda SK, Karosiene E, Edwards L, et al. Predicting HLA CD4 immunogenicity in human populations[J]. Front Immunol, 2018, 9: 1369. DOI:10.3389/fimmu.2018.01369 |
| [11] |
Jespersen MC, Peters B, Nielsen M, et al. BepiPred-2.0: improving sequence -based B-cell epitope prediction using conformational epitopes[J]. Nucleic Acids Res, 2017, 45(W1): W24-W29. DOI:10.1093/nar/gkx346 |
| [12] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47(D1): D607-D613. DOI:10.1093/nar/gky1131 |
| [13] |
Weiss G, Schaible UE. Macrophage defense mechanisms against intracellular bacteria[J]. Immunol Rev, 2015, 264(1): 182-203. DOI:10.1111/imr.12266 |
| [14] |
Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on toll-like receptors[J]. Nat Immunol, 2010, 11(5): 373-384. DOI:10.1038/ni.1863 |
| [15] |
Shukla S, Richardson ET, Drage MG, et al. Mycobacterium tuberculosis lipoprotein and lipoglycan binding to toll-like receptor 2 correlates with agonist activity and functional outcomes[J]. Infect Immun, 2018, 86(10): e00450-18. |
| [16] |
Cervantes JL. MYD88 in Mycobacterium tuberculosis infection[J]. Med Microbiol Immunol, 2017, 206(3): 187-193. DOI:10.1007/s00430-017-0495-0 |
| [17] |
Biyikli OO, Baysak A, Ece G, et al. Role of toll-like receptors in tuberculosis infection[J]. Jundishapur J Microbiol, 2016, 9(10): e20224. |
| [18] |
Madan-Lala R, Peixoto KV, Re F, et al. Mycobacterium tuberculosis Hip1 dampens macrophage proinflammatory responses by limiting toll-like receptor 2 activation[J]. Infect Immun, 2011, 79(12): 4828-4838. DOI:10.1128/IAI.05574-11 |



