2. 广东省第二人民医院检验医学科,广东 广州 510310
2. Department of Laboratory Medicine, Guangdong Second Provincial General Hospital, Guangzhou 510310, China
抗菌药物在预防和治疗感染性疾病中发挥着不可替代的作用,但不合理地使用抗菌药物也可导致细菌产生耐药性[1],2019年某院抗菌药物使用强度为48.28,高于国家标准。2018年国家公立医院绩效考核结果,该院抗菌药物使用强度得分率仅为50%。合理使用抗菌药物,降低抗菌药物使用强度,是该院合理用药管理现阶段最迫切的任务。而从临床应用角度来看,依据微生物培养与药敏结果拟定抗感染治疗方案,可提高临床疗效,防止抗菌药物滥用,遏制细菌耐药[2]。因此,该院期望通过加强多学科协作模式,提高血培养阳性率,进一步降低抗菌药物使用强度。
1 对象与方法 1.1 研究对象选取2020年1—12月感染管理重点内科送检血培养的患者为研究对象,分析其血培养送检及抗菌药物使用情况。2020年1—6月为对照组,7—12月为干预组。选取的感染管理重点内科包括:重症医学科、血液科、感染科、呼吸与危重症医学科、神经内科。
1.2 干预措施 1.2.1 成立多部门协作管理小组,完善相关工作制度2020年7月成立多部门协作管理小组,由业务主管副院长领导,成立专家组及质控小组。专家组由感染管理重点内科科室,医务部下属的医院感染管理科、医疗科、质量管理科,及护理部、药学部、检验医学部等专家组成;质控小组由相关管理科室包括信息科、配送中心的业务骨干及参与研究的临床科室质控医生组成。
1.2.2 开展针对性培训,规范各环节流程组织项目质控组人员进行培训,使每位成员了解项目意义、工作职责和要求;组织临床科室、输送中心相关人员进行临床微生物标本的规范采集及运送的相关知识培训,规范微生物标本采集、贮存、运送等。
1.2.3 加强血培养质控,强化信息反馈与沟通(1) 监督检查。对每个科室每月抽取上月开具了血培养医嘱的病历10份,由项目质控组成员按照分工,每月中旬对质控指标进行收集、统计和分析。每月对微生物实验室的标本接收、保存、接种等操作进行质量检查。每月对临床科室接到血培养报阳危急值的处理情况进行质量检查。每月对输送中心的标本输送工作进行质量检查。每月对科室提交的血培养标本采集操作视频进行质量检查;临床科室感控督导员负责对本科室血培养标本采集过程进行拍摄,每月至少提交2个标本采集视频,于次月5日前由医院感染管理科人员评价。(2)分析反馈。质控组每月召开例会,分析上个月各项质控指标和检查发现的问题,提出解决方案,督促责任科室、个人落实整改。专家组每季度召开1次工作会议,通报各项质控指标质量持续改进情况,研究解决存在的问题。
1.2.4 强化监督考核,将血培养指标纳入绩效管理对科室的参与积极性、资料提交及时性、质量改进有效性等进行评分,评出临床组及非临床组优秀科室,给予相关奖励。
1.3 评价方法 1.3.1 质控指标根据血培养标准流程选取10个质控指标,每个质控指标指定负责质控的科室,并制定相应的质控目标。
1.3.2 指标释义和质控目标(1) 血培养标本平均送检时间=血培养标本送检总时间÷同期血培养标本数,质控目标<30 min;标本送检时间=标本送达检验医学部时间-临床科室电话通知输送中心时间。(2)血培养标本平均上机时间=标本总上机时间÷标本总数,质控目标≤20 min。标本上机时间=上机开始时间-接收时间。(3)血培养结果平均报告临床科室时间=报告总时间÷阳性报告例次数,质控目标≤1 h。报告时间=检验科致电时间-机器报阳时间。(4)血培养阳性率=血培养阳性瓶数÷血培养送检总瓶数×100%,质控目标为年度同期有上升。(5)血培养平均采集套数=血培养送检标本总数÷血培养送检人次÷2,质控目标为成人2~3套。(6)血培养标本污染率=污染的血培养标本数÷同期血培养标本总数×100%,质控目标<3%。根据《临床微生物实验室血培养操作规范》WS/T 503—2017,存在以下情况时判定为污染标本:血培养瓶中培养出皮肤(如表皮葡萄球菌、痤疮丙酸杆菌、梭菌、类白喉棒状杆菌)或周围环境(如不动杆菌属、芽孢杆菌属)中常见菌。这些菌大部分为污染菌,但出现以下情况考虑可能为致病菌:①不同部位血培养标本培养出同一种菌;②多次分离出同一种菌,且药敏结果相同。血培养中两种或两种以上细菌生长,可能是复数菌菌血症,如厌氧菌菌血症时可能有多种病原菌感染;也可能是污染所致。(7)血培养标本不合格率=血培养不合格标本数÷同期血培养标本总数×100%,质控目标<5%。根据《临床微生物学检验标本的采集和转运》WS/T 640—2018中“4.9标本拒收”进行判定。不合格标本情况包括:标本标记错误或无患者姓名的标本;标本类型和申请检验项目不符的标本;容器破损的标本,容器表面严重污染的标本,使用不符合专业规范容器采集的标本;质量评估不合格的标本,合格的标本需满足相应的质量判断方法;采集部位、转运容器以及转运条件不符合要求,宜重新采集标本,标本采集、转运条件和转运时间,可接受的标准详见WS/T 640—2018中的表 3。(8)血培养采集方法正确率,质控目标100%。根据WS/T 503—2017中“3.6采集方法”对科室提交的视频进行判定。步骤为:采集静脉血(仅在评估导管相关血流感染时采集导管血);采集前做好手卫生,静脉穿刺点选定后,去除血培养瓶的塑料瓶帽,切勿打开金属封口环和胶塞,使用75%乙醇或70%异丙醇消毒,自然干燥60 s。注意采血前检查血培养瓶是否完好无损、是否过期;在穿刺前或穿刺期间,为防止静脉滑动,应戴无菌乳胶手套固定静脉;穿刺点皮肤消毒详见WS/T 503—2017;用注射器无菌穿刺取血后,勿更换针头(如行第二次穿刺,更换针头),直接注入血培养瓶,不应将抗凝血注入血培养瓶;血液接种到培养瓶后,轻轻颠倒混匀以防血液凝固;完成工作后洗手。(9)血培养标本采集时机正确率,质控目标100%。用于血培养的标本应在寒战或发热初起时或在抗菌药物使用前采集。(10)血培养报阳临床科室处理正确率=正确处理次数÷总次数×100%。符合以下2条标准为处理正确:①医护人员接听危急值电话记录规范;②医生结合患者病情判断血培养结果准确性,并在病程中规范记录(6 h内),质控目标100%。
1.4 统计分析应用SPSS 20.0软件进行数据分析,率及构成比的比较采用χ2检验,P≤0.05为差异具有统计学意义。
2 结果 2.1 血培养送检总体情况2020年1—12月重点科室送检血培养标本16 246瓶,其中对照组7 512瓶,干预组8 734瓶。科室干预前后送检血培养标本情况见表 1。
| 表 1 重点科室干预前后送检血培养标本情况(瓶) Table 1 Status of blood culture specimens delivered by key departments before and after intervention (No. of specimens) |
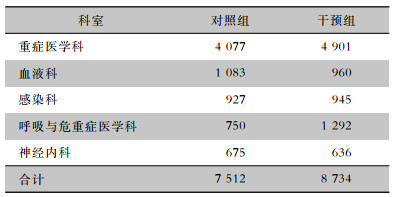
|
对照组送检血培养7 512瓶,2 626人次,血培养平均采集1.43套,2套及以上共395人次(占15.04%),单套和单瓶2 231人次(占84.96%)。干预组送检血培养8 734瓶,2 136人次,平均采集2.04套,2套及以上共532人次(占24.91%),单套和单瓶1 604人次(占75.09%)。干预组平均血培养采集套数达到质控目标。干预组2套及以上送检比例高于对照组,差异有统计学意义(χ2=73.12,P<0.001)。见表 2。
| 表 2 干预前后血培养采集方式构成情况 Table 2 Composition of blood culture collection modes before and after intervention |

|
干预组血培养平均送检时间、平均上机时间、报阳结果平均报告临床科室时间均下降。干预组平均送检时间18.56 min,达到质控目标(<30 min),平均上机时间18.83 min,达到质控目标(≤20 min),报阳结果平均报告临床科室时间148.28 min,未达到质控目标(≤1 h)。干预组的平均送检时间、上机时间、报阳结果报告临床科室时间的达标率均高于对照组,差异均有统计学意义(均P<0.001)。见表 3。
| 表 3 干预前后血培养送检时间及报阳结果处理时间情况 Table 3 Blood culture delivering time and positive results processing time before and after the intervention |
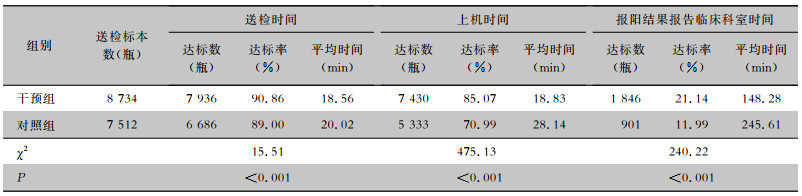
|
每月抽取参与科室10份开具血培养医嘱的病历,共300份,由项目质控组成员对质控指标(血培养采集方法、时机、报阳临床科室处理情况)进行统计。干预组血培养采集时机正确率(98.33% VS 74.67%)、采集方法正确率(82.67% VS 67.67%)、报阳临床科室处理正确率(70.67% VS 62.00%)均较对照组高,差异均有统计学意义(均P<0.05)。见表 4。
| 表 4 干预前后血培养不同采集方式及报阳科室处理情况比较 Table 4 Comparison of different blood culture collection methods and the processing of departments with positive blood culture before and after intervention |
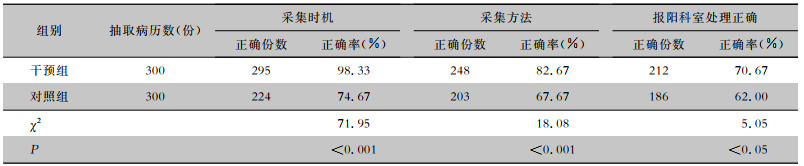
|
干预组血培养阳性率较对照组高(9.43% VS 6.56%);污染率较对照组低(0.77% VS 1.28%);不合格率较对照组低(1.19% VS 2.18%);差异均有统计学意义(均P<0.05)。见表 5。
| 表 5 干预前后血培养阳性、标本污染及不合格情况 Table 5 Positive blood culture, contamination and unqualified conditions of specimens before and after intervention |
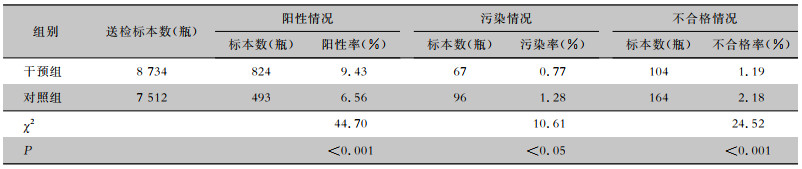
|
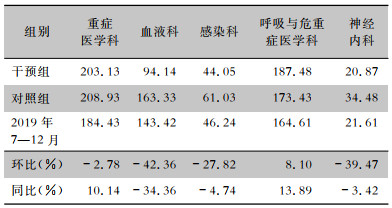
干预组参与科室的抗菌药物使用强度均下降,环比增长率分别为重症医学科(-2.78%)、血液科(-42.36%)、感染科(-27.82%)、呼吸与危重症医学科(8.10%)和神经内科(-39.47%);同比增长率分别为重症医学科(10.14%)、血液科(-34.36%)、感染科(-4.74%)、呼吸与危重症医学科(13.89%)和神经内科(-3.42%)。见表 6。
| 表 6 干预前后抗菌药物使用强度情况 Table 6 Antimicrobial use intensity before and after intervention |
|
病原微生物的药敏结果,是抗菌药物合理应用的重要保障,对感染性疾病的诊治及降低抗菌药物使用强度具有重要意义[3]。血培养是最有价值的细菌学检测项目之一,对脓毒血症、感染性心内膜炎、导管相关血流感染等疾病的诊断有重要的临床意义[4-5]。本研究显示干预组血培养送检份数总体上有所提高,2套及以上血培养采集方式所占比率(24.91%)较对照组(15.04%)升高。研究[6]表明血培养采集套数为2套或3套时,检测灵敏度分别为93.9%、96.9%,有利于提高血培养阳性率[7],具有较高的病原菌检出率和临床鉴别污染的价值,因而美国临床实验室标准化协会(CLSI)推荐2套或3套采集方式[8-9]。培养阳性危急值报告是临床尽快使用抗菌药物进行目标性治疗的重要参考,优化、缩短阳性报告时间,使临床能够更加及时、合理地调整抗感染治疗方案,为降低患者医疗费用,延缓细菌耐药性的发生、发展,保证患者的生命安全提供保障[10-11]。本研究中干预组平均送检时间和平均上机时间达到质控目标,而报阳结果平均报告临床科室时间虽有缩短,但未达到质控目标,提示下一步应采取有效措施,优化、缩短阳性结果报告临床时间,同时也应根据科室自身特点设定符合科室的目标值。
对照组采集流程中常见的问题主要包括:未规范手卫生;皮肤和采血瓶盖消毒待干时间不够;1根棉签消毒2个采血瓶盖;采血针提前去针帽,碰触到床单造成污染;治疗盘放置过低,跨过无菌区操作;污染压脉带放治疗盘内,未一步到位放入回收桶里。通过加强医院、科室两级培训和考核[12-13],建立统一的血培养采集流程,管理部门对科室提交的采集流程视频进行“找茬”,不断监督反馈,从而提高护士对血培养规范采集知识的掌握程度,提升血培养采集行为依从性[14-15]。干预组血培养采集方法正确率、采集时机正确率、报阳临床科室处理正确率分别为82.67%、98.33%、70.67%,高于对照组的67.67%、74.67%、62.00%,差异均有统计学意义(均P<0.05)。
CLSI指出血培养污染率应控制在可接受的范围(≤3%),本研究血培养标本干预前后污染率均<3%,均在可接受范围内。干预前本院采血针后端塑胶拔除后,易碰触周围环境及物品,造成污染,干预后及时更换成带安全针帽的采血针,有针帽保护,不易污染[16]。干预组污染率和不合格率均较对照组降低,且干预组血培养阳性率提高至9.43%。干预组重症医学科、血液科、感染科、神经内科的抗菌药物使用强度下降,而呼吸与危重症医学科上升。提示大部分科室医务人员认识到血培养的意义,能根据药敏结果合理选择抗菌药物,减少无指征使用抗菌药物,从而降低抗菌药物使用强度。
综上所述,通过多部门协作,开展针对性的培训,规范各环节流程,加强血培养质控,强化信息反馈和沟通,强化监督考核,可提高科室参与积极性、资料提交及时性、质量改进有效性。本研究仅在部分重点科室进行,未涉及全院所有科室,研究结果无法全面反映医院的状况,后续研究有待进一步扩大研究对象,以提高研究结果的广泛适用性。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
袁磊, 黄耿文, 黄勋, 等. 中南大学湘雅医院抗菌药物科学化管理的实践与评价[J]. 中国感染控制杂志, 2021, 20(12): 1133-1138. Yuan L, Huang GW, Huang X, et al. Practice and evaluation of antimicrobial stewardship in Xiangya Hospital of Central South University[J]. Chinese Journal of Infection Control, 2021, 20(12): 1133-1138. DOI:10.12138/j.issn.1671-9638.20211591 |
| [2] |
刘善善, 李家树, 史家欣, 等. 综合干预对病原微生物标本送检的临床效果评价[J]. 中国感染控制杂志, 2018, 17(2): 160-164. Liu SS, Li JS, Shi JX, et al. Clinical effect of comprehensive intervention on submission rates of microbiological specimens[J]. Chinese Journal of Infection Control, 2018, 17(2): 160-164. DOI:10.3969/j.issn.1671-9638.2018.02.015 |
| [3] |
郭玲玲, 陈韵, 吴晓英. 应用综合干预措施提高临床微生物标本送检质量[J]. 中国感染控制杂志, 2022, 21(1): 80-85. Guo LL, Chen Y, Wu XY. Application of comprehensive intervention measures to improve the sub-mission quality of cli-nical microbial specimens[J]. Chinese Journal of Infection Control, 2022, 21(1): 80-85. |
| [4] |
周梦兰, 杨启文, 于淑颖, 等. 血流感染流行病学研究进展[J]. 中国感染与化疗杂志, 2019, 19(2): 212-217. Zhou ML, Yang QW, Yu SY, et al. Updates on the epidemio-logy of bloodstream infection[J]. Chinese Journal of Infection and Chemotherapy, 2019, 19(2): 212-217. |
| [5] |
Lamy B, Sundqvist M, Idelevich EA, et al. Bloodstream infections-standard and progress in pathogen diagnostics[J]. Clin Microbiol Infect, 2020, 26(2): 142-150. DOI:10.1016/j.cmi.2019.11.017 |
| [6] |
Lee A, Mirrett S, Reller LB, et al. Detection of bloodstream infections in adults: how many blood cultures are needed?[J]. J Clin Microbiol, 2007, 45(11): 3546-3548. DOI:10.1128/JCM.01555-07 |
| [7] |
向宇培, 古丽, 许迅, 等. 采集部位及送检模式对提高血培养阳性率的分析[J]. 检验医学与临床, 2022, 19(17): 2402-2404. Xiang YP, Gu L, Xu X, et al. Analysis of collection site and inspection mode on increasing the positive rate of blood culture[J]. Laboratory Medicine and Clinic, 2022, 19(17): 2402-2404. DOI:10.3969/j.issn.1672-9455.2022.17.025 |
| [8] |
王亚, 阮燕萍. 血培养双侧双瓶送检的持续质量改进[J]. 中华医院感染学杂志, 2017, 27(1): 79-81. Wang Y, Ruan YP. Continuous quality improvement of submission of bilateral double bottles for blood culture[J]. Chinese Journal of Nosocomiology, 2017, 27(1): 79-81. |
| [9] |
Shin CH, Lim C, Kim TS, et al. Effective and rapid microbial identification in pediatric osteoarticular infections using blood culture bottles[J]. J Bone Joint Surg Am, 2020, 102(20): 1792-1798. DOI:10.2106/JBJS.20.00219 |
| [10] |
梁馨月, 孟涵, 王启, 等. 优化血培养检测流程的效果评价研究[J]. 中华检验医学杂志, 2022, 45(2): 137-144. Liang XY, Meng H, Wang Q, et al. Effect evaluation of optimizing blood culture testing process[J]. Chinese Journal of Laboratory Medicine, 2022, 45(2): 137-144. DOI:10.3760/cma.j.cn114452-20211103-00683 |
| [11] |
段京京, 宁永忠, 赵雪, 等. 血培养阳性报警时间的临床应用[J]. 中华检验医学杂志, 2015, 38(1): 67-69. Duan JJ, Ning YZ, Zhao X, et al. The application of time to positivity in blood culture[J]. Chinese Journal of Laboratory Medicine, 2015, 38(1): 67-69. DOI:10.3760/cma.j.issn.1009-9158.2015.01.018 |
| [12] |
Foggiato GF, Tuon FF, Becker G, et al. Reduction of blood culture contamination rates after implementation of a phlebotomist team[J]. Am J Infect Control, 2017, 45(6): 698-699. |
| [13] |
Nair A, Elliott SP, Al Mohajer M. Knowledge, attitude, and practice of blood culture contamination: a multicenter study[J]. Am J Infect Control, 2017, 45(5): 547-548. |
| [14] |
赵红亮, 朱孟菊, 曾莎莎. 监护室护士血培养规范的采集知识及行为[J]. 国际护理学杂志, 2022, 41(20): 3677-3681. Zhao HL, Zhu MJ, Zeng SS. Knowledge and behavior of nurses in intensive care unit collecting standard blood culture[J]. International Journal of Nursing, 2022, 41(20): 3677-3681. |
| [15] |
Doern GV, Carroll KC, Diekema DJ, et al. Practical guidance for clinical microbiology laboratories: a comprehensive update on the problem of blood culture contamination and a discussion of methods for addressing the problem[J]. Clin Microbiol Rev, 2019, 33(1): e00009-19. |
| [16] |
周根秀, 黄小红. 真空采血管管帽在血气分析标本采集中的应用[J]. 临床肺科杂志, 2010, 15(6): 796. Zhou GX, Huang XH. Application of vacuum blood collection tube cap in sample collection for blood gas analysis[J]. Journal of Clinical Pulmonary Medicine, 2010, 15(6): 796. |



