2. 武汉大学公共卫生学院,湖北 武汉 430061
2. School of Public Health, Wuhan University, Wuhan 430061, China
非结核分枝杆菌(non-tuberculous mycobacterium, NTM)是指除结核分枝杆菌(Mycobacterium tuberculosis, MTB)复合群(MTB、牛分枝杆菌等)及麻风分枝杆菌以外的一类分枝杆菌。NTM致病性及传染性都不及MTB,因此,很长一段时间都未引起临床及科研工作者的关注。随着社会老龄化,后天免疫系统疾病如获得性免疫缺陷综合征(AIDS)患者,以及先天免疫功能缺陷人群的增加,NTM感染患者逐年增加,临床症状也呈现出多样性,如肺部脓肿,皮肤软组织感染、淋巴结炎等[1-3]。NTM与MTB感染的临床症状及影像学表现高度相似,且NTM对大多数抗结核药物天然耐药[4-6],给临床诊治工作带来极大困难。快速准确地诊断NTM感染,对临床医生规范化、针对性地用药和治疗具有重要意义。
目前实验室鉴定分枝杆菌的主要方法有分离培养鉴定法(PNB法)、DNA测序及PCR反向点杂交法。荧光PCR熔解曲线法鉴定分枝杆菌是根据分枝杆菌18sRNA-23sRNA基因内转录间隔区(ITS)片段的特异序列设计探针,采用特定的荧光通道和熔点进行分枝杆菌的鉴定,能同时鉴定出包括MTB复合群在内的19种分枝杆菌,整个试验过程仅需5~6 h。目前,已有荧光PCR熔解曲线法用于MTB的鉴定和利福平、异烟肼的耐药检测,利福平耐药检测灵敏度为100%,特异度为97.10%,异烟肼耐药检测灵敏度为76.00%,特异度为99.19%[7-8]。本文利用多色荧光PCR熔解曲线法鉴定分枝杆菌菌种,以全基因组测序(WGS)为金标准分析其准确性,同时总结宜昌地区NTM感染的临床特征。
1 资料与方法 1.1 标本来源及资料收集收集宜昌市某结核病定点治疗医院有结核病疑似症状患者的临床标本,包括胸腔积液、腹腔积液、痰、支气管肺泡灌洗液标本,采用抗酸染色、改良罗氏培养管及MGIT 960系统进行分枝杆菌培养鉴定,所有阳性标本采用荧光PCR熔解曲线法鉴别NTM至菌种。收集2016年1月1日—2020年12月31日期间该院门诊及住院疑似结核患者的临床检测数据,分析NTM感染情况,同时收集NTM感染患者临床资料,包括性别、年龄、初治复治、合并其他疾病等信息,分析其特征。
1.2 磁珠法提取核酸痰、支气管肺泡灌洗液、胸腔积液、腹腔积液等标本离心吸取沉淀,加入2倍体积消化液,消化15 min至标本完全液化后吸取1 mL转移至1.5 mL EP管中。快速培养标本直接吸取培养液1 mL加入1.5 mL EP管中,12 000 r/min离心5 min,弃上清,重悬于300 μL裂解液中。改良罗氏培养基上生长的分枝杆菌用22SWG标准接种环收集细菌一环,重悬于300 μL裂解液中。99℃加热10 min后静置。将灭活好的标本加入提取试剂条样本孔,安装好磁棒,打开Lab-Aid 824s核酸提取仪,运行结核核酸提取程序“MTB-Maxi-Fast”获取纯化的DNA,转移至干净EP管备用。
1.3 荧光PCR熔解曲线法鉴定分枝杆菌至菌种分枝杆菌鉴定试剂盒(荧光PCR熔解曲线法)购自厦门致善生物科技股份有限公司,反应体系及PCR扩增程序严格按照说明书操作。扩增仪使用全自动医用PCR分析系统Slan-96S real-time PCR system(上海宏石医疗科技有限公司)。反应完成后,用仪器自带分析软件MeltPro Manager version 1.0(致善科技有限公司)对扩增及熔解曲线进行比对分析。
根据不同分枝杆菌ITS片段的特异序列设计探针[9],采用特定的荧光通道和熔点鉴定分枝杆菌,同时在扩增体系中加入外源性内控模板(拟南芥管家基因suc2)进行质量控制。
1.4 WGS分析部分培养阳性的分枝杆菌经80℃ 30 min水浴灭活后,利用十六烷基三甲基溴化铵(CTAB)提取法提取菌株DNA,根据WGS建库试剂盒说明书,建立DNA双端测序文库,在Illumina Hiseq 2500平台上进行WGS。测序下机数据上传至SAM-TB平台(https://samtb.szmbzx.com/)分析,鉴定菌种,并与荧光PCR熔解曲线法鉴定结果对比。
1.5 临床肺结核病及NTM肺病的入组标准肺结核符合中华医学会发布的《肺结核基层诊疗指南(2018年)》[10]标准。NTM肺病诊断符合《非结核分枝杆菌病诊断与治疗指南(2020年版)》[11]诊断标准,经分枝杆菌培养及菌种鉴定后,结合患者临床表现、实验室和病理检查结果,并在排除其他病因的情况下进行诊断。所有病例均排除临床资料不全、并发严重精神疾病及认知功能障碍、住院期间因其他系统疾病导致病情恶化或死亡者。
1.6 统计分析方法应用Excel 2016软件整理试验数据及患者信息,SPSS 24.0软件对NTM感染者的信息进行描述性分析。采用非参数检验分析不同特征患者感染的NTM菌种的分布特征,卡方检验比较感染MTB与NTM患者特征。P≤0.05为差异有统计学意义。
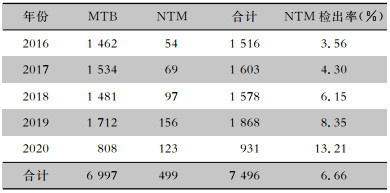
2 结果 2.1 基本检测情况2016—2020年,共7 496份疑似结核病患者的临床标本分枝杆菌培养阳性,进一步进行NTM鉴别,共检出6 997株MTB与499株NTM,NTM总检出率为6.66%。
研究期间,NTM检出率逐年上升,从2016年的3.56%(54/1 516)上升至2020年的13.21%(123/931),见表 1。Cochran-Armitage趋势检验提示上升趋势显著(Z=8.267, P<0.001)。2020年标本数大幅下降,可能与新型冠状病毒疫情期间患者就诊减少有关。
| 表 1 2016—2020年宜昌地区分枝杆菌检出情况 Table 1 Detection results of Mycobacterium in Yichang area from 2016 to 2020 |
|
利用荧光PCR熔解曲线法对以上499株初步鉴定为NTM菌株进行菌种鉴定,共鉴定出469株(93.99%)常见NTM菌种,30株(6.01%)报告为其他未知NTM菌种,超出该方法检测范围。胞内、脓肿分枝杆菌是该地区最流行的NTM菌种,分别占NTM标本中的37.88%(189株)、13.63%(68株),其余常见NTM菌种依次为戈登(25株, 5.01%)、偶然(24株, 4.81%)、堪萨斯(16株, 3.21%)、鸟(9株, 1.80%)、缓黄(7株, 1.40%)、龟(6株, 1.20%)、瘰疠(3株, 0.60%)、耻垢分枝杆菌(2株, 0.40%),土、海、蟾蜍、苏加、马尔摩、猿分枝杆菌均为1株(各占0.20%)。
2.3 WGS验证荧光PCR熔解曲线法鉴定分枝杆菌效能选择荧光PCR熔解曲线法鉴定的MTB菌株22株及NTM菌株18株行WGS,以验证两种方法鉴定分枝杆菌菌种符合情况。结果显示,两种方法鉴别MTB与NTM的符合率为98.15%,灵敏度为99.80%,特异度为93.45%。其中,WGS检测18株NTM菌种包括9株脓肿分枝杆菌、3株鸟分枝杆菌复合群、3株堪萨斯分枝杆菌、1株偶然分枝杆菌、1株马尔摩分枝杆菌、1株未知菌种,与荧光PCR熔解曲线法检测结果基本一致。
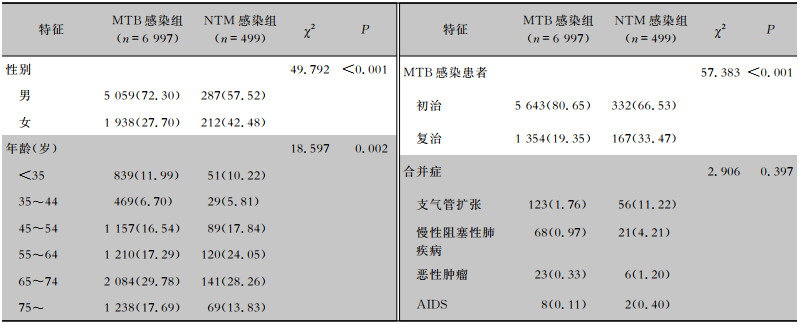
2.4 MTB与NTM感染患者特征比较对诊断的6 997例MTB感染患者及499例NTM感染患者的临床资料进行对比分析,发现宜昌地区MTB和NTM感染患者中,男性比例均高于女性(P<0.001)。对患病人群进行年龄分层,MTB与NTM感染患者均主要集中在65~74岁年龄组,其次为55~64岁及75~岁年龄组。分析患者年龄趋势发现,随年龄增大,MTB和NTM的感染风险也增大,各年龄组间比较,差异有统计学意义(P<0.05)。NTM感染患者中, 52.30%(261/499)的患者集中在55~74岁年龄段。比较MTB和NTM感染患者初治和复治比例发现,MTB感染患者中80.64%(5 633例)为初治,19.36%(1 352例)为复治;而NTM患者66.53%(332例)为初治,33.47%(167例)为复治。此外,NTM肺病合并疾病中支气管扩张最多(56例,11.22%),其次为慢性阻塞性肺疾病(21例,4.21%)、恶性肿瘤(6例,1.20%)和AIDS(2例,0.40%)。见表 2。
| 表 2 MTB与NTM感染患者特征比较[例,(%)] Table 2 Comparison of characteristics between MTB and NTM infected patients (No. of cases[%]) |
|
NTM肺病患者数量在全球范围内呈不断上升趋势, 其发病率在发达国家已超过肺结核, 在发展中国家亦呈明显上升趋势。发展中国家及落后国家因总体检测能力有限而对其了解不足[12],我国也缺乏流行病学大样本或全人群的研究[13-14]。根据某些省市的分析研究,NTM病在我国呈地域化分布,发病率南方高于北方,特别是广东沿海地区,发病率远高于西北地区;感染的菌种也呈地域化分布,南方多见胞内、堪萨斯、脓肿、溃疡、海分枝杆菌,北方多见胞内、鸟、脓肿等NTM菌种[15-16]。宜昌处于长江中下游温带季风气候地区,四季分明,夏季潮湿闷热,冬季干旱少雨,水资源丰富,为某些NTM菌(胞内、脓肿)提供了适宜的生长环境。近年来,随着分子生物学技术的发展,NTM菌种的鉴定在各地级市开展,本文采用荧光PCR熔解曲线法鉴定分枝杆菌菌种,以WGS为金标准,比较两种方法检测NTM菌种的符合率,分析荧光PCR熔解曲线法的灵敏度及特异度,并对该地区MTB及NTM菌种的临床感染特征进行分析。
针对我国NTM疾病的流行情况,Liu等[17]的研究显示,在分枝杆菌培养标本中,我国NTM分离率为6.4%(317/4 917);也有研究[18]表明,我国结核病可疑症状者中NTM分离率由2004—2009年的1.6%上升至2012—2017年的3.13%;2010年全国第五次结核病流行病学抽样调查[19]则报告NTM分离率为22.9%(83/363),远高于临床实验室的相关报道。宜昌地区NTM的分离率自2016年的3.56%(54/1 516)上升至2020年的13.21%(123/931),虽然低于2010年报道的22.9%,但也呈明显的上升趋势,公共卫生预防部门及临床医生在诊治分枝杆菌感染性疾病时应高度关注。
目前,我国针对NTM的早期、快速诊断尚没有敏感且特异的标准化诊断程序[20]。随着分子生物学技术的发展,NTM肺病的实验室检测技术也进一步发展,目前市面上的检测产品包括PCR熔解曲线法检测试剂盒、PCR荧光探针法检测试剂盒、微阵列基因芯片试剂盒、质谱法及16srRNA测序技术,各种检测方法的效能比较已有研究[21-22]。本研究结果显示,荧光PCR熔解曲线法作为最新的分子诊断手段,检测成本及所需时间远低于基因测序技术(成本昂贵、检测时间约3 d,需专业技术人员),灵敏度、特异度均>93%,值得临床推广应用。
本研究中,NTM肺病出现在各个年龄段, 以55~74岁年龄段老年人群占比最高(52.30%,261/499),与大部分研究[23-24]结果一致。本地区MTB和NTM感染患者的男女性别比例比较,差异有统计学意义(P<0.001)。不论是MTB还是NTM,男性感染者均高于女性,尤其是MTB,男性感染者远高于女性,其原因是否与男性吸烟、不健康的生活方式,以及社会压力等因素有关,还需进一步研究。
NTM肺病常发生于有慢性肺部疾病,如结核病、慢性阻塞性肺疾病、肺囊性纤维化等患者,以及免疫功能受损,如AIDS、恶性肿瘤和实体器官移植等患者[2]。本研究显示,NTM合并症中支气管扩张症最多见,该类患者由于气道受阻及结构异常,导致环境及空气中NTM长期滞留于肺部而诱发NTM肺病;肿瘤及AIDS患者自身免疫功能低下,也是NTM致病的重要原因之一。NTM患者复治比率为33.47%,提示NTM治疗迁延不愈易复发,与NTM生物学特征及耐药性有关,后期也将继续追踪患者治疗转归及药敏情况。
综上所述,肺部有支气管扩张改变,特别是合并肺气肿且长期进行治疗的免疫功能低下的老年患者,当抗酸染色阳性时,需高度怀疑NTM感染。我国一项多中心研究[25]表明, 胞内分枝杆菌是东部地区检出的主要NTM菌种,脓肿分枝杆菌在南部地区检出率高。本研究显示,宜昌地区检出的NTM以胞内分枝杆菌最多(37.88%),其次是脓肿分枝杆菌(13.63%),其余依次为戈登(5.01%)、偶然(4.81%)、堪萨斯(3.21%),与上海、广州不同[16, 26]。该地区的NTM分布特点可为宜昌市NTM的流行趋势研究提供参考,但未对检出的NTM进行药敏试验,缺乏随访和转归数据以评价患者的治疗效果,具有一定局限性,后期应考虑在既往研究的基础上进一步完善药敏试验和随访结果分析。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Sharma SK, Upadhyay V. Epidemiology, diagnosis & treatment of non-tuberculous mycobacterial diseases[J]. Indian J Med Res, 2020, 152(3): 185-226. DOI:10.4103/ijmr.IJMR_902_20 |
| [2] |
Pavlik I, Ulmann V, Hubelova D, et al. Nontuberculous Mycobacteria as sapronoses: a review[J]. Microorganisms, 2022, 10(7): 1345. DOI:10.3390/microorganisms10071345 |
| [3] |
Mencarini J, Cresci C, Simonetti MT, et al. Non-tuberculous Mycobacteria: epidemiological pattern in a reference laboratory and risk factors associated with pulmonary disease[J]. Epidemiol Infect, 2017, 145(3): 515-522. DOI:10.1017/S0950268816002521 |
| [4] |
Maya TG, Komba EV, Mensah GI, et al. Drug susceptibility profiles and factors associated with non-tuberculous Mycobacteria species circulating among patients diagnosed with pulmonary tuberculosis in Tanzania[J]. PLoS One, 2022, 17(3): e0265358. DOI:10.1371/journal.pone.0265358 |
| [5] |
周亚娣, 金法祥. 基质辅助激光解吸电离飞行时间质谱鉴定非结核分枝杆菌及药敏试验分析[J]. 中华全科医学, 2022, 20(9): 1548-1550. Zhou YD, Jin FX. Identification of nontuberculous Mycobacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry and analysis of drug-sensitivity test[J]. Chinese Journal of General Practice, 2022, 20(9): 1548-1550. |
| [6] |
朱春玲, 魏素梅, 侯远沛, 等. 徐州市92株非结核分枝杆菌菌种鉴定及药敏结果分析[J]. 实验与检验医学, 2021, 39(2): 278-280. Zhu CL, Wei SM, Hou YP, et al. Analysis of species identification and drug sensitivity results of 92 strains of nontuberculous Mycobacteria in Xuzhou[J]. Experimental and Laboratory Medicine, 2021, 39(2): 278-280. |
| [7] |
徐丽霞, 雷永良, 吴燕飞, 等. 荧光PCR熔解曲线法检测结核分枝杆菌耐药性价值及耐药特征分析[J]. 中国卫生检验杂志, 2022, 32(11): 1318-1321. Xu LX, Lei YL, Wu YF, et al. Value of fluorescence PCR fusion curve method in detection of Mycobacterium tuberculosis and analysis of its drug resistance and characteristics[J]. Chinese Journal of Health Laboratory Technology, 2022, 32(11): 1318-1321. |
| [8] |
刘春平, 谭耀驹, 苏碧仪, 等. 荧光PCR探针熔解曲线法检测结核分枝杆菌对利福平、异烟肼、喹诺酮及卡那霉素耐药性的评价[J]. 广东医学, 2021, 42(4): 377-381. Liu CP, Tan YJ, Su BY, et al. The value of fluorescent PCR probe melting curve analysis in detection of Mycobacterium tuberculosis for rifampicin, isoniazid, fluoroquinolone and kanamycin resistance[J]. Guangdong Medical Journal, 2021, 42(4): 377-381. |
| [9] |
Xu Y, Liang B, Du C, et al. Rapid identification of clinically relevant Mycobacterium species by multicolor melting curve analysis[J]. J Clin Microbiol, 2019, 57(1): e01096-18. |
| [10] |
中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 等. 肺结核基层诊疗指南(2018年)[J]. 中华全科医师杂志, 2019, 18(8): 709-717. Chinese Medical Association, Journal of Chinese Medical Association, General Practice Branch of Chinese Medical Association, et al. Guideline for primary care of pulmonary tuberculosis (2018)[J]. Chinese Journal of General Practitioners, 2019, 18(8): 709-717. |
| [11] |
刘盛盛, 唐神结. 《非结核分枝杆菌病诊断与治疗指南(2020年版)》解读[J]. 结核与肺部疾病杂志, 2021, 2(2): 108-115. Liu SS, Tang SJ. Interpretation of the guidelines for diagnosis and treatment of non-tuberculous Mycobacteria disease (2020 edition)[J]. Journal of Tuberculosis and Lung Disease, 2021, 2(2): 108-115. |
| [12] |
Chin KL, Sarmiento ME, Alvarez-Cabrera N, et al. Pulmonary non-tuberculous mycobacterial infections: current state and future management[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(5): 799-826. |
| [13] |
Zhou L, Xu D, Liu HC, et al. Trends in the prevalence and antibiotic resistance of non-tuberculous Mycobacteria in Mainland China, 2000-2019: systematic review and Meta-analysis[J]. Front Public Health, 2020, 8: 295. |
| [14] |
聂琦, 周勇, 陈华, 等. 非结核分枝杆菌病流行病学研究进展[J]. 中华临床感染病杂志, 2020, 13(5): 394-400. Nie Q, Zhou Y, Chen H, et al. Progress in epidemiological studies on non-tuberculous mycobacterial disease[J]. Chinese Journal of Clinical Infectious Diseases, 2020, 13(5): 394-400. |
| [15] |
Ma Q, Chen RD, Yang EH, et al. Non-tuberculous mycobacterial infection of the musculoskeletal system detected at two tertiary medical centres in Henan, China, 2016-2020[J]. Front Microbiol, 2021, 12: 791918. |
| [16] |
雷杰, 吴玲, 王楠, 等. 广州地区552株非结核分枝杆菌感染患者流行病学分析[J]. 现代医院, 2021, 21(8): 1245-1247, 1251. Lei J, Wu L, Wang N, et al. Epidemiological analysis of 552 patients infected with non-tuberculous Mycobacteria in Guangzhou[J]. Modern Hospitals, 2021, 21(8): 1245-1247, 1251. |
| [17] |
Liu CF, Song YM, He WC, et al. Nontuberculous Mycobacteria in China: incidence and antimicrobial resistance spectrum from a nationwide survey[J]. Infect Dis Poverty, 2021, 10(1): 59. |
| [18] |
Xu D, Han C, Wang MS, et al. Increasing prevalence of non-tuberculous mycobacterial infection from 2004-2009 to 2012-2017: a laboratory-based surveillance in China[J]. J Infect, 2018, 76(4): 422-424. |
| [19] |
全国第五次结核病流行病学抽样调查技术指导组, 全国第五次结核病流行病学抽样调查办公室. 2010年全国第五次结核病流行病学抽样调查报告[J]. 中国防痨杂志, 2012, 34(8): 485-508. Technical Guidance Group of the Fifth National TB Epidemiological Survey, The Office of the Fifth National TB Epidemiological Survey. The fifth national tuberculosis epidemiological survey in 2010[J]. Chinese Journal of Antituberculosis, 2012, 34(8): 485-508. |
| [20] |
李文彬, 胡培磊, 陈忠南, 等. 湖南省525株非结核分枝杆菌临床分离株的菌种鉴定与流行特征[J]. 中国人兽共患病学报, 2022, 38(5): 417-422. Li WB, Hu PL, Chen ZN, et al. Identification and epidemiological characteristics of 525 strains of nontuberculous Mycobacteria isolated from a Hunan clinic[J]. Chinese Journal of Zoonoses, 2022, 38(5): 417-422. |
| [21] |
易俊莉, 杨新宇, 张洁, 等. 三种检测技术鉴别结核分枝杆菌复合群与非结核分枝杆菌的效能评价[J]. 结核与肺部疾病杂志, 2020, 1(4): 240-244. Yi JL, Yang XY, Zhang J, et al. Application evaluation of three methods for identification between Mycobacterium tuberculosis complex and non-tuberculous Mycobacteria[J]. Journal of Tuberculosis and Lung Disease, 2020, 1(4): 240-244. |
| [22] |
吴祥兵, 吴联朋, 项领, 等. DNA微阵列芯片与质谱技术快速鉴定非结核分枝杆菌的差异性分析[J]. 中华医院感染学杂志, 2022, 32(1): 16-20. Wu XB, Wu LP, Xiang L, et al. Difference in rapid identification of nontuberculous Mycobacteria between DNA microarray chip and MALDI-TOF MS[J]. Chinese Journal of Nosocomio-logy, 2022, 32(1): 16-20. |
| [23] |
Sun Q, Yan J, Liao XL, et al. Trends and species diversity of non-tuberculous Mycobacteria isolated from respiratory samples in Northern China, 2014-2021[J]. Front Public Health, 2022, 10: 923968. |
| [24] |
Huang JJ, Li YX, Zhao Y, et al. Prevalence of nontuberculous Mycobacteria in a tertiary hospital in Beijing, China, Janu-ary 2013 to December 2018[J]. BMC Microbiol, 2020, 20(1): 158. |
| [25] |
Pang Y, Tan YJ, Chen J, et al. Diversity of nontuberculous mycobacteria in eastern and southern China: a cross-sectional study[J]. Eur Respir J, 2017, 49(3): 1601429. |
| [26] |
彭荣, 龚倩, 杨馨怡. 上海市青浦区非结核分枝杆菌肺病的临床特征及菌种分布分析[J]. 检验医学与临床, 2022, 19(9): 1247-1249. Peng R, Gong Q, Yang XY. Clinical characteristics and strain distribution of non-tuberculous Mycobacterium lung disease in Qingpu District, Shanghai[J]. Laboratory Medicine and Clinic, 2022, 19(9): 1247-1249. |



