2. 安徽医科大学附属六安医院 感染管理科, 安徽 六安 237005
2. Department of Infection Management, Lu'an Hospital of Anhui Medical University, Lu'an 237005, China
胃癌是消化道最常见的恶性肿瘤之一,在全球所有恶性肿瘤中其发病率和癌症相关病死率均位居第四位。2020年约有108万新发胃癌病例和77万人死于胃癌[1]。胃癌的恶性程度较高,根治性胃切除术是胃癌治疗的主要方式[2]。胃癌D2根治术(胃切除术+D2淋巴结清扫术)被医学界视为东亚地区胃癌的标准手术治疗方式[3]。尽管随着手术技术和围手术期管理的改进,胃癌根治术后的病死率和发病率明显降低,但术后感染作为胃癌根治术后最常见的并发症之一,会增加住院费用,延长住院时间,并严重影响患者的临床预后[4]。虽然目前已有关于胃癌根治术后感染危险因素的文献报道[5-6],但均不能直观、可视的预测其感染概率,临床参考价值有限。列线图(nomogram图)作为一种新的预测模型,在疾病结局风险的概率预测方面准确性高,稳定性好,已广泛应用于临床。本研究旨在建立基于胃癌D2根治术后感染危险因素的列线图模型,并对模型效能和稳定性进行验证、评估,以直观、准确识别高风险患者,为制定围手术期感染的个体化防治提供参考。
1 对象与方法 1.1 研究对象选取2019年1月—2021年12月安徽某医科大学附属医院接受胃癌D2根治术的477例胃癌患者作为研究对象。纳入标准:(1)符合术后医院感染的诊断标准[7];(2)年龄>18岁;(3) 进行择期手术;(4)临床诊疗资料完整。排除标准:(1)临床资料不完整;(2)长期使用免疫抑制剂相关药物;(3)残胃癌;(4)术前已合并感染。本研究未对研究对象实施任何干预措施,且经该院伦理委员会审查豁免知情同意。
1.2 研究方法本研究对接受胃癌D2根治术患者术后感染情况进行前瞻性监测,监测是否发生术后感染及感染部位等,同时收集术后感染病例和非感染病例的人口学资料、基础疾病情况、术前实验室检查结果、手术情况及术后组织病理学检查结果等资料。
1.3 相关标准及指标 1.3.1 诊断标准按照2001年卫生部颁布的《医院感染诊断标准(试行)》进行医院感染诊断[7],并符合以下全部条件:体温≥38.0℃,外周血白细胞≥12.0×109/L,且有相应的局部及全身感染的临床表现,经体液、分泌物、引流液等标本病原学培养阳性。
1.3.2 营养风险筛查采用NRS 2002量表进行营养风险筛查,NRS 2002由欧洲肠内肠外营养学会制定,是成年患者的营养筛查工具。其评分≥3分可判定存在营养风险,可能对临床结局不利[8]。
1.3.3 实验室指标检测术前12 h采集清晨空腹静脉血。采用全自动血细胞分析仪(希森美康XN-2100)进行血常规检测;采用贝克曼全自动生化分析仪(AU5821)进行血清蛋白水平检测。预后营养指数(PNI)=血清清蛋白(g/L)+5×外周血淋巴细胞总数(×109/L)[9]。
1.3.4 最佳截断值由约登指数(Youden index)确定。约登指数=灵敏度+特异度-1,在约登指数最大处取最佳截断值。
1.4 统计学方法应用SPSS 26.0软件进行数据分析。计量资料符合正态分布的数据以x±s表示,采用独立样本t检验;不符合正态分布的数据以中位数和四分位数表示,使用Mann-Whitney U检验;计数资料采用例数及百分率(%)表示,采用χ2检验;采用二元logistic回归分析筛选术后感染的独立危险因素。采用R(R4.2.2)软件制作列线图,用Bootstrap法进行内部验证,绘制模型受试者工作特征(receiver operating characteristic, ROC)曲线,并计算ROC曲线下面积(area under the curve, AUC) 验证模型的区分度,绘制校准曲线验证模型的校准度,绘制临床决策曲线(decision curve analysis, DCA)评价模型的临床效用。P≤0.05为差异具有统计学意义。
2 结果 2.1 基本情况共纳入477例患者,采用R语言软件将数据集按照训练集∶验证集3 ∶1的比例随机分割,其中训练集358例,验证集119例,训练集与验证集各指标比较,差异均无统计学意义(均P>0.05)。185例胃癌D2根治术患者发生术后感染,其中下呼吸道感染98例(53.0%),器官或腔隙感染48例(25.9%),血流感染17例(9.2%),上呼吸道8例(4.3%),切口感染6例(3.2%),泌尿道感染4例(2.2%),其他部位感染4例(2.2%)。
2.2 单因素分析采用ROC曲线分析PNI预测胃癌D2根治术后感染的最佳截断值为49.6。单因素分析显示,年龄≥65岁,合并心血管疾病、糖尿病,腹部手术史,NRS 2002评分≥3分,PNI<49.6,术前血红蛋白(HGB)≤110 g/L,清蛋白(ALB)≤35 g/L,美国麻醉医师协会(ASA)分级,联合器官切除,术中失血量>200 mL,围手术期输血,入住重症监护病房(ICU),T分期>Ⅱ期,肿瘤直径>4 cm,术前血清糖类抗原199(CA199)>37 U/mL对胃癌D2根治术后感染的发生有一定影响(均P<0.05)。见表 1。
| 表 1 胃癌D2根治术后感染危险因素单因素分析[例(%)] Table 1 Univariate analysis on risk factors for infection after D2 radical resection of gastric cancer (No. of cases [%]) |

|
将胃癌D2根治术后是否发生感染作为因变量(0为否,1为是),将单因素分析中P<0.05的变量赋值,见表 2。多因素logistic回归分析结果显示:腹部手术史、NRS 2002≥3分、PNI<49.6、高ASA分级、联合器官切除、入住ICU是胃癌D2根治术后感染的独立危险因素(均P<0.05),见表 3。
| 表 2 研究自变量赋值表 Table 2 Assignment of research variables |
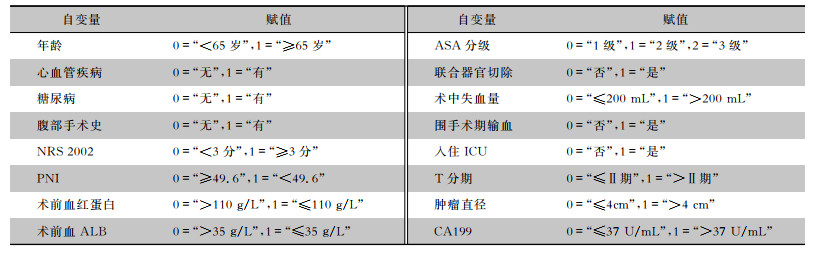
|
| 表 3 胃癌D2根治术后感染危险因素logistic回归分析 Table 3 Logistic regression analysis on risk factors for infection after D2 radical resection of gastric cancer |
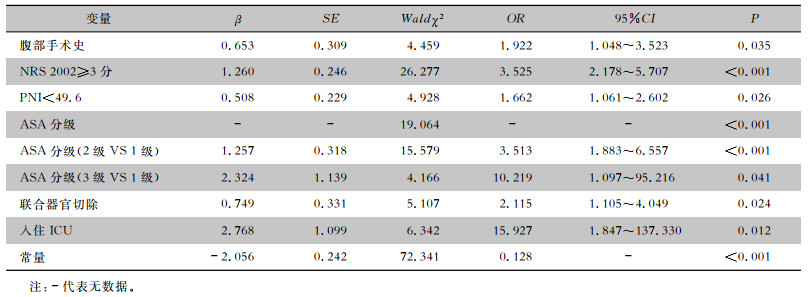
|
基于多因素logistic回归分析结果,构建胃癌D2根治术后感染风险预测列线图模型,绘制nomogram图,见图 1。先对各独立危险因素进行单独计分,各单项分数相加得到总分,总分对应预测患者术后感染的概率。
 |
| 图 1 胃癌D2根治术后感染风险预测列线图 Figure 1 The nomogram model for risk prediction of infection after D2 radical resection of gastric cancer |
采用ROC曲线和Hosmer-Lemeshow检验对模型进行验证。训练集预测胃癌D2根治术后感染发生的AUC为0.768 (95%CI: 0.718~0.818),验证集胃癌D2根治术后感染发生的AUC为0.750(95%CI: 0.664~0.837),表明该模型具有良好的判别能力,见图 2。同时,Hosmer-Lemeshow拟合优度检验显示出较好的拟合度(P>0.05),该模型拟合曲线与训练集和验证集数据的理想曲线间的差异均无统计学意义,说明该模型的校准度良好,预测概率与实际概率基本一致,准确性较好,见图 3。
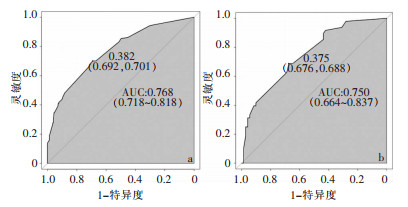 |
| 注:a为训练集;b为验证集。 图 2 列线图预测模型的ROC曲线 Figure 2 ROC curve of nomogram prediction model |
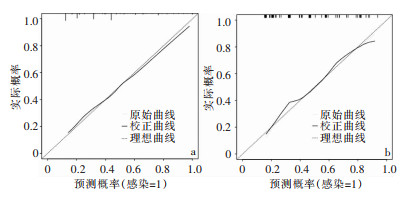 |
| 注:a为训练集;b为验证集。 图 3 列线图预测模型的校准曲线 Figure 3 Calibration curve of nomogram prediction model |
利用DCA评估该预测模型的临床效用,胃癌D2根治术后感染风险列线图预测模型DCA见图 4。提示使用该列线图模型评估出胃癌D2根治术后感染风险较高的患者进行干预,患者可能会获得较高的正向净收益。
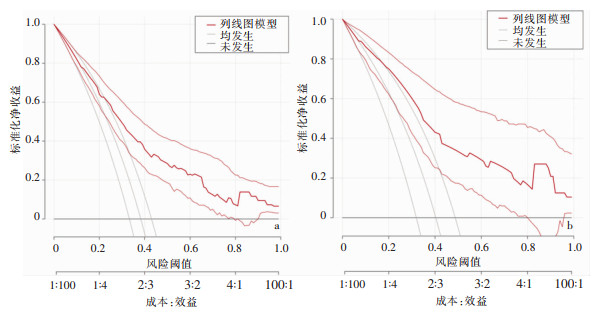 |
| 注:a为训练集;b为验证集 图 4 列线图预测模型的决策曲线分析 Figure 4 Decision curve analysis of nomogram prediction model |
感染是胃癌术后常见的严重并发症,也是患者术后死亡的重要原因之一。术后感染会明显增加抗菌药物用量,延长住院时间,增加住院费用[10-11],预防胃癌术后感染对患者的预后具有重要的临床意义。本研究回顾性调查了477例接受胃癌D2根治术患者的临床资料,分析术后感染的危险因素,结果显示腹部手术史、NRS 2002≥3分、PNI < 49.6、高ASA分级、联合器官切除、入住ICU是胃癌D2根治术后发生感染的独立危险因素。
腹部手术史患者往往存在胃肠功能偏差,食物的摄入、消化和吸收障碍,存在较大的营养风险,导致营养状况下降,影响术后康复。另外,癌症患者机体处于过度分解代谢状态,营养风险及营养不良发生率高。营养风险可对患者临床结局产生不利影响[8],NRS 2002是欧洲营养学会推荐的营养风险筛查工具,已被广泛应用于肿瘤患者营养风险的筛查[12]。而PNI是通过血清清蛋白水平和外周血淋巴细胞计数计算获得,用于评估多种疾病患者的营养状况、术后并发症风险、短期生存期的预测等[13-14]。因此,术前对患者进行营养风险筛查和综合营养状况评定,及早给予营养干预对预防术后感染并发症具有重要意义。ASA评分是美国麻醉医师协会对接受麻醉手术患者的评分,临床上常用ASA评分评估患者接受麻醉和手术的耐受力,ASA评分越高,表明该患者对麻醉和手术的耐受力越差,将影响患者的临床预后[15]。本研究结果显示,高ASA分级是胃癌D2根治术后感染的独立危险因素。胃癌向上可能会达到食管下段,甚至向周围侵犯膈肌,部分患者还会累及肝脏、结肠、脾脏等,根治术同时往往需要进行肿瘤的联合脏器切除。马雕龙等[16]回顾性分析262例胃癌患者临床资料,logistic回归分析显示,术中联合脏器切除患者术后感染发生风险是无联合脏器切除患者的5.236倍。Kunisaki等[17]研究显示,术中联合脏器切除是胃癌根治术后感染发生的影响因素。术中联合器官切除,手术时间长,创伤大,失血多,增加了感染并发症风险[18]。部分胃癌患者术后因病情较重可能会转入ICU进行监护治疗。ICU环境处于多种耐药菌并存状态,增加患者感染的风险[19]。ICU获得性感染可直接影响患者预后,延长术后住院时间[20]。本研究结果显示,术后进入ICU监护治疗的患者发生感染的风险更高。
列线图模型可将多因素logistic回归分析结果图形化、可视化,能更直观地衡量临床结局的发生风险,临床实用性更强。因此,建立一个直观、简单、有效的列线图预测模型可以指导临床医生预防与治疗术后感染。本研究基于多因素logistic回归分析结果,构建胃癌D2根治术后感染发生风险的列线图预测模型。结果显示训练集ROC曲线AUC为0.768(95%CI: 0.718~0.818),验证集ROC曲线AUC为0.750(95%CI: 0.664~0.837),表明该模型具有良好的区分度和判别能力。通过Hosmer-Lemeshow拟合优度检验和绘制的校正曲线均提示该模型在预测值与真实值之间一致性较好,同时DCA表明模型具有良好的临床效用。临床医生可通过本研究构建的直观预测模型对胃癌D2根治术后感染高危患者进行早期预判,并及早采取相应预防措施。
综上所述,腹部手术史、NRS 2002≥3分、PNI < 49.6、高ASA分级、联合器官切除、入住ICU是胃癌D2根治术后感染的独立危险因素,基于此结果构建的列线图预测模型具有良好的预测性能和临床效用,可为术后感染的预防提供参考。该预测模型是基于单中心研究获得,需要多中心、前瞻性、大样本量的临床研究进一步验证。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Smyth EC, Nilsson M, Grabsch HI, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. DOI:10.1016/S0140-6736(20)31288-5 |
| [3] |
Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2021(6th edition)[J]. Gastric Cancer, 2023, 26(1): 1-25. DOI:10.1007/s10120-022-01331-8 |
| [4] |
De Pascale G, Carelli S, Vallecoccia MS, et al. Risk factors for mortality and cost implications of complicated intra-abdo-minal infections in critically ill patients[J]. J Crit Care, 2019, 50: 169-176. DOI:10.1016/j.jcrc.2018.12.001 |
| [5] |
黄于珊, 蔡玲, 张肖红, 等. 胃癌患者术后感染的危险因素[J]. 中国感染控制杂志, 2019, 18(6): 582-586. Huang YS, Cai L, Zhang XH, et al. Risk factors for postope-rative infection in patients with gastric cancer[J]. Chinese Journal of Infection Control, 2019, 18(6): 582-586. |
| [6] |
赵金辉, 谷顺通, 田丽, 等. 腹腔镜胃癌根治术患者术后肺部感染与影响因素分析[J]. 中华医院感染学杂志, 2019, 29(3): 403-406. Zhao JH, Gu ST, Tian L, et al. Indicators and risk factors of postoperative pulmonary infection in patients after laparoscopic radical resection of gastric cancer[J]. Chinese Journal of Noso-comiology, 2019, 29(3): 403-406. |
| [7] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the PRC. Diagnostic criteria for nosocomial infections(proposed)[J]. National Medical Journal of China, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [8] |
Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003, 22(3): 321-336. DOI:10.1016/S0261-5614(02)00214-5 |
| [9] |
迪丽奴尔·艾尔肯, 张华, 阿布都沙塔尔·卡地尔, 等. 预后营养指数在胃癌肺转移患者预后中的意义及列线图预测模型的建立研究[J]. 中国全科医学, 2021, 24(30): 3863-3869. Dilinuer·Aierken, Zhang H, Abudushataer·Kadier, et al. Prognostic value of prognostic nutritional index and a prognostic nomogram developed based it for gastric cancer patients with lung metastasis[J]. Chinese General Practice, 2021, 24(30): 3863-3869. DOI:10.12114/j.issn.1007-9572.2021.02.019 |
| [10] |
Kosuga T, Ichikawa D, Komatsu S, et al. Clinical and surgical factors associated with organ/space surgical site infection after laparoscopic gastrectomy for gastric cancer[J]. Surg Endosc, 2017, 31(4): 1667-1674. DOI:10.1007/s00464-016-5156-7 |
| [11] |
Qian Y, Liu HY, Pan JH, et al. Preoperative controlling nutritional status (CONUT) score predicts short-term outcomes of patients with gastric cancer after laparoscopy-assisted radical gastrectomy[J]. World J Surg Oncol, 2021, 19(1): 25. DOI:10.1186/s12957-021-02132-6 |
| [12] |
斯彩娟, 王卫光, 洪秀芳, 等. NRS2002、SGA在恶性肿瘤住院患者营养筛查与评估中的应用[J]. 浙江医学, 2021, 43(11): 1192-1195. Si CJ, Wang WG, Hong XF, et al. Application of NRS2002 and SGA in nutritional assessment in patients with malignant tumor[J]. Zhejiang Medical Journal, 2021, 43(11): 1192-1195. DOI:10.12056/j.issn.1006-2785.2021.43.11.2019-2659 |
| [13] |
Hirahara N, Tajima Y, Fujii Y, et al. Prognostic nutritional index as a predictor of survival in resectable gastric cancer patients with normal preoperative serum carcinoembryonic antigen levels: a propensity score matching analysis[J]. BMC Cancer, 2018, 18(1): 285. DOI:10.1186/s12885-018-4201-4 |
| [14] |
刘燕燕, 张明军. 预后营养指数对进展期胃癌患者术后并发症及短期生存率的影响分析[J]. 临床输血与检验, 2022, 24(2): 230-235. Liu YY, Zhang MJ. Effect of prognostic nutritional index on postoperative complications and short-term survival rate for patients with advanced gastric cancer[J]. Journal of Clinical Transfusion and Laboratory Medicine, 2022, 24(2): 230-235. DOI:10.3969/j.issn.1671-2587.2022.02.019 |
| [15] |
陈思曾, 穆建成. 术前ASA分级及手术范围对胃癌根治术患者预后的影响[J]. 中国普通外科杂志, 2015, 24(10): 1363-1366. Chen SZ, Mu JC. Influence of preoperative ASA classification and scope of surgical operation on prognosis of gastric cancer after radical gastrectomy[J]. Chinese Journal of General Surgery, 2015, 24(10): 1363-1366. DOI:10.3978/j.issn.1005-6947.2015.10.004 |
| [16] |
马雕龙, 狐鸣, 苏阿德, 等. 机器人辅助胃癌根治术后腹腔感染的危险因素及预后分析[J]. 中国普通外科杂志, 2022, 31(4): 497-506. Ma DL, Hu M, Su AD, et al. Analysis of risk factors and prognosis of intra-abdominal infection after robotic-assisted radical gastric cancer resection[J]. Chinese Journal of General Surgery, 2022, 31(4): 497-506. |
| [17] |
Kunisaki C, Sato S, Tsuchiya N, et al. Systemic review and Meta-analysis of impact of splenectomy for advanced gastric cancer[J]. In Vivo, 2020, 34(6): 3115-3125. DOI:10.21873/invivo.12145 |
| [18] |
李云峰. 腹腔镜胃癌根治术后发生感染的危险因素研究[J]. 临床研究, 2018, 26(7): 7-8, 10. Li YF. Study on risk factors of infection after laparoscopic radi-cal gastrectomy for gastric cancer[J]. Clinical Research, 2018, 26(7): 7-8, 10. |
| [19] |
Bassetti M, Eckmann C, Giacobbe DR, et al. Post-operative abdominal infections: epidemiology, operational definitions, and outcomes[J]. Intensive Care Med, 2020, 46(2): 163-172. DOI:10.1007/s00134-019-05841-5 |
| [20] |
Agodi A, Barchitta M, Auxilia F, et al. Epidemiology of intensive care unit-acquired sepsis in Italy: results of the SPIN-UTI network[J]. Ann Ig, 2018, 30(5 Supple 2): 15-21. |



