新型冠状病毒感染(coronavirus disease 2019, COVID-19)是严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)感染导致的疾病[1]。全球范围内仍不断出现新发及反复感染人群,对全球人类健康带来了巨大影响。国家卫生健康委员会虽已将其纳入乙类乙管传染病,但病毒传播力强、个体感染差异大。大部分肾损伤患者因长期口服糖皮质激素、使用免疫抑制剂或规律透析[2],易受SARS-CoV-2侵袭。COVID-19影响患者的肾脏疾病治疗,甚至加重病情[3]。研究[4]表明,感染SARS-CoV-2的慢性肾脏病(chronic kidney disease, CKD) 患者病死率是未感染SARS-CoV-2的CKD患者5.81倍。因此,寻找有效、安全的抗新型冠状病毒(简称新冠病毒)药物对于肾损伤患者至关重要。
重组全人源抗新型冠状病毒单克隆抗体注射液(F61注射液)为国药集团中国生物武汉生物制品研究所有限责任公司生产的具有高中和活性的重组全人源抗新冠病毒单克隆抗体,在CHO细胞中进行重组表达,能特异性结合SARS-CoV-2的RBD蛋白,阻止其与宿主细胞的ACE2结合,从而阻止病毒感染细胞,达到治疗疾病的目的[5]。F61注射液已获得国家食品药品监督管理局的临床批件。但针对新冠病毒感染合并肾损伤人群的疗效和安全性尚不明确,为此,进行了这项研究者发起的探索性随机对照试验,对F61单抗在新冠病毒感染合并肾损伤人群开展初步的临床评估。
1 对象与方法 1.1 研究设计本研究在解放军总医院第一医学中心开展。研究方案经过该院伦理审查委员会批准(伦审第S2023-022-01号),本研究遵循《赫尔辛基宣言》,所有受试者均须签署知情同意书(informed consent form, ICF)。
1.2 纳入与排除标准 1.2.1 纳入标准(1) 受试者年龄18~80岁,男女不限;(2)SARS-CoV-2核酸检测结果呈阳性;(3)维持性血液透析患者或合并肾损伤[符合尿沉渣异常、肾脏影像学异常、肾脏病理异常或肾小球滤过率(eGFR)<60 mL/(min · 1.73 m2)之一] 的患者;(4)自签署ICF至研究药物给药后6个月内,受试者(包括伴侣)无妊娠计划且自愿采取有效避孕措施;(5)受试者意识清晰,能够和研究者进行良好的沟通,并且理解和遵守本项研究的各项要求,理解并签署ICF。
1.2.2 排除标准(1) 根据国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案》(试行第九版)临床分型为危重型患者[6];(2)疑似或证实的严重活动性细菌、真菌、病毒或其他感染(COVID-19除外),研究者认为采取干预措施时可能构成风险;(3)在筛选期丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)>3倍正常值上限;(4)既往发生过药物严重过敏反应者;(5)筛选前3个月接受过SARS-CoV-2特异性免疫球蛋白(含单克隆抗体)治疗者;(6)给药前3个月有接受恢复期COVID-19血浆治疗史者;(7)筛选前1个月内参加过其他药物临床试验;(8)研究者认为不适宜进入本项试验的其他因素;(9)妊娠期、哺乳期妇女。
1.3 随机与盲法符合要求的受试者通过计算机程序被随机分配到试验组或对照组。本研究未设盲法。
1.4 干预方法对照组接受常规治疗,试验组则接受常规治疗+F61注射液,单次给予F61注射液600 mg(加入250 mL 0.9%氯化钠注射液中)静脉滴注,时间不少于1 h。常规治疗:包括抗病毒药物、氧疗、抗凝治疗等临床医生判断的必要治疗,抗病毒药物为奈玛特韦/利托那韦片Paxlovid(300 mg奈玛特韦和100 mg利托那韦),q12h,治疗疗程为5 d,在确诊COVID-19及出现症状后5 d内用药;或阿兹夫定片5 mg,qd,治疗疗程不超过14 d。研究药物:F61注射液(武汉生物制品研究所有限责任公司生产),由国药集团中国生物武汉生物制品研究所和中国疾病预防控制中心病毒病控制所合作开发。
1.5 随访给药后随访15 d。其中给药当天至给药后第8天为疗效随访阶段(基线D1定义为给药第一天),在此阶段对受试者的临床症状、疾病进展情况进行评估,直到持续临床恢复和转为重症或完成8 d随访。给药后9~15 d为安全性随访阶段,在最后1次随访结束前或提前退出前,需进行随访结束的安全性检查,并在整个研究期间收集不良事件和合并用药情况。
1.6 数据采集及监测筛选及随访期采集受试者的人口学、既往史、个人史、检查及实验室指标等数据。并按照世界卫生组织(WHO)10分等级疾病进展量表评分,对受试者病情进行评估[7]。受试者症状评估为患者自评,COVID-19相关目标症状评分量表包括:评估过去24 h患者发热、咳嗽、咽喉痛、鼻塞或者流鼻涕、头痛、肌肉痛、气促或呼吸困难、恶心、畏寒或寒战的严重程度(无=0分,轻度=1分,中度=2分,重度=3分),以及呕吐、腹泻(不成形或者水样便)情况(无=0分,1~2次=1分,3~4次=2分,≥5次=3分)。持续临床恢复是指连续2 d所有COVID-19相关目标症状评分≤1分。持续临床恢复时间的定义为从基线至受试者首次达到临床症状持续恢复的天数或完成8 d疗效随访(以先出现为准)。
1.7 样本量估算主要结局指标为受试者在用药后至第8天临床分型进展及死亡的比例。根据主要结局指标估算样本量。估计对照组临床分型进展及死亡的比率为30%,试验组比率为12%。检验水准α取0.05(双侧),把握度1-β取0.80。利用SPSS 15.0软件计算得到对照组和试验组各需要80例受试者,共计160例。假定研究对象的失访率为10%,则本试验共计划入组178例,其中肾透析组和非肾透析组各89例。因本研究是探索性临床试验,故可允许纳入估算样本量的9%左右[8],即16例。
1.8 研究终点主要终点:用药当天至第8天临床分型进展及死亡受试者的比例。次要终点:①15天内全因病死率;②疗效随访期SARS-CoV-2转阴的受试者百分比及两组转阴平均时间;③症状评分(总评分和患者自评)及WHO 10分等级疾病进展量表较基线的变化;④肺部CT较基线的变化(肺叶、段、层,进展/好转);⑤炎性指标及凝血功能较基线变化情况;⑥治疗中出现的不良事件和严重不良事件的发生率和严重程度。
患者临床分型及治愈标准根据《新型冠状病毒肺炎诊疗方案》(试行第九版)执行[6],临床分型为四型:轻型、普通型、重型及危重型。治愈标准:参照《新型冠状病毒肺炎诊疗方案(试行第九版)》的出院标准,①体温恢复正常3 d以上;②呼吸道症状明显好转;③肺部影像学显示急性渗出性病变明显改善;④连续两次新型冠状病毒核酸检测V基因和ORF基因Ct值均≥35,或连续两次新型冠状病毒核酸检测阴性。
1.9 统计学方法统计分析应用R 4.3.1统计分析软件进行计算。所有统计检验均为双侧,检验水准为0.05。符合正态分布的计量资料用均数、标准差进行统计描述,不符合正态分布的计量资料用中位数(P25,P75)表示;计数资料或等级资料用频数、频率描述。计量资料符合正态性及方差齐时,采用成组t检验进行统计分析,不符合时采用Wilcoxon秩和检验分析;分类资料用卡方/Fisher确切概率检验进行组间比较。P≤0.05为差异有统计学意义。
2 结果研究共筛选52例患者,其中36例患者符合纳入标准,12例患者签署了知情同意书。最终,共12例受试者接受了随机分组,其中对照组5例,试验组7例。第一例受试者于2023年1月12日入组,本试验于2023年2月28日结束。12例受试者中,血液透析患者5例(其中4例持续性透析,1例为新冠病毒感染期间行床旁持续性血液滤过治疗),非透析肾损伤受试者7例。受试者基线特征见表 1。部分感染、凝血指标及血肌酐基线见表 2。
| 表 1 纳入受试者的基本情况 Table 1 Basic conditions of included subjects |
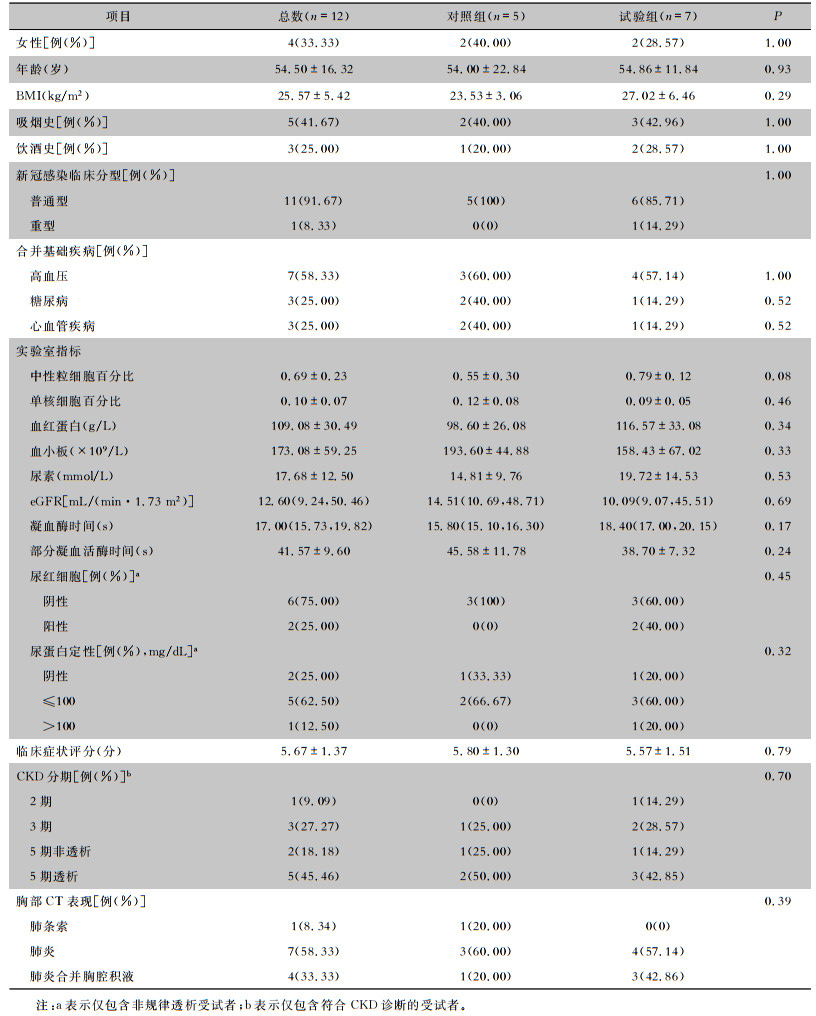
|
| 表 2 受试者感染、凝血指标及血肌酐的基线及随访情况 Table 2 Baseline and follow-up of infection, coagulation indicators and blood creatinine in subjects |
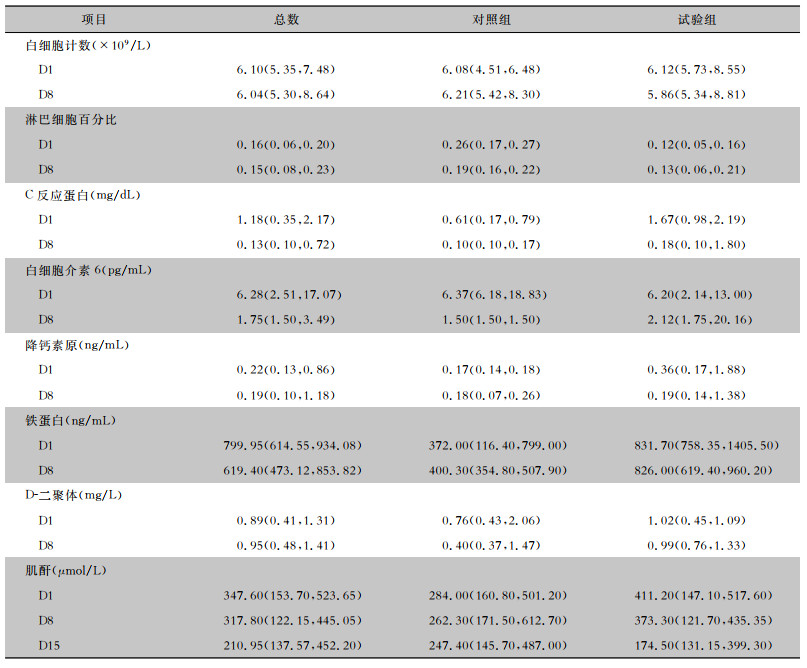
|
12例受试者中,11例的临床分型为普通型,1例为重型(入组时血氧饱和度为93%,试验组),所有受试者在研究随访期间均未发生临床分型进展,且无死亡病例,两组差异无统计学意义(P>0.05)。用药后至第8天,经临床症状评估,治愈1例(8.33%),转为轻型者5例(41.67%),普通型者6例(50.00%)。其中,对照组至第8天,无治愈者,转为轻型2例(40.00%),普通型3例(60.00%);试验组治愈1例(14.30%),转为轻型3例(42.86%),普通型3例(42.86%),其中1例重型受试者转为普通型。对比两组受试者临床分型进展/改善情况,差异无统计学意义(P>0.05)。见图 1。
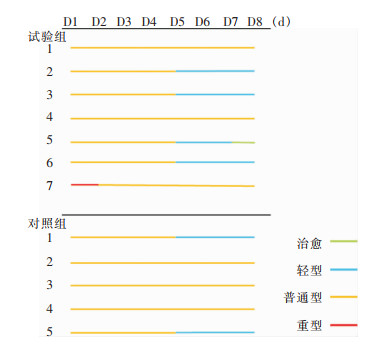 |
| 注:横坐标为受试者入组后随访天数,纵坐标为试验组和对照组受试者序号。实线表示该受试者在随访当天的临床分型状态,绿色实线为治愈,蓝色实线为轻型,橙色实线为普通型,红色实线为重型。 图 1 两组受试者临床分型随时间变化情况 Figure 1 Changes in clinical classification over time in two groups of subjects |
安全性评估阶段,两组均未出现死亡病例,也均未出现疾病进展,差异无统计学意义(P>0.05)。至第15天,共治愈6例(50.00%),对照组2例(40.00%),试验组4例(57.14%),两组差异无统计学意义(P>0.05)。
2.2.2 SARS-CoV-2转阴的受试者比例评估第3、5、8天的SARS-CoV-2转阴情况,第3天,共8例(66.67%)受试者转阴,其中对照组3例(60.00%),试验组5例(71.43%),差异无统计学意义(P>0.05)。第5天,共9例受试者转阴(75.00%),其中对照组3例(60.00%),试验组6例(85.71%),差异无统计学意义(P>0.05)。第5天,有1例受试者复阳,为试验组受试者。第8天,共8例(66.67%)受试者转阴,其中对照组3例(60.00%),试验组5例(71.43%),差异无统计学意义(P>0.05)。第8天,有2例受试者复阳,对照组1例,试验组1例。根据受试者转阴情况,对照组平均转阴时间为3.20 d,试验组为1.57 d,差异有统计学意义(P=0.046)。见图 2。
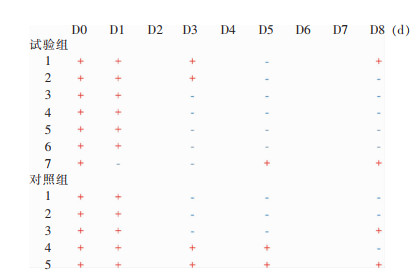 |
| 注:横坐标为受试者入组后随访天数,D0表示筛选期,D1表示用药后第1天。纵坐标为试验组和对照组受试者序号。+/-表示该受试者在随访当天的SARS-CoV-2核酸检测结果,红色+为阳性,蓝色-为阴性,试验组第7例受试者D1为入组用药后采集的咽拭子检测结果,故用药后第1天转为阴性。 图 2 两组受试者SARS-CoV-2核酸检测转阴情况 Figure 2 Conversion to negative SARS-CoV-2 nucleic acid testing in two groups of subjects |
受试者症状评估为患者自评,受试者入组时基线总体临床症状评分为(5.67±1.37)分,其中对照组为(5.80±1.30)分,试验组为(5.57±1.51)分,差异无统计学意义(P>0.05)。第3天总体评分(3.92±1.24)分,对照组为(4.80±0.84)分,高于试验组的(3.29±1.11)分,差异有统计学意义(P=0.029)。第5天总体评分为(2.67±0.89)分,对照组为(3.40±0.89)分,高于试验组的(2.14±0.38)分,差异有统计学意义(P=0.007)。第8天评分为(2.08±0.90)分,对照组为(2.40±0.89)分,试验组为(1.86±0.90)分,差异无统计学意义(P>0.05)。
2.2.4 WHO 10分等级疾病进展量表对照组1例受试者,在感染期间仅有相关症状,无绝对住院治疗需要,故参照轻症流动人群,评估为3分。受试者入组时基线等级疾病评分为(4.08±1.44)分,其中对照组为(4.20±0.84)分,试验组为(4.00±1.83)分。第3天评分(1.33±2.02)分,其中对照组为(1.60±2.30)分,试验组为(1.14±1.95)分。第5天评分为(0.92±1.78)分,对照组为(1.40±2.19)分,试验组为(0.57±1.51)分。第8天评分为(0.92±1.44)分,对照组为(1.20±1.79)分,试验组为(0.71±1.25)分。两组疾病进展评分比较,差异均无统计学意义(均P>0.05)。
2.2.5 肺部影像学变化所有入组受试者均存在肺部影像学异常,其中,存在肺条索者1例(8.33%),为对照组受试者;片状肺炎者7例(58.33%),其中对照组3例(60.00%),试验组4例(57.14%);肺炎合并胸腔积液者4例(33.33%),其中对照组1例(20.00%),试验组3例(42.86%)。以上两组间比较,差异无统计学意义(P>0.05)。
第3天,较基线轻度进展者1例(8.33%),为对照组规律血液透析者;轻度好转者6例(50.00%),对照组1例(20.00%),试验组5例(71.43%);明显好转者2例(16.67%),其中对照组1例(20.00%),试验组1例(14.29%);较基线无变化者3例(25.00%),其中对照组2例(40.00%),试验组1例(14.29%)。以上两组间比较,差异无统计学意义(P>0.05)。
第8天,较基线轻度进展者1例(8.33%),为对照组受试者,曾长期规律血液透析,后于2007年进行肾移植,术后未再透析治疗;轻度好转者3例(25.00%),对照组1例(20.00%),试验组2例(28.57%);明显好转者8例(66.67%),其中对照组3例(60.00%),试验组5例(71.43%)。以上两组间比较,差异无统计学意义(P>0.05)。
2.2.6 感染、凝血及肾功能指标研究期间,严密监测患者的白细胞、淋巴细胞、降钙素原、铁蛋白等感染指标,D-二聚体及肌酐等相关指标,以观察患者用药疗效及安全性。与基线相比,两组的感染指标和凝血功能整体呈下降趋势,显示受试者感染均在改善。且两组患者的血肌酐水平也整体呈下降趋势,表明药物未对肾脏造成进一步损伤,在肾脏安全性方面是可靠的。见表 2。
2.2.7 不良事件根据既往临床研究不良事件的发生情况,以及在研究过程中对受试者症状、体征及相关检查的综合分析,受试者用药后的不良事件主要表现为血糖升高、尿葡萄糖升高、尿胆原升高、尿管型阳性及心律失常,两组比较,差异无统计学意义(P>0.05)。其中血糖升高者2例(16.67%),其中对照组1例(20.00%),试验组1例(14.29%);尿葡萄糖升高者3例(25.00%),其中对照组1例(20.00%),试验组2例(28.57%);尿胆原升高1例(8.33%),为试验组受试者(14.29%);尿管型表现为阳性者1例(8.33%),为对照组受试者(20.00%);心律失常者1例(8.33%),为试验组受试者(14.29%),P=0.41,该受试者既往即合并持续性房颤,用药后第15天,心电图表现为房颤合并快速心室率,及时予控制心率治疗后好转。
3 讨论本研究是一项随机对照的探索性临床试验,初步获得COVID-19合并肾损伤患者使用F61注射液的有效性和安全数据,为F61注射液应用于临床提供了可行性。
根据《新型冠状病毒感染诊疗方案》(试行第九版)[6]推荐的抗病毒治疗方法包括:奈玛特韦/利托那韦片联合治疗、阿兹夫定、单克隆抗体治疗、静注COVID-19人免疫球蛋白、康复者恢复期血浆治疗等[9-12]。具有中和活性的单克隆抗体具有靶点明确、纯度高、可大规模制备等优势,是应对传染病防治的有力武器。既往研究结果显示,F61注射液安全性、耐受性较好,综合F61前期临床药代动力学数据及体外假病毒和活病毒中和活性数据,600、900 mg能更充分保证其对Omicron BA.5感染的治疗效果。针对中和抗体或中和抗体联合/鸡尾酒疗法的研究表明,该治疗有效降低了新诊断为COVID-19患者的病毒载量和住院治疗或急救护理的需求[13]。且各剂量组发生不良事件的严重程度未出现随着剂量升高而增加的趋势。F61在治疗合并基础疾病,特别对于新冠病毒感染后高死亡风险的肾损伤患者中评估使用F61治疗新冠的有效性和安全性更具有临床价值。
本研究最终纳入的12例受试者, 除1例试验组受试者为重型外,余11例均为普通型。治疗后,两组受试者均未出现临床进展或死亡病例。两组受试者临床分型均不同程度出现好转,但未表现出统计学差异。在SARS-CoV-2转阴方面,两组受试者在入组后第3、5、8天均有大部分受试者转阴,但也存在个别受试者转阴后一过性复阳表现,包括试验组2例及对照组1例受试者,考虑与患者感染前长期应用免疫抑制剂相关。而试验组治疗后的平均转阴时间短于对照组,差异有统计学意义。研究结果显示,F61注射液可更快地抑制病毒复制效应,推测如果将药物用于重症或危重症的患者,可能发挥更有临床意义的抗病毒作用。
本研究同时关注了患者的自我症状改善,相比于基线,试验组在第3天及第5天的症状评分低于对照组。WHO 10分等级疾病进展量表评分变化显示受试者病情均有好转,但两组差异无统计学意义,这些可能是由于纳入患者临床分型较轻及样本量小。两组受试者感染及凝血指标在治疗后整体呈下降趋势,可能与较快的新冠病毒核酸转阴、患者远期预后良好有关。肺部感染影像学方面,对照组2例患者在研究期间出现新发感染病灶或合并胸腔积液,两组余受试者均表现为感染范围较前减小。
F61是强效中和抗体,不同于低亲和力、交叉反应抗体或低中和度的抗体,引起抗体依赖的增强作用的风险可能性较低[14]。本试验通过报告不良事件、记录生命体征、化验、心电图检查等,密切监测本临床研究受试者的安全。在使用F61注射液过程中,受试者均未表现出任何不良事件,随访阶段,两组受试者表现出不同程度血糖升高、尿葡萄糖升高、尿胆原升高、尿管型阳性及心律失常,与前期药物研究的不良事件发生情况大致相符,但两组未表现出明显差异。本研究结果显示,相对于常规治疗方案,联合F61注射液在改善新冠病毒感染合并肾损伤患者病情方面表现出较为满意的疗效,同时也未增加任何不良事件的发生,显示出临床可接受的安全性。
肾损伤COVID-19患者易进展至重型肺炎,本研究选择了所有入组受试者均使用《新型冠状病毒感染诊疗方案》(试行第九版)推荐的常规疗法,试验组在常规疗法基础上,加用试验药物F61注射液,以保证所有受试者均能得到有效治疗,极大地保障了患者利益。本研究显示,加用F61注射液治疗后,明显缩短了肾损伤受试者SARS-CoV-2核酸转阴时间,改善COVID-19病情。同时,联合F61注射液,明显减轻了肾损伤患者的新冠病毒感染相关症状。同时,本研究未出现药物严重不良事件,加用试验药物,也未明显增加不良事件发生,进一步显示了药物安全性,提示F61注射液的临床可推广性。
本研究的设计优势在于以常规疗法为基础,在试验组联合研究药物,最大化受试者的利益,提高了依从性。同时,新冠病毒目前仍持续存在,对于肾脏功能受损的患者,新冠病毒感染的病死率高。而进口的抗新冠药物Paxlovid供应不足,获取难度大,且用药禁忌较多,而Molnupiravir价格更为昂贵。新冠病毒流行期间,临床推荐药物主要为进口药物Paxlovid,但F61作为国产创新药为临床患者救治提供了新的手段,临床可及性高,且单次用药,易于临床使用和患者接受,增加了临床用药的选择,提示研究药物具有良好的临床应用前景。本研究按照pilot RCT设计,虽然样本量小,但已给出国产抗新冠病毒感染新药F61单抗的初步安全性和有效性数据,为临床进一步扩大样本量验证提供了信心,有积极的临床价值。但本研究也存在一些局限性。首先,由于RCT仅在单中心开展,且COVID-19属于时限性疾病,研究开展时间受限,虽时有阶段性感染人群,但因多在门诊或居家治疗,入组及用药难度大,难以进一步扩展样本量。其次,为保障患者临床获益,未设置安慰剂对照,治疗效果对比差异受限。最后,纳入受试者临床分型多数为普通型,限制了对重型及危重型患者的研究,而此类患者可能获益更多;且未纳入高龄(>80岁)患者,考虑此群体可能免疫功能下降、基础疾病较多,应引起更多关注,目前对于该年龄群体的研究不足。因此,今后的研究应该扩大样本量,并纳入不同临床分型及更大范围年龄段人群,以全面地评估F61的疗效,为临床决策的制定提供依据。
F61注射液在治疗COVID-19合并肾损伤患者时显示出较为满意的疗效及可耐受的安全性,但需进一步研究验证。考虑到国产药物的高可及性,使用国产的抗新冠药物可为临床决策的制定和实践提供更多选择。
致谢: 感谢武汉生物制品研究所有限责任公司为研究提供试验药物,并感谢国药集团中国生物杨晓明研究员,临床医学部主任杨云凯女士及龙菲光女士对本研究的大力支持。
作者贡献声明:陈香美、蔡广研、孙雪峰、李平主要负责研究设计及论文撰写的指导,李平、陈丁华、周京负责受试者筛选及签署知情同意书,陈丁华负责论文的撰写,陈丁华、李超凡、牛越负责数据分析,冯哲、王涌、张利等主要负责研究的指导、实施及随访。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Zhou GY, Zhao Q. Perspectives on therapeutic neutralizing antibodies against the novel coronavirus SARS-CoV-2[J]. Int J Biol Sci, 2020, 16(10): 1718-1723. DOI:10.7150/ijbs.45123 |
| [2] |
Rovin BH, Adler SG, Barratt J, et al. Executive summary of the KDIGO 2021 guideline for the management of glomerular diseases[J]. Kidney Int, 2021, 100(4): 753-779. DOI:10.1016/j.kint.2021.05.015 |
| [3] |
Brogan M, Ross MJ. COVID-19 and kidney disease[J]. Annu Rev Med, 2023, 74: 1-13. DOI:10.1146/annurev-med-042420-104753 |
| [4] |
Cai RY, Zhang JS, Zhu YF, et al. Mortality in chronic kidney disease patients with COVID-19: a systematic review and Meta-analysis[J]. Int Urol Nephrol, 2021, 53(8): 1623-1629. DOI:10.1007/s11255-020-02740-3 |
| [5] |
Qu YY, Zhang XY, Wang MY, et al. Antibody cocktail exhibits broad neutralization activity against SARS-CoV-2 and SARS-CoV-2 variants[J]. Virol Sin, 2021, 36(5): 934-947. DOI:10.1007/s12250-021-00409-4 |
| [6] |
国家卫生健康委员会办公厅, 国家中医药管理局办公室. 新型冠状病毒肺炎诊疗方案(试行第九版)[J]. 中国病毒病杂志, 2022, 12(3): 161-169. General Office of National Health Commission of the People's Republic of China, Office of National Administration of Traditional Chinese Medicine of the People's Republic of China. Guidelines for the diagnosis and treatment of coronavirus di-sease 2019 (trial version ninth)[J]. Chinese Journal of Viral Diseases, 2022, 12(3): 161-169. |
| [7] |
WHO Working Group on the Clinical Characterisation and Management of COVID-19 Infection. A minimal common outcome measure set for COVID-19 clinical research[J]. Lancet Infect Dis, 2020, 20(8): e192-e197. DOI:10.1016/S1473-3099(20)30483-7 |
| [8] |
Cocks K, Torgerson DJ. Sample size calculations for pilot randomized trials: a confidence interval approach[J]. J Clin Epidemiol, 2013, 66(2): 197-201. DOI:10.1016/j.jclinepi.2012.09.002 |
| [9] |
Liu LH, Wang PF, Nair MS, et al. Potent neutralizing antibodies against multiple epitopes on SARS-CoV-2 spike[J]. Nature, 2020, 584(7821): 450-456. DOI:10.1038/s41586-020-2571-7 |
| [10] |
Owen DR, Allerton CMN, Anderson AS, et al. An oral SARS-CoV-2 M pro inhibitor clinical candidate for the treatment of COVID-19[J]. Science, 2021, 374(6575): 1586-1593. DOI:10.1126/science.abl4784 |
| [11] |
Kabinger F, Stiller C, Schmitzová J, et al. Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis[J]. Nat Struct Mol Biol, 2021, 28(9): 740-746. DOI:10.1038/s41594-021-00651-0 |
| [12] |
Taylor PC, Adams AC, Hufford MM, et al. Neutralizing monoclonal antibodies for treatment of COVID-19[J]. Nat Rev Immunol, 2021, 21(6): 382-393. DOI:10.1038/s41577-021-00542-x |
| [13] |
Chen P, Nirula A, Heller B, et al. SARS-CoV-2 neutralizing antibody LY-CoV555 in outpatients with COVID-19[J]. N Engl J Med, 2021, 384(3): 229-237. DOI:10.1056/NEJMoa2029849 |
| [14] |
Arvin AM, Fink K, Schmid MA, et al. A perspective on potential antibody-dependent enhancement of SARS-CoV-2[J]. Nature, 2020, 584(7821): 353-363. DOI:10.1038/s41586-020-2538-8 |



