鲍曼不动杆菌因其具有强大的获得性耐药和克隆传播能力而受到广泛关注。目前,临床微生物实验室多采用自动化细菌鉴定系统或生物质谱技术鉴定不动杆菌,由于醋酸钙不动杆菌、鲍曼不动杆菌、皮特不动杆菌(Acinetobacter pittii,不动杆菌基因型3)和医院不动杆菌(Acinetobacter nosocomialis,不动杆菌基因型13TU)生化表型或蛋白指纹图谱接近,较难区分,大多被鉴定并报告为鲍曼不动杆菌。醋酸钙不动杆菌多分布于自然环境中,临床送检标本中分离到的不动杆菌则多为其余三种。鲍曼不动杆菌是医院感染常见的条件致病菌,而皮特不动杆菌和医院不动杆菌约占临床分离醋酸钙不动杆菌-鲍曼不动杆菌复合群(Acinetobacter calcoaceticus-Acinetobacter baumannii complex, ACB)的10%~66%[1-4]。需要引起重视的是,上述三种细菌感染患者的临床特点可能存在差异[5-6]。关于鲍曼不动杆菌医院感染的文献[7-8]较多,本研究重点关注皮特不动杆和医院不动杆菌,回顾性分析其分离患者的临床资料和实验室数据,探讨OXA-51基因扩增在临床ACB快速鉴定中的价值,并对同期分离的皮特不动杆菌和医院不动杆菌进行同源性分析。
1 资料与方法 1.1 菌株来源收集2016年1—12月分离自云南省第二人民医院临床微生物实验室335株ACB非重复菌株,同一患者仅选取首次培养分离的菌株。
1.2 资料收集收集细菌培养ACB阳性患者的临床资料及实验室检查结果,包括:(1)患者的年龄、性别;(2)是否入住重症监护病房(ICU),ICU入住天数,出院或死亡前的住院时间;(3)患者的基础疾病(肺部疾病、心血管疾病、高血压、糖尿病);(4)有创操作,分离前1个月内是否行机械通气(气管切开和气管插管),中央动脉/静脉置管、留置导尿管≥3 d;(5)对常用抗菌药物的药敏情况、多重耐药菌检出情况;(6)转归:是否死亡;(7)分离前最后一次实验室检查结果,丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清尿素氮(BUN)、球蛋白。
1.3 方法 1.3.1 主要仪器与试剂VITEK 2 Compact全自动微生物分析仪、细菌鉴定卡和药敏卡由法国BioMerieux公司生产,培养皿为郑州安图生物有限公司生产,抗菌药物药敏纸片为英国OXOID公司产品。PCR仪购自北京安杰思,电泳仪、电泳槽及凝胶成像系统为美国Bio-Rad公司产品。PCR Master Mix试剂购自擎科生物技术有限公司,引物合成及DNA测序均交由擎科生物技术有限公司完成。
1.3.2 细菌培养与药敏试验采用VITEK 2 Compact全自动微生物分析系统进行菌株鉴定和药敏试验,部分药敏试验采用K-B纸片扩散法。质控菌株为大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853,购自卫生部临床检验中心。多重耐药菌(MDR)判定为对5类抗菌药物中(第三代头孢菌素、氟喹诺酮类、氨基糖苷类、碳青霉烯类、β-内酰胺/β-内酰胺酶抑制剂)3类或以上抗菌药物耐药的细菌。
1.3.3 细菌总DNA的提取煮沸法提取细菌DNA。
1.3.4 16S-23S rRNA基因间隔区序列分析引物序列及操作方法参见文献[9]。
1.3.5 PCR扩增OXA-51基因(1) 引物序列,上游引物:5’-TAATGCTTTGATCGGCCTTG-3’,下游引物:5’- TGGATTGCACTTCATCTTGG -3’。(2)反应体系(20 μL):2×PCR Mix 10 μL,上下游引物各0.5 μL,DNA模板5 μL,无核酸酶双蒸水4 μL。(3)扩增条件:95℃预变性5 min,95℃变性1 min,55℃退火30 s,72℃延伸30 s,共35个循环,最后72℃延伸10 min。扩增产物经1.5%的琼脂糖凝胶电泳,用凝胶成像系统观察结果并拍照,选取部分阳性基因扩增产物测序。
1.3.6 随机扩增多态性DNA(randomly amplified polymorphic DNA, RAPD)技术检测细菌同源性取细菌DNA模板进行同源性分析。(1)引物ERIC-2和DAF4参照文献[10]合成引物,DAF4:5’-CGGCAGCGCC-3’, ERIC-2:5’-AAGTAAGTGACTGGGGTGAGCG-3’。(2)反应体系(30 μL):2×PCR Mix 12.5 μL, ERIC-2引物5 μL, DAF4引物5 μL, DNA模板5 μL, 无核酸酶双蒸水2.5 μL。(3)扩增条件:94℃预变性2 min,94℃变性1 min,24℃退火1 min,75℃延伸2 min,共45个循环。扩增产物经1.5%的琼脂糖凝胶电泳,使用凝胶成像系统拍照后根据扩增带的有无统计所有细菌的二元数据。利用NTSYSpc version 2.10e软件对RAPD电泳结果进行遗传相似性聚类分析树状图。
1.4 统计学处理应用SPSS 22.0统计软件分析数据。计量资料用x±s表示,采用t检验或秩和检验;计数资料用例数(百分数)表示,采用χ2检验。P≤0.05为差异有统计学意义。
2 结果 2.1 16S-23S rRNA基因间隔区序列测序比对结果335株ACB包括皮特不动杆菌18株,医院不动杆菌23株和鲍曼不动杆菌284株,其余10株为不动杆菌属其他种的细菌(未列入分组)。
2.2 ACB感染患者临床资料及实验室检查结果见表 1。
| 表 1 325例ACB感染患者临床资料及实验室检查结果 Table 1 Clinical data and laboratory results of 325 patients with ACB infection |

|
皮特不动杆菌和医院不动杆菌对大部分抗菌药物的耐药率均低于鲍曼不动杆菌;皮特不动杆菌和医院不动杆菌对哌拉西林和头孢他啶的耐药率高,对其他抗菌药物的耐药率则均 < 50%。皮特不动杆菌与医院不动杆菌对11种抗菌药物的耐药率比较,差异均无统计学意义。见表 2。
| 表 2 325株ACB对11种抗菌药物的耐药情况 Table 2 Resistance of 325 strains of ACB to 11 kinds of antimicrobial agents |

|
18株皮特不动杆菌和23株医院不动杆菌均未见OXA-51基因扩增阳性,284株鲍曼不动杆菌OXA-51基因PCR检测均阳性。见图 1。
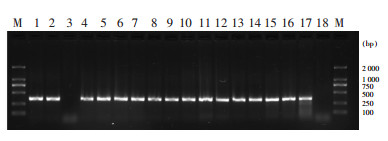 |
| M:DNA分子量标准;3、18泳道分别为皮特不动杆菌和医院不动杆菌临床分离株,其余为鲍曼不动杆菌临床分离株 图 1 ACB细菌OXA-51基因扩增产物电泳图 Figure 1 Electrophoresis map of amplified product of OXA-51 gene of ACB bacteria |
遗传相似性系数在0.65时,18株皮特不动杆菌可分为克隆A、B、C和D;23株医院不动杆菌分为克隆E、F、G和H。其中,克隆A(66.67%)、克隆F(56.52%)分别为皮特不动杆菌和医院不动杆菌的主要克隆。见图 2。
 |
| 注:a、b分别为皮特不动杆菌的RAPD电泳图、聚类分析树状图;c、d分别为医院不动杆菌的RAPD电泳图、聚类分析树状图 图 2 皮特不动杆菌和医院不动杆菌RAPD、聚类分析树状图 Figure 2 RAPD and dendrogram of cluster analysis of A. pittii and A. nosocomialis |
根据分子遗传学技术,不动杆菌至少可以分为45个基因型,其中28种已正式命名,以前的基因3型现为皮特不动杆菌,基因型13TU为医院不动杆菌[11]。在表型上此两种细菌与鲍曼不动杆菌十分接近,临床微生物实验室使用的商品化鉴定方法常会将其误鉴定为鲍曼不动杆菌[12-13],因此,皮特不动杆菌和医院不动杆菌在临床工作中少见报告。近年来,随着分子生物学鉴定方法的普及,越来越多文献报道临床分离皮特不动杆菌和医院不动杆菌相关的医院感染[1-4, 14]。本研究结果显示,鲍曼不动杆菌在ACB中最常见,其次为医院不动杆菌,皮特不动杆菌检出率仅为5.37%。医院不动杆菌和皮特不动杆菌占ACB临床分离株的12.24%,远低于以往报道的美国29%[1]、中国(台湾地区)24%~45%[2]、韩国50%[3]及挪威66%[4],说明不同国家或地区医院内菌群感染的流行方式及种群的进化程度不同。国内关于此两种细菌临床分布的文献报道较少,多中心研究及区域性细菌监测工作的重要性日益凸显,有条件的临床微生物实验室还应积极探索分子遗传学鉴定方法,以及应用现代质谱和测序技术对医院感染复合菌群及少见菌进行鉴定。
不同文献报道中皮特不动杆菌/医院不动杆菌的临床检出率存在较大差异,但大多数研究[1-6]认为,与感染鲍曼不动杆菌的患者相比,皮特不动杆菌或医院不动杆菌感染患者往往表现出更低的耐药率和病死率,以及更轻的并发症和更好的临床预后,因此,鲍曼不动杆菌和皮特不动杆菌/医院不动杆菌应该被视为不同的种群而区分对待。在本研究中,分离皮特不动杆菌或医院不动杆菌的患者均以男性为主,较鲍曼不动杆菌感染患者而言,此部分患者较年轻,血清球蛋白水平更高,可能具有较强的免疫力,从而抵御毒力较高细菌的定植与感染。本研究中鲍曼不动杆菌和皮特不动杆菌/医院不动杆菌分离患者间ICU入住率、侵入性操作情况、肺部感染率、住院期间死亡率比较,差异均有统计学意义,与其他文献[5-6]报道一致。机械通气往往跨越了咽喉部自然屏障,同时削弱气道纤毛清除系统功能,气管导管表面细菌生物被膜形成,并保护病原微生物不受抗菌药物以及宿主防御作用的影响,导致肺部感染的难治和反复发生[15]。因此,对于鲍曼不动杆菌感染患者或高危人群,应尽早拔管或采用有创-无创序贯通气策略,减少肺部感染的发生,进而降低患者的病死率。本研究中皮特不动杆菌和医院不动杆菌的MDR率和碳青霉烯类抗生素的使用率均低于鲍曼不动杆菌;除哌拉西林、头孢他啶和左氧氟沙星外,皮特不动杆菌和医院不动杆菌对其他抗菌药物,特别是碳青霉烯类抗生素的耐药率均低于鲍曼不动杆菌,提示临床实验室需使用分子遗传学方法对ACB进行准确鉴定,有助于临床医生合理选择抗菌药物,降低碳青霉烯类抗生素的选择压力,缩短住院时间,减轻患者痛苦,降低社会、医院、患者的经济负担。
blaOXA-51-like是一大类鲍曼不动杆菌天然携带的D类β-内酰胺酶基因,多定位在染色体上并具有很高的种属特异性[16]。然而,也有研究[17]报道含ISAba1-blaOXA-51-like的质粒在鲍曼不动杆菌和医院不动杆菌间互相播散。本组皮特不动杆菌和医院不动杆菌均未扩增出OXA-51基因,284株鲍曼不动杆菌OXA-51基因PCR检测均阳性,OXA-51基因扩增在快速区分鲍曼不动杆菌和皮特不动杆菌/医院不动杆菌中的敏感性和特异性均为100%,与王贺等[13]研究结果一致。本研究结果提示,OXA-51基因扩增可以作为一种简便快捷、成本低廉且易于推广的技术,作为临床微生物实验室商品化表型鉴定系统的补充。
本研究RAPD分型结果显示,遗传相似性系数在0.65时,18株皮特不动杆菌和23株医院不动杆菌均可分为4个不同的克隆,其中克隆A和克隆F分别为皮特不动杆菌、医院不动杆菌的流行株,提示该院存在医院内皮特不动杆菌和医院不动杆菌的克隆传播或科室间的交叉感染。根据RAPD基因分型结果可以推断,细菌克隆株的传播流行可能是皮特不动杆菌和医院不动杆菌医院感染逐年增加的主要原因之一。
皮特不动杆菌和医院不动杆菌已成为医院感染的重要病原菌之一,区域性细菌耐药监测工作应正确区分该菌群。临床微生物实验室开展ACB的准确鉴定对于病原菌流行病学调查具有重要的意义。OXA-51基因扩增可以考虑作为一种简便快捷的分子生物学技术应用于皮特不动杆菌和医院不动杆菌的快速鉴定。临床微生物实验室应加强对皮特不动杆菌和医院不动杆菌的检测和监控,以期为临床合理使用抗菌药物及控制医院克隆株播散提供实验室依据。
| [1] |
Wisplinghoff H, Paulus T, Lugenheim M, et al. Nosocomial bloodstream infections due to Acinetobacter baumannii, Acinetobacter pittii and Acinetobacter nosocomialis in the United States[J]. J Infect, 2012, 64(3): 282-290. DOI:10.1016/j.jinf.2011.12.008 |
| [2] |
Ko WC, Lee NY, Su SC, et al. Oligonucleotide array-based identification of species in the Acinetobacter calcoaceticus-A. baumannii complex in isolates from blood cultures and antimicrobial susceptibility testing of the isolates[J]. J Clin Microbiol, 2008, 46(6): 2052-2059. DOI:10.1128/JCM.00014-08 |
| [3] |
Park KH, Shin JH, Lee SY, et al. The clinical characteristics, carbapenem resistance, and outcome of Acinetobacter bacteremia according to genospecies[J]. PloS One, 2013, 8(6): e65026. |
| [4] |
Karah N, Haldorsen B, Hegstad K, et al. Species identification and molecular characterization of Acinetobacter spp. blood culture isolates from Norway[J]. J Antimicrob Chemother, 2011, 66(4): 738-744. DOI:10.1093/jac/dkq521 |
| [5] |
Pailhoriès H, Tiry C, Eveillard M, et al. Acinetobacter pittii isolated more frequently than Acinetobacter baumannii in blood cultures:the experience of a French hospital[J]. J Hosp Infect, 2018, 99(3): 360-363. DOI:10.1016/j.jhin.2018.03.019 |
| [6] |
Chen L, Yuan J, Xu Y, et al. Comparison of clinical manifestations and antibiotic resistances among three genospecies of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex[J]. PLoS One, 2018, 13(2): e0191748. DOI:10.1371/journal.pone.0191748 |
| [7] |
朱善军, 倪晓艳, 吴巧珍, 等. 吴江地区多重耐药鲍曼不动杆菌碳青霉烯酶基因型携带情况及同源性[J]. 中国感染控制杂志, 2016, 15(12): 913-916. DOI:10.3969/j.issn.1671-9638.2016.12.004 |
| [8] |
金亮, 李达, 王勇雁, 等. 2012~2016年鲍曼不动杆菌分布及耐药变化趋势分布[J]. 临床输血与检验, 2017, 19(6): 585-589. DOI:10.3969/j.issn.1671-2587.2017.06.016 |
| [9] |
吴伟根, 黄永禄, 杨旭峰, 等. 基质辅助激光解吸/电离飞行时间质谱仪在醋酸钙鲍曼不动杆菌复合群鉴定中的应用研究[J]. 中华检验医学杂志, 2013, 36(12): 1115-1119. DOI:10.3760/cma.j.issn.1009-9158.2013.12.012 |
| [10] |
Grundmann HJ, Towner KJ, Dijkshoorn L, et al. Multicenter study using standardized protocols and reagents for evaluation of reproducibility of PCR-based fingerprinting of Acinetobacter spp.[J]. J Clin Microbiol, 1997, 35(12): 3071-3077. |
| [11] |
Nemec A, Krizova L, Maixnerova M, et al. Genotypic and phenotypic characterization of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex with the proposal of Acinetobacter pittii sp. nov. (formerly Acinetobacter genomic species 3) and Acinetobacter nosocomialis sp. nov. (formerly Acinetobacter genomic species 13TU)[J]. Res Microbiol, 2011, 162(4): 393-404. DOI:10.1016/j.resmic.2011.02.006 |
| [12] |
Golanbar GD, Lam CK, Chu YM, et al. Phenotypic and molecular characterization of Acinetobacter clinical isolates obtained from inmates of California correctional facilities[J]. J Clin Microbiol, 2011, 49(6): 2121-2131. DOI:10.1128/JCM.02373-10 |
| [13] |
王贺, 王辉, 徐英春, 等. 自动化细菌鉴定仪和碳青霉烯酶基因OXA-51扩增在不动杆菌属细菌鉴定中的价值[J]. 中华检验医学杂志, 2009, 32(1): 83-87. DOI:10.3760/cma.j.issn.1009-9158.2009.01.022 |
| [14] |
邓德耀, 袁文丽, 张唤. 医院感染pittii不动杆菌的研究进展[J]. 中华医院感染学杂志, 2015, 25(1): 238-240. |
| [15] |
潘冬青, 王水珠. 以肺部感染控制窗为切换点序贯机械通气治疗慢性阻塞性肺疾病并严重呼吸衰竭的体会[J]. 中国医药指南, 2011, 9(26): 281-282. DOI:10.3969/j.issn.1671-8194.2011.26.220 |
| [16] |
Akbari M, Niakan M, Taherikalani M, et al. Rapid identification of Iranian Acinetobacter baumannii strains by single PCR assay using BLA OXA-51-like carbapenemase and evaluation of the antimicrobial resistance profiles of the isolates[J]. Acta Microbiol Immunol Hung, 2010, 57(2): 87-94. DOI:10.1556/AMicr.57.2010.2.2 |
| [17] |
邓德耀, 袁文丽, 刘春林. OXA-51型β内酰胺酶的研究进展[J]. 中国感染与化疗杂志, 2014, 14(5): 451-454. DOI:10.3969/j.issn.1009-7708.2014.05.024 |




 唑
唑