2. 湖北文理学院附属医院 襄阳市中心医院妇产科, 湖北 襄阳 441021;
3. 湖北文理学院附属医院 襄阳市中心医院检验科, 湖北 襄阳 441021;
4. 湖北文理学院附属医院 襄阳市中心医院内分泌科, 湖北 襄阳 441021;
5. 湖北文理学院附属医院 襄阳市中心医院呼吸内科, 湖北 襄阳 441021
2. Department of Gynecology and Obstetrics, Xiang-yang Central Hospital, Affiliated Hospital of Hubei University of Arts and Sciences, Xiang-yang 441021, China;
3. Department of Laboratory Medicine, Xiang-yang Central Hospital, Affiliated Hospital of Hubei University of Arts and Sciences, Xiang-yang 441021, China;
4. Department of Endocrinology, Xiang-yang Central Hospital, Affiliated Hospital of Hubei University of Arts and Sciences, Xiang-yang 441021, China;
5. Department of Respiratory Medicine, Xiang-yang Central Hospital, Affiliated Hospital of Hubei University of Arts and Sciences, Xiang-yang 441021, China
糖尿病是我国人群的高发疾病之一,且其发病率呈上升趋势。由于糖尿病患者存在潜在的免疫系统功能障碍,因此,比其他住院患者更容易发生感染。流行病学调查显示,糖尿病患者医院感染的发病率远高于非糖尿病患者,且以多重耐药菌感染增长速度最快,而非糖尿病患者医院感染发病率无明显上升趋势[1]。López-de-Andrés等[2]对西班牙2004—2013年8 751例2型糖尿病合并肺部感染患者的流行病学特征进行调查,结果显示,随着糖尿病患者病程延长,其肺部感染率呈直线上升趋势,存活率呈直线下降趋势。国内文献报道,糖尿病患者一旦发生多重耐药菌感染,病死率高达50%以上[3]。肺部感染是糖尿病患者常见的医院感染,占50%左右[4]。糖尿病患者年龄越大、病程越长,其血管脆性增加,血糖控制差、波动幅度较大,易伴随多种并发症、免疫功能逐渐衰退等,且长期高糖环境适宜病原菌侵入、繁殖等,因此,发生医院感染的风险显著上升,同时感染细菌谱及耐药性也不相同。马卫东[5]报道,糖尿病病程≥10年是糖尿病患者发生医院感染的独立危险因素之一。因此,本研究以糖尿病合并肺部感染患者为研究对象,探讨不同病程糖尿病合并肺部感染患者的病原菌分布及耐药性差异,以期为临床医生早期应用抗菌药物提供指导。
1 对象与方法 1.1 研究对象选取2015年1月—2018年10月某院收治的2型糖尿病合并肺部感染患者。按照糖尿病病程分为两组,糖尿病病程≥10年的患者纳入长病程组,糖尿病病程<10年的患者纳入短病程组。糖尿病病程:以患者首次确诊为2型糖尿病为起点,以笔者对患者进行筛选时选定的截止日期为终点,二者的时间差即为糖尿病病程,单位均以“年”计算。排除标准:(1)伴有其他部位感染病史患者;(2)首次采集标本前已使用抗菌药物的患者;(3)存在免疫系统疾病的患者;(4)临床资料不齐全的患者。医院伦理委员会已批准本次研究。
1.2 诊断标准 1.2.1 糖尿病诊断标准参照《美国糖尿病协会2010糖尿病诊疗指南》[6],即空腹血糖(FPG)≥7.0 mmol/L,餐后2 h血糖≥11 mmol/L。
1.2.2 肺部感染诊断标准根据中华医学会呼吸病学分会制定的肺部感染标准[7],符合胸部X射线检查结果为片状或者斑状阴影,肺部伴有间质性改变,并包括以下四项中任意一项:(1)肺炎实体病变;(2)发热;(3)原呼吸道症状加重或者新出现咳嗽、咳痰;(4)白细胞显著升高(>10×109/L)或者显著降低(<4×109/L),并排除肺结核、肺部肿瘤等疾病。
1.3 痰标本采集在患者使用抗菌药物之前,选取清晨用生理盐水漱口3次后的支气管深部痰液,无痰或痰少不易咳出者可用45℃ 10%氯化钠溶液雾化吸入导痰,已经建立人工气道的患者,使用一次性无菌专用吸痰管抽吸痰液。所有采集的痰标本均经细胞学检查为合格标本:鳞状上皮细胞<10个/低倍视野,多核白细胞>25个/低倍视野,或者二者比例<1:2.5,不合格的标本重新取样涂片,直至采到合格标本为止。
1.4 细菌鉴别与药敏监测按《全国临床检验操作规程(第3版)》要求进行接种、培养,标本采集先涂片,应用VYTEK-32微生物全自动分析仪(法国生物梅里埃公司生产)鉴定菌株。体外药敏试验采用Kirby-Bauer琼脂扩散法,敏感度判断依据美国临床实验室标准化协会(CLSI)2010年文件判定,同一患者多次检出的相同菌株不重复计入,耐药性分析根据首次药敏结果计入。
1.5 产超广谱β-内酰胺酶(ESBLs)及耐甲氧西林金黄色葡萄球菌(MRSA)菌株的确定按照标准纸片扩散法药敏试验,将菌液涂布到M-H平板,用头孢他啶和头孢他啶+克拉维酸、头孢噻肟和头孢噻肟+克拉维酸药敏纸片分别对可疑菌株进行试验,测量两种纸片及加克拉维酸后的抑菌环直径。当任何复合抗菌药物药敏纸片的抑菌圈直径比单一抗菌药物药敏纸片的抑菌圈直径≥5 mm,即可确认为ESBLs阳性菌株。用头孢西丁监测MRSA。
1.6 质控菌株质控细菌为金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603、铜绿假单胞菌ATCC 27853,均购自于卫生部生物制品研究所。
1.7 统计学方法应用SPSS 20.0软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,组间比较采用t检验;计数资料采用构成比(%)表示,组间比较采用χ2检验。以P≤0.05为差异有统计学意义。
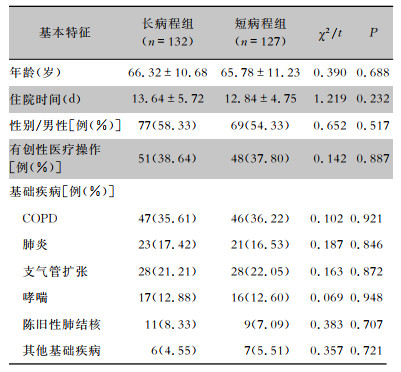
2 结果 2.1 基本情况长病程组纳入132例,其中男性77例,女性55例,平均年龄(66.32±10.68)岁,有创性医疗操作51例,住院时间(13.64±5.72)d,基础疾病中慢性阻塞性肺疾病(COPD)47例、支气管扩张28例、肺炎23例、哮喘17例、陈旧性肺结核11例、其他6例。短病程组127例,其中男性69例,女性58例,平均年龄(65.78±11.23)岁,有创性医疗操作48例,住院时间(12.84±4.75)d,原患疾病中COPD 46例、支气管扩张28例、肺炎21例、哮喘16例、陈旧性肺结核10例、其他6例。两组患者年龄、性别及基础疾病等比较,差异均无统计学意义(均P>0.05),资料具有可比性。见表 1。
| 表 1 长病程组与短病程组糖尿病合并肺部感染患者的基本特征 Table 1 Basic characteristics of patients in LC group and SC group with diabetes mellitus complicated with pulmonary infection |
|
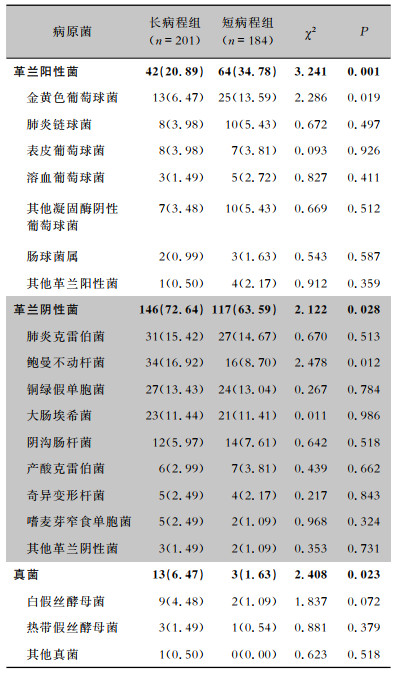
共分离病原菌385株,长病程组分离201株,其中革兰阳性菌42株(20.89%)、革兰阴性菌146株(72.64%)、真菌13株(6.47%);短病程组分离184株,革兰阳性菌64株(34.87%)、革兰阴性菌117株(63.59%)、真菌3株(1.63%)。长病程组检出革兰阴性菌和真菌的比例高于短病程组,检出革兰阳性菌的比例低于短病程组;长病程组检出鲍曼不动杆菌的比例高于短病程组,检出金黄色葡萄球菌的比例低于短病程组;差异均有统计学意义(均P<0.05)。见表 2。
| 表 2 长病程组与短病程组糖尿病合并肺部感染患者病原菌分布[株(%)] Table 2 Distribution of pathogens from patients in LC group and SC group with diabetes mellitus complicated with pulmonary infection (No. of isolate [%]) |
|
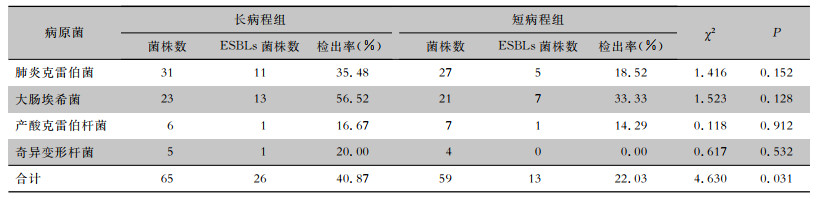
长病程组65株细菌中检出26株产ESBLs菌株,检出率为40.87%;短病程组59株细菌中检出13株产ESBLs菌株,检出率为22.03%,差异有统计学意义(P<0.05)。两组患者各种菌株产ESBLs菌株检出率比较,差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 长病程组与短病程组患者ESBLs菌株检出情况比较 Table 3 Comparison of isolation of ESBLs-producing strains between patients in LC group and SC group |
|
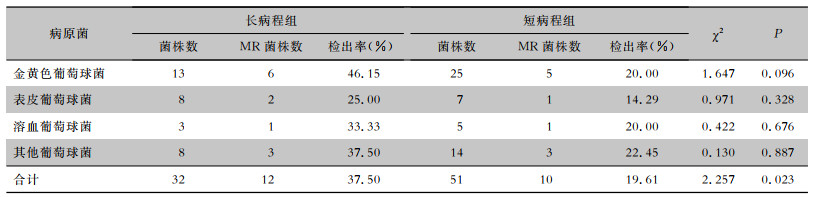
长病程组的32株葡萄球菌属细菌中检出12株MR菌株,检出率为37.50 %;短病程组的51株葡萄球菌属细菌中检出10株MR菌株,检出率为19.61 %,差异有统计学意义(P<0.05)。两组患者检出的各种葡萄球菌中MR菌株的检出率比较,差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 长病程组与短病程组患者葡萄球菌属细菌MR菌株检出情况比较 Table 4 Comparison of isolation of MR Staphylococcus strains between patients in LC group and SC group |
|
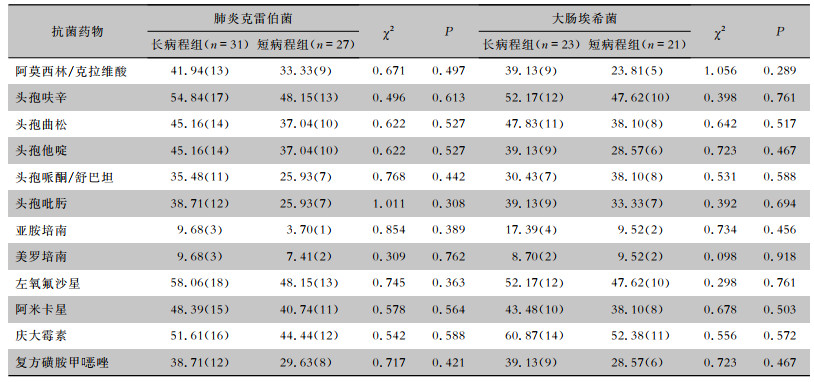
肺炎克雷伯菌对头孢呋辛、左氧氟沙星的耐药率均>50%,对碳青霉烯类药物的耐药率<10%。大肠埃希菌对头孢呋辛、左氧氟沙星、庆大霉素的耐药率均≥50%,对碳青霉烯类药物的耐药率<15%。两组患者检出的肺炎克雷伯菌与大肠埃希菌对常用抗菌药物的耐药率比较,差异均无统计学意义(均P>0.05)。见表 5。
| 表 5 长病程组与短病程组患者检出肺炎克雷伯菌和大肠埃希菌对常用抗菌药物的耐药情况比较[%(株)] Table 5 Comparison of antimicrobial resistance of Escherichia coli and Klebsiella pneumoniae between patients in LC group and SC group (%[No. of isolates]) |
|
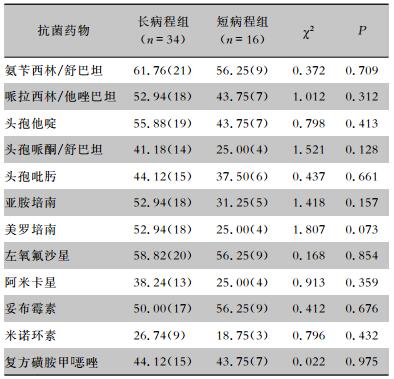
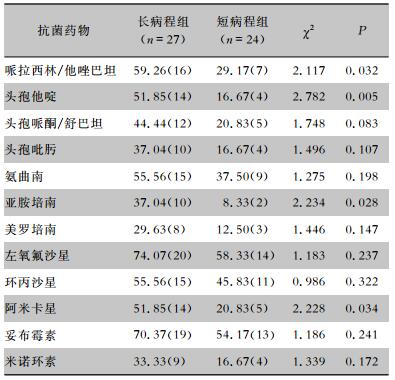
鲍曼不动杆菌对氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢他啶、左氧氟沙星、妥布霉素的耐药率均≥50%,对米诺环素的耐药率最低,为24.00%。两组患者检出鲍曼不动杆菌对常用抗菌药物的耐药率比较,差异均无统计学意义(均P>0.05)。见表 6。铜绿假单胞菌对左氧氟沙星、环丙沙星、妥布霉素的耐药率>50%,对碳青霉烯类药物的耐药率最低(<24%)。长病程组患者检出铜绿假单胞菌对哌拉西林/他唑巴坦、头孢他啶、亚胺培南和阿米卡星的耐药率均高于短病程组,差异有统计学意义(均P<0.05)。见表 7。
| 表 6 长病程组与短病程组患者检出鲍曼不动杆菌对常用抗菌药物的耐药情况比较[%(株)] Table 6 Comparison of antimicrobial resistance of Acinetobacter baumannii between patients in LC group and SC group (%[No. of isolates]) |
|
| 表 7 长病程组与短病程组患者检出铜绿假单胞菌对常用抗菌药物的耐药情况比较[%(株)] Table 7 Comparison of antimicrobial resistance of Pseudomonas aeruginosa between patients in LC group and SC group (%[No. of isolates]) |
|
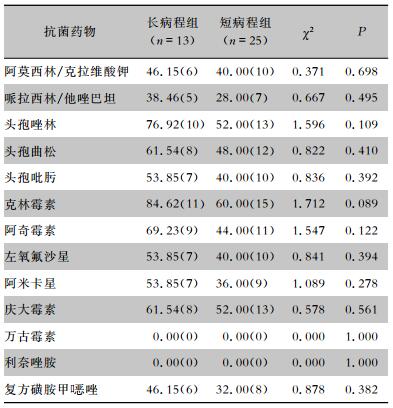
金黄色葡萄球菌对头孢唑林、头孢曲松、克林霉素、阿奇霉素、庆大霉素的耐药率均>50%,对万古霉素、利奈唑胺均敏感。两组患者检出金黄色葡萄球菌对常用抗菌药物的耐药率比较,差异均无统计学意义(均P>0.05)。见表 8。
| 表 8 长病程组与短病程组患者检出金黄色葡萄球菌对常用抗菌药物的耐药情况比较[%(株)] Table 8 Comparison of antimicrobial resistance of Staphylococcus aureus between patients in LC group and SC group (%[No. of isolates]) |
|
糖尿病患者因酮症酸中毒易发生昏迷,在治疗时需要长期卧床,严重者常需要行气管插管、机械辅助呼吸,此类操作均涉及呼吸道,因此,糖尿病合并肺部感染非常常见。糖尿病和非糖尿病患者合并肺部感染病原菌并不完全相同。周辉[8]报道,糖尿病合并肺部感染患者检出革兰阴性菌的比例大于非糖尿病患者,检出革兰阳性菌的比例小于非糖尿病患者。本研究结果显示,糖尿病合并肺部感染患者的病原菌以革兰阴性菌为主,革兰阳性菌和真菌较少,其中以肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌和金黄色葡萄球菌最常见。结果与相关研究[9-10]报道的基本一致,但与沈小燕等[11]报道的不一致。沈小燕等[11]报道,2型糖尿病合并肺部感染病原菌以真菌为主(51.4%),其次为革兰阴性菌(31.9%),可能与不同地区医疗机构环境定植病原菌的差异有关。
文献[5-6]报道,糖尿病患者的年龄、病程、有创性医疗操作、住院时间和原患疾病等均是医院感染的独立危险因素。本研究中,长病程组和短病程组患者的年龄、性别、有创性医疗操作、住院时间和原患疾病等均无显著性差异,可以排除上述因素对研究结果的影响。结果显示,不同病程组患者肺部感染病原菌分布存在差异。长病程组患者检出革兰阴性菌和真菌的比例大于短病程组,革兰阳性菌检出比例小于短病程组,其中鲍曼不动杆菌检出比例大于>短病程组,金黄色葡萄球菌检出比例小于短病程组,长病程组肠杆菌科细菌产ESBLs菌株和葡萄球菌属细菌MR菌株的检出率均大于短病程组,差异均具有统计学意义(P<0.05)。可能与糖尿病患者机体免疫水平和并发症有关。鲍曼不动杆菌为定植于人体呼吸道、消化道和泌尿生殖道中的条件致病菌,基础性疾病重、免疫功能低下、机械通气、合并糖尿病、住院时间长及反复使用抗菌药物的患者是鲍曼不动杆菌感染的危险因素[12]。糖尿病患者易出现多种并发症,体内各个脏器功能也可能受到影响,身体机能下降,抵抗力减弱,一般而言,糖尿病病程越长,其机体免疫力水平越低。王栋等[13]报道,2型糖尿病患者CD4、CD3和CD8明显下降,T细胞亚群和血糖控制情况及病程长短有关,血糖控制理想患者的T细胞亚群数量较血糖控制不良患者明显升高,病程越长,T细胞亚群数量越低。因此,长病程糖尿病患者感染鲍曼不动杆菌的风险大大提高。冯玉等[14]报道,该院糖尿病患者鲍曼不动杆菌的分离率为8.09%,而且随着糖尿病病程的延长,鲍曼不动杆菌的分离率也有所增加。文献报道,糖尿病患者病史长、免疫功能低下及滥用抗菌药物引起的二重感染等与糖尿病患者发生真菌医院感染相关[15]。
药敏结果表明,肺炎克雷伯菌和大肠埃希菌对头孢呋辛、左氧氟沙星的耐药率≥50%;鲍曼不动杆菌对氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢他啶、左氧氟沙星、妥布霉素的耐药率均≥50%;铜绿假单胞菌对左氧氟沙星、环丙沙星、妥布霉素的耐药率>50%;金黄色葡萄球菌对头孢唑林、头孢曲松、克林霉素、阿奇霉素、庆大霉素的耐药率均>50%。与细菌产ESBLs、青霉素结合蛋白2a(PBP2a)的突变有关[16-17],提示该院糖尿病合并肺部感染的常见病原菌耐药形式非常严峻,应引起高度重视。对不同病程糖尿病患者分离出的病原菌耐药率进行比较,长病程组病原菌对常用抗菌药物的耐药率稍高于短病程组,可能与长病程组患者糖尿病病程长,并发症多,机体反复感染,反复住院治疗及使用广谱抗菌药物,从而使细菌耐药增加有关。但仅长病程组检出的铜绿假单胞菌对哌拉西林/他唑巴坦、头孢他啶、亚胺培南和阿米卡星的耐药率高于短病程组(P<0.05),其余均无统计学意义(P>0.05),可能与纳入样本量较少有关。
综上所述,糖尿病是肺部感染的危险因素之一,也是影响感染预后的重要因素。本研究结果显示,不同病程糖尿病患者合并肺部感染的病原菌分布和耐药性存在差异。因此,在临床上选择抗菌药物时应区别对待。
| [1] |
卢健聪, 夏晓英. 糖尿病患者院内多重耐药菌感染的流行特征分析[J]. 广东医学, 2015, 36(2): 252-254. |
| [2] |
López-de-Andrés A, de Miguel-Díez J, Jiménez-Trujillo I, et al. Hospitalisation with community-acquired pneumonia among patients with type 2 diabetes:an observational population-based study in Spain from 2004 to 2013[J]. BMJ Open, 2017, 7(1): e013097. DOI:10.1136/bmjopen-2016-013097 |
| [3] |
唐光敏, 余叶蓉, 王艳丽. 华西医院1996-2004年住院成人糖尿病患者病死率及死因分析[J]. 中国糖尿病杂志, 2008, 16(10): 598-600. DOI:10.3321/j.issn:1006-6187.2008.10.008 |
| [4] |
陈春莺. 2型糖尿病患者医院感染调查分析[J]. 中国感染控制杂志, 2010, 9(5): 369-370. DOI:10.3969/j.issn.1671-9638.2010.05.020 |
| [5] |
马卫东. 老年糖尿病患者院内感染危险因素分析[J]. 广西医学, 2014, 36(11): 1643-1645. |
| [6] |
卢胜家, 邵婷婷. 老年2型糖尿病患者合并肺部感染的危险因素[J]. 中国老年学杂志, 2018, 38(13): 3105-3107. DOI:10.3969/j.issn.1005-9202.2018.13.013 |
| [7] |
中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 |
| [8] |
周辉. 98例糖尿病和非糖尿病肺部感染患者的病原学及耐药性分析[J]. 中国现代医学杂志, 2009, 19(8): 1215-1217. DOI:10.3969/j.issn.1005-8982.2009.08.026 |
| [9] |
王力鹏, 陈军, 罗穆玲, 等. 老年糖尿病患者肺部感染病原菌分布及耐药性研究[J]. 中国消毒学杂志, 2018, 35(3): 233-235. |
| [10] |
杨玉华, 曹秀萍, 吴庆勇, 等. 糖尿病并发获得性肺部感染患者病原菌分布及药物敏感性研究[J]. 中华医院感染学杂志, 2017, 27(18): 4143-4146. |
| [11] |
沈小燕, 陈刚, 林丽香. 2型糖尿病合并肺部感染患者临床分析[J]. 中国糖尿病杂志, 2009, 17(12): 935-938. DOI:10.3969/j.issn.1006-6187.2009.12.019 |
| [12] |
王立万, 邹琳, 李洪霞, 等. 泛耐药鲍曼不动杆菌所致呼吸机相关肺炎的临床疗效分析[J]. 中国医学科学院学报, 2014, 36(2): 185-188. DOI:10.3881/j.issn.1000-503X.2014.02.013 |
| [13] |
王栋, 于宗学, 杨竞, 等. 2型糖尿病患者T细胞亚群与血糖控制及病程关系的研究[J]. 中国老年学杂志, 2005, 25(11): 1292-1293. DOI:10.3969/j.issn.1005-9202.2005.11.002 |
| [14] |
冯玉, 左壮, 沈健. 糖尿病患者鲍曼不动杆菌感染监测[J]. 中国消毒学杂志, 2012, 29(12): 1100-1101, 1104. |
| [15] |
李珍瑾, 王艳萍, 郑少雄. 2型糖尿病合并肺部感染患者的细菌谱及药敏分析[J]. 山东医药, 2011, 51(33): 56-57. DOI:10.3969/j.issn.1002-266X.2011.33.033 |
| [16] |
Gazin M, Paasch F, Goossens H, et al. Current trends in culture-based and molecular detection of extended-spectrum-β-lactamase-harboring and carbapenem-resistant Enterobacteriaceae[J]. Clin Microbiol, 2012, 50(4): 1140-1146. DOI:10.1128/JCM.06852-11 |
| [17] |
冯明. 耐甲氧西林金黄色葡萄球菌的检测与耐药性的研究进展[J]. 中国医药导报, 2012, 9(2): 8-10. DOI:10.3969/j.issn.1673-7210.2012.02.003 |




 唑
唑