2. 广州市番禺区何贤纪念医院神经内科, 广东 广州 510000
2. Department of Neurology, Panyu Hexian Memorial Hospital of Guangzhou, Guangzhou 510000, China
医院获得性肺炎(hospital-acquired pneumonia, HAP)是常见的医院感染类型之一,大规模医院感染现患率调查结果[1-2]显示,住院患者中医院获得性感染发生率为3.22%~5.22%,其中HAP约占一半。HAP严重影响患者疾病预后,增加经济负担,通常成为医院质量持续改进的重点。HAP主要宿主危险因素有高龄、误吸、基础疾病(糖尿病、慢性阻塞性肺疾病等)、免疫功能受损、颅脑等严重创伤、电解质紊乱等[3]。目前HAP有效预测模型较少,对HAP早期采取干预措施有一定的影响。
卒中相关性肺炎(stroke-associated pneumonia, SAP)是指非机械通气的卒中患者在发病7 d内新出现的肺炎。SAP是卒中患者常见的并发症之一,发病率为2.4%~47%。研究[4-7]表明,SAP不仅延长患者住院时间,增加住院费用,也是卒中患者死亡的重要危险因素之一。SAP的危险因素包括高龄、男性、基础疾病(糖尿病、高血压、房颤、充血性心力衰竭、慢性阻塞性肺疾病等)、吞咽困难、病情严重程度、白细胞升高等[4-7]。为了尽早识别高风险患者,集中资源采取干预措施,改善患者预后,近年来国内外已经建立多个SAP预测量表,包括Kwon等评分量表[8]、Sellars等评分量表[9]、Chumbler等评分量表[10]、A2DS2量表[11]、PANTHERIS量表[12]、ASI-APS量表[13]、ISAN量表[14],各量表预测性能尚可。
缺血性脑卒中患者HAP很大一部分属于SAP,但受入院48 h后发生的时间限制,故又不同于SAP。HAP与SAP在危险因素上有很多相似之处,因此, 本研究试图使用之前公布的SAP预测量表检验其在缺血性脑卒中患者HAP中的应用效果,为HAP预测量表的建立提供参考依据。
1 资料与方法 1.1 资料来源收集某二级综合医院2015—2018年入住神经内科的所有缺血性脑卒中患者的病历资料进行分析。
1.2 诊断标准HAP诊断依据2001年卫生部颁布的《医院感染诊断标准(试行)》中下呼吸道感染诊断标准执行[15],SAP诊断依据《卒中相关性肺炎的诊断》执行[16]。
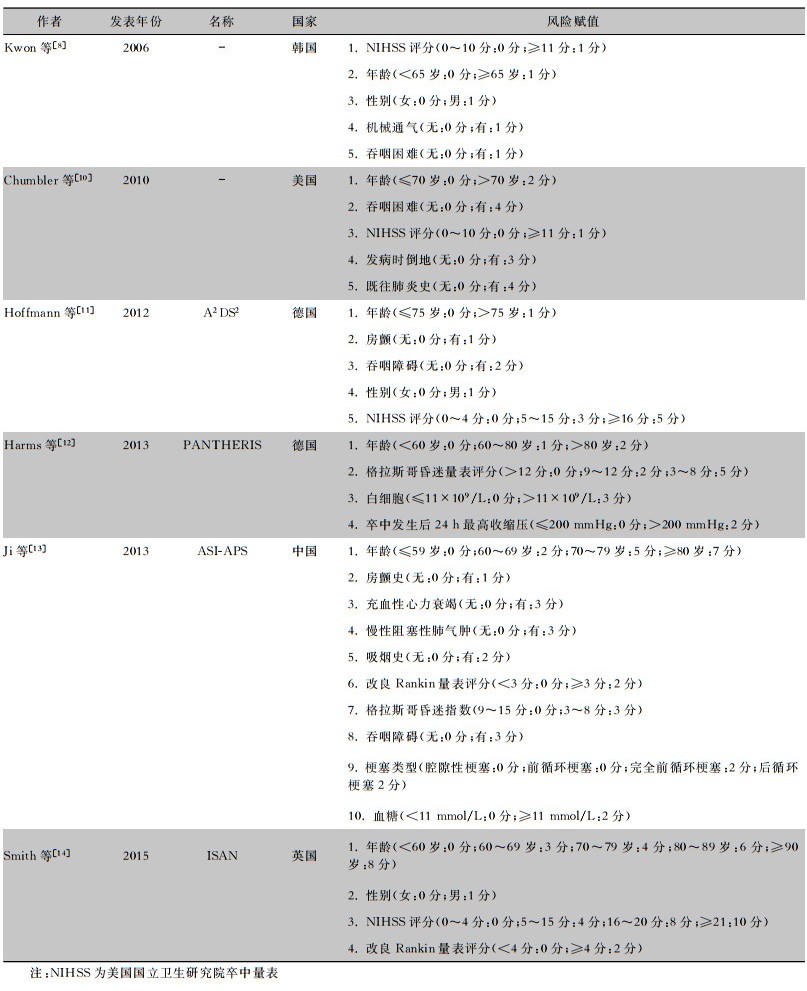
1.3 研究工具选取6个SAP预测量表:Kwon等评分量表、Chumbler等评分量表、A2DS2量表、PANTHERIS量表、ASI-APS量表、ISAN量表。6个SAP预测量表的基本情况见表 1。
| 表 1 6个SAP预测量表的基本情况 Table 1 Basic information of 6 SAP predictive scales |
|
由神经内科医院感染监控医生、护士收集调查资料,包括基本信息:性别、年龄;既往史:房颤史、充血性心力衰竭史、肺炎史、慢性阻塞性肺疾病史、饮酒史、吸烟史;一般体格检查:发病时是否倒地,卒中发生后24 h内最高收缩压、是否吞咽困难(洼田饮水试验,入院4 h内评估)、改良Rakin量表评分;卒中相关性评分:NIHSS评分、格拉斯哥昏迷量表评分;实验室检查:入院时血糖、卒中发生后24 h内最高白细胞等;缺血性脑卒中类型:腔隙性梗塞、前循环梗塞、完全前循环梗塞、后循环梗塞;有无使用呼吸机治疗;是否发生HAP、SAP等。
1.5 统计分析采用受试者工作特征曲线(ROC)对SAP预测量表在缺血性脑卒中患者HAP判别能力的应用情况进行分析。通过计算ROC曲线下面积(AUC)评估各预测量表性能,如果AUC在0.5附近,说明该模型不优于随机预测模型,如果AUC为1.0,说明该模型能完美预测出所有病例结局,对于临床研究而言,模型性能统计量至少应>0.7[17-18]。运用SPSS 22.0计算AUC、约登指数、截断值,用MedCalc绘制ROC曲线,进行曲线差异性检验,以P≤0.05为差异具有统计学意义。
2 结果 2.1 基本情况共收集某院2015—2018年缺血性脑卒中患者628例。其中男性313例,占49.84%;年龄31~91岁,中位数为69岁。
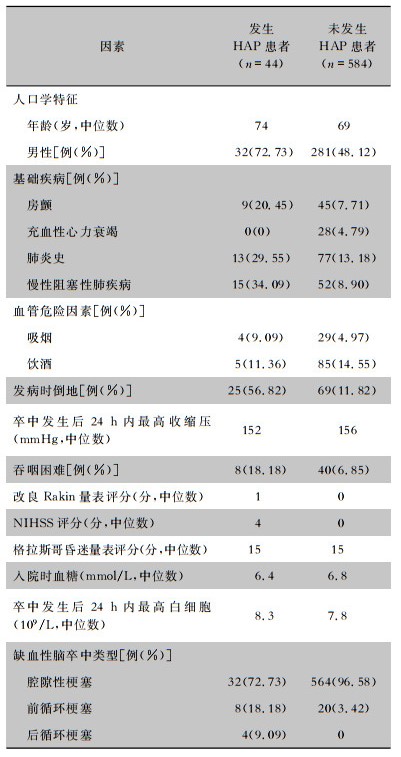
2.2 发生HAP患者的基本特征628例缺血性脑卒中患者共发生SAP 46例、HAP 44例,SAP发生率为7.32%,HAP发生率为7.01%。见表 2。
| 表 2 628例缺血性脑卒中患者基本情况 Table 2 Basic information of 628 patients with ischemic stroke |
|
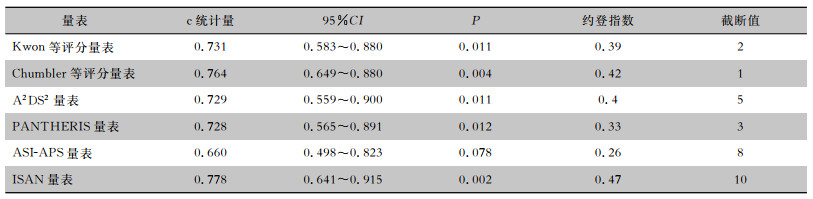
Kwon等评分量表、Chumbler等评分量表、A2DS2量表、PANTHERIS量表、ASI-APS量表、ISAN量表的c统计量分别为0.731、0.764、0.729、0.728、0.660、0.778,除ASI-APS量表外,其他量表差异均有统计学意义(P<0.05),见图 1、表 3。对量表曲线下面积进行两两比较,差异均无统计学意义(均P>0.05),见表 4。
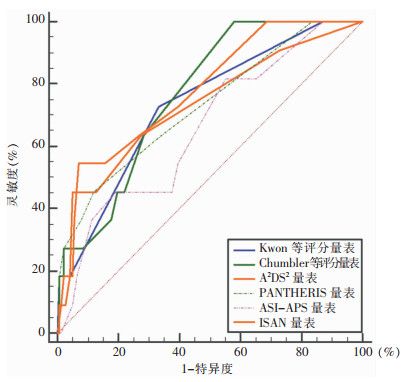 |
| 图 1 各量表预测缺血性脑卒中患者HAP发生的ROC曲线 Figure 1 ROC curve of each scale for predicting occurrence of HAP in patients with ischemic stroke |
| 表 3 各量表预测缺血性脑卒中患者HAP发生的性能 Table 3 Performance of each scale in predicting occurrence of HAP in patients with ischemic stroke |
|
| 表 4 各量表预测缺血性脑卒中患者HAP发生ROC曲线下面积两两比较(P) Table 4 Pairwise comparison in the area under ROC curve of each scale in predicting HAP occurrence in patients with ischemic stroke (P) |
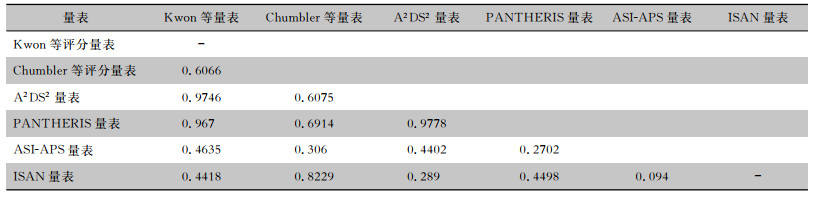
|
各量表HAP预测性能与报道SAP预测性能[10-14]对比,Chumbler等评分量表和ISAN量表在预测HAP和SAP中的性能差异较小,见图 2。
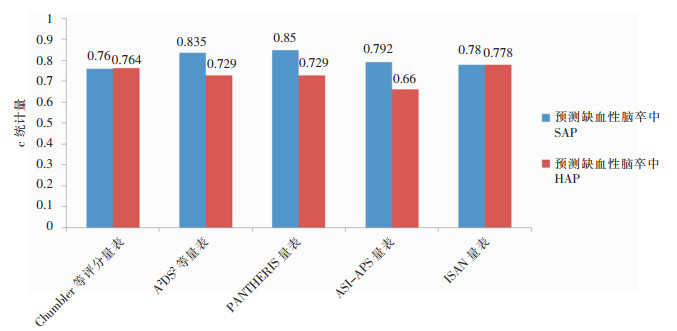 |
| 图 2 各量表预测缺血性脑卒中患者HAP与报道预测SAP量表性能比较 Figure 2 Comparison of the performance of each scale in predicting HAP and reported SAP in patients with ischemic stroke |
本研究收集了某院神经内科所有缺血性脑卒中患者的资料,对不同SAP预测量表在缺血性脑卒中患者HAP的应用进行效度分析。结果显示,不同SAP预测量表对缺血性脑卒中患者HAP的预测性能尚可,除ASI-APS量表外,其他量表的c统计量均>0.7。HAP是医院感染的主要类型之一,可以显著延长患者住院时间。因此,了解HAP的危险因素非常重要,并且有助于改进医疗质量。然而,因为目前信息系统不完善、数据收集不统一、定义不十分明确,使得建立HAP的预测量表非常困难。本研究试图通过前瞻性的研究解决这一问题。
HAP建立预测模型的难点在于不同患者的基础疾病不同,不同机构内的疾病构成也不同。基础疾病是HAP最大的风险因素之一,然而又与其他风险因素具有共线性关系。例如,卒中是HAP的常见病因,误吸是HAP的主要危险因素,而卒中患者常伴有吞咽困难,容易造成误吸。因此,试图建立一个适用于所有疾病的HAP预测模型可能并不能达到预期效果。刘晓等[19]使用APACHEⅡ评分、多器官功能障碍综合征、低蛋白血症、降钙素原值增高、无创通气与输血作为变量,建立危重患者HAP的预测模型,建模组c统计量为0.844(95%CI为0.811~0.878),验证组c统计量为0.834(95%CI为0.744~0.924), 但是该模型的外部效度并没有得到进一步验证,而且该模型不适用于轻、中症住院患者的早期评估。本研究试图通过对患者按照疾病类型进行分层,探讨HAP预测量表建立的可行性。
SAP的危险因素已在大量研究中进行了探讨,国内外学者通过危险因素分析,制定了SAP预测量表,各量表的内部数据验证性能尚可,c统计量均在0.7以上,但前瞻性研究这些量表的预测性能资料相对有限。尚延昌等[20]对A2DS2量表在131例急性脑卒中中老年男性中的应用进行检验,结果显示预测性能良好,c统计量为0.86(95%CI为0.784~0.911)。单晔等[21]对A2DS2量表、Kwon等评分量表、PANTHERIS量表、ASI-APS量表采用同一数据进行外部效度验证,结果显示A2DS2量表、PANTHERIS量表、ASI-APS量表的c统计量均>0.7,Kwon等评分量表的c统计量为0.698,但是各量表之间的差异无统计学意义。
本研究通过借助SAP与HAP的共性,探讨SAP预测量表在缺血性脑卒中患者HAP中的应用。Ji等[13]研究结果发现Kwon等评分量表、Chumbler等评分量表、A2DS2量表、ASI-APS量表 4个量表中,预测性能最好的量表为ASI-APS量表(AUC=0.792)。而本研究结果显示除ASI-APS量表外,各量表在缺血性脑卒中患者HAP中的预测性能良好,其中ISAN量表的c统计量大于其他量表,考虑可能与ASI-APS量表不确定性变量数量较多有关。ASI-APS量表共有10个变量,其中包含房颤史、充血性心力衰竭、慢性阻塞性肺疾病,这些变量在患者频繁更换就医地点的地区,可能无法获得真实的数据,吸烟史目前也缺乏统一的定义和标准。另外,Kwon等评分量表、Chumbler等评分量表、A2DS2量表、ASI-APS量表均含有吞咽困难这一变量,但是目前评价吞咽困难无统一的标准,常见的吞咽困难量表包括洼田饮水试验、反复唾液吞咽试验、吞咽障碍V-VST、EAT-10等。ISAN量表变量少,只有4个(年龄、性别、NIHSS评分外和改良Rankin量表),这些变量更加客观,数据更准确,便于临床操作。
HAP除了受患者自身因素影响外,还受医疗环境因素的影响。虽然本研究是前瞻性研究,但是在患者标准化的护理依从性上仍然存在一些差异;另外,本研究采用二级医院的数据进行模型验证,二级医院患者病情相对较轻,住院时间相对较短,HAP与SAP有较多的重叠,因此对于研究结果的外推造成一定影响。
综上所述,大部分SAP预测量表(除ASI-APS量表)能应用于缺血性脑卒中患者HAP的预测,是一种可供临床使用的、有效的、可靠的HAP筛查工具。
| [1] |
曾翠, 任南, 黄勋, 等. 湘雅医院15年间医院感染现患率调查[J]. 中国感染控制杂志, 2016, 15(6): 367-373. DOI:10.3969/j.issn.1671-9638.2016.06.002 |
| [2] |
李福琴, 吴安华, 任南, 等. 2013-2015年某综合性医院医院感染现患率调查[J]. 中国感染控制杂志, 2016, 15(7): 484-487. DOI:10.3969/j.issn.1671-9638.2016.07.010 |
| [3] |
中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 225-280. |
| [4] |
Ingeman A, Andersen G, Hundborg HH, et al. In-hospital medical complications, length of stay, and mortality among stroke unit patients[J]. Stroke, 2011, 42: 3214-3218. DOI:10.1161/STROKEAHA.110.610881 |
| [5] |
Westendorp WF, Nederkoorn PJ, Vermeij JD, et al. Post-stroke infection:a systematic review and meta analysis[J]. BMC Neurol, 2011, 11: 110-116. DOI:10.1186/1471-2377-11-110 |
| [6] |
Wang PL, Zhao XQ, Yang ZH, et al. Effect of in-hospital medical complications on case fatality post-acute ischemic stroke:data from the China National Stroke Registry[J]. Chin Med J (Engl), 2012, 125: 2449-2454. |
| [7] |
Finlayson O, Kapral M, Hall R, et al. Risk factors, inpatient care, and outcomes of pneumonia after ischemic stroke[J]. Neurology, 2011, 77: 1338-1345. DOI:10.1212/WNL.0b013e31823152b1 |
| [8] |
Kwon HM, Jeong SW, Lee SH, et al. The pneumonia score:a simple grading scale for prediction of pneumonia after acute stroke[J]. Am J Infect Control, 2006, 34(2): 64-68. DOI:10.1016/j.ajic.2005.06.011 |
| [9] |
Sellars C, Bowie L, Bagg J, et al. Risk factors for chest infection in acute stroke:a prospective cohort study[J]. Stroke, 2007, 38(8): 2284-2291. DOI:10.1161/STROKEAHA.106.478156 |
| [10] |
Chumbler NR, Williams LS, Wells CK, et al. Derivation and validation of a clinical system for predicting pneumonia in acute stroke[J]. Neuroepidemiology, 2010, 34(4): 193-199. DOI:10.1159/000289350 |
| [11] |
Hoffmann S, Malzahn U, Harms H, et al. Development of a clinical score (A2DS2) to predict pneumonia in acute ischemic stroke[J]. Stroke, 2012, 43(10): 2617-2623. DOI:10.1161/STROKEAHA.112.653055 |
| [12] |
Harms H, Grittner U, Dröge H, et al. Predicting post-stroke pneumonia:the PANTHERIS score[J]. Acta Neurol Scand, 2013, 128(3): 178-184. DOI:10.1111/ane.12095 |
| [13] |
Ji R, Shen H, Pan Y, et al. Novel risk score to predict pneumonia after acute ischemic stroke[J]. Stroke, 2013, 44(5): 1303-1309. DOI:10.1161/STROKEAHA.111.000598 |
| [14] |
Smith CJ, Bray BD, Hoffman A, et al. Can a novel clinical risk score improve pneumonia prediction in acute stroke care? A UK multicenter cohort study[J]. J Am Heart Assoc, 2015, 4(1): e001307. |
| [15] |
中华人民共和国卫生部.医院感染诊断标准(试行)[S].北京, 2001.
|
| [16] |
卒中相关性肺炎诊治中国专家共识组. 卒中相关性肺炎诊治中国专家共识[J]. 中华内科杂志, 2010, 49(12): 1075-1078. DOI:10.3760/cma.j.issn.0578-1426.2010.12.031 |
| [17] |
Hosmer DH, Lemeshow S. Applied logistic regression[M]. New York: Wiley, 2000.
|
| [18] |
Janssen I, Katzmarzyk PT, Church TS, et al. The cooper clinic mortality risk index:clinical score sheet for men[J]. Am J Prev Med, 2005, 29(3): 194-203. DOI:10.1016/j.amepre.2005.05.003 |
| [19] |
刘晓, 何艳凛, 邢亚威, 等. 危重患者医院获得性肺炎的危险因素分析及预测模型的建立[J]. 中华医院感染学杂志, 2015, 25(11): 2502-2504. |
| [20] |
尚延昌, 王淑辉, 柏秀娟, 等. 应用A2DS2评分预测老年人群卒中后肺炎发生的危险因素[J]. 南方医科大学学报, 2013, 33(11): 1615-1619. |
| [21] |
单晔, 陈冬勤. 不同卒中相关性肺炎预测量表在缺血性脑卒中患者中预测作用的比较[J]. 护理学报, 2018, 25(24): 43-46. |



