全球范围内,革兰阴性杆菌是威胁患者安全的主要耐药菌,但革兰阳性球菌感染导致的治疗失败同样是临床难题。随着耐药革兰阳性球菌对糖肽类药物不敏感以及最低抑菌浓度不断高漂移,体外检测敏感而临床治疗失败的病例不断增多,临床上迫切需要有效的、新型抗菌药物用于救治革兰阳性球菌感染患者,特别是菌血症和心内膜炎患者。
达托霉素是一种新型环脂肽类抗生素,具有全新抗菌靶点和快速杀菌活性,可穿透生物膜,因其不导致菌体溶解,从而避免细菌内容物炎症介质释放引发的严重炎症反应,在治疗菌血症、感染性心内膜炎、复杂皮肤软组织感染等方面具有良好的临床应用价值。达托霉素已作为医保支付药物被纳入我国医保药物目录(2019版),用于有证据支持的金黄色葡萄球菌菌血症(含右心心内膜炎)患者的治疗。
为合理应用达托霉素有效救治患者,本专业委员会组织国内感染相关领域专家,结合国际权威指南、相关文献和专家处方经验,撰写了达托霉素临床应用专家意见,以期为广大临床工作者提供借鉴。
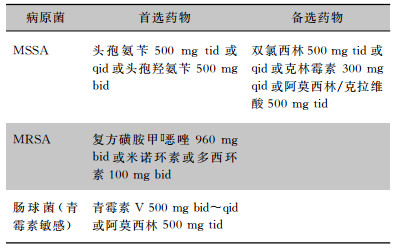
1 革兰阳性球菌的治疗现状 1.1 革兰阳性球菌致病情况及预后革兰阳性球菌主要包括葡萄球菌属、肠球菌属和链球菌属,可引起多种感染,如菌血症、感染性心内膜炎、皮肤和软组织感染、肺炎、中枢神经系统感染、骨关节感染、尿路感染、腹腔感染等。革兰阳性球菌所致感染预后与菌种、致病性、感染部位以及治疗药物选择密切相关。如金黄色葡萄球菌引起的菌血症可发生于所有年龄组,病死率高达20%~30%[1];金黄色葡萄球菌引起的感染性心内膜炎病死率22%~66%,高于其他病原引起的感染性心内膜炎[2-3]。
1.2 革兰阳性球菌耐药现状细菌耐药威胁人类健康且增加公共卫生负担[4]。世界卫生组织(WHO)指出,耐甲氧西林金黄色葡萄球菌(MRSA)以及耐万古霉素肠球菌(VRE)是优先级关注的耐药细菌[5]。在我国,耐药的革兰阳性球菌主要包括MRSA、耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)、耐青霉素肺炎链球菌(PRSP)及耐大环内酯类肺炎链球菌(MRSP)[6-7]。2017年中国细菌耐药性监测网(CHINET)监测结果显示,临床分离的主要革兰阳性球菌依次为金黄色葡萄球菌、肠球菌属和凝固酶阴性葡萄球菌,其中MRSA平均检出率为35.3%,MRCNS的平均检出率为80.3%[7-8];青霉素不敏感肺炎链球菌(PNSP)在儿童中更常见,儿童中平均检出率为13.2%。我国肺炎链球菌对大环内酯类药物耐药率高,2017年数据显示,成人耐药率为93.3%,儿童为98.3%[9-10]。屎肠球菌对青霉素类、喹诺酮类及红霉素类药物普遍耐药,对高浓度庆大霉素耐药率为48%,除氯霉素外,粪肠球菌对抗菌药物耐药率较屎肠球菌低[7-8]。我国VRE比例较低,近五年屎肠球菌对万古霉素的耐药率波动于1.4%~3.0%,粪肠球菌对万古霉素的耐药率波动于0.1%~0.8%[7-8, 11-12]。
1.3 常见革兰阳性球菌感染治疗药物革兰阳性菌对氨曲南和多粘菌素天然耐药,对大环内酯类、林可酰胺类耐药率亦较高,目前临床常用绝大多数抗菌药物均具有抗革兰阳性球菌活性。在临床应用时需综合考虑药物的安全性、适应证、依从性、PK/PD特点及经济负担等因素。
1.3.1 链球菌青霉素、头孢菌素,尤其是头孢曲松、头孢噻肟以及氟喹诺酮类等药物对链球菌均具有较强的抗菌活性。CHINET监测结果显示,青霉素对肺炎链球菌依然保持较高的敏感性,尤其是成人分离株[13]。但应注意区别脑脊液和非脑脊液标本分离菌药敏结果的不同判定标准,以及治疗药物的选择。青霉素依然是治疗青霉素敏感肺炎链球菌(PSSP)感染的一线药物,青霉素过敏者可选择头孢曲松、头孢噻肟;对于PNSP可参考药敏结果选择头孢曲松(或头孢噻肟)、氟喹诺酮类、糖肽类以及
肠球菌对目前所有的第一~四代头孢菌素、头霉素、林可霉素、夫西地酸和磺胺类天然耐药。鹑鸡肠球菌、铅黄肠球菌对万古霉素天然耐药。
氨苄西林敏感的肠球菌:粪肠球菌对青霉素和氨苄西林的耐药率很低,氨苄西林是一线选择药物。其他广谱青霉素如阿莫西林、哌拉西林及其酶抑制剂复合制剂亦可选择。如果药敏检测为敏感株,也可选择青霉素。氨苄西林耐药的肠球菌:我国屎肠球菌对氨苄西林的耐药率超过90%,VRE分离率较低[13],糖肽类药物是重要选择。但由于我国VRE菌株最常见为vanA基因型[13-14],对(去甲)万古霉素、替考拉宁同时耐药,临床上应根据感染部位选择利奈唑胺或达托霉素等。部分感染如感染性心内膜炎等,若对高水平庆大霉素敏感,可联合使用氨基糖苷类药物。
1.3.3 葡萄球菌甲氧西林敏感葡萄球菌:耐青霉素酶的广谱半合成青霉素及头孢菌素(特别是头孢唑林)、克林霉素等均有效;除非患者对前述药物过敏,不需要使用糖肽类、
达托霉素是从玫瑰孢链霉菌发酵液中提取的环酯肽类抗生素, 由13个氨基酸和1个癸酰基侧链构成[18-21],独特的化学结构决定了其作用机制与其他药物的不同。达托霉素对革兰阳性菌,特别是MRSA、VRE和肺炎链球菌具有强大的杀菌作用[22-23]。
2.2 作用机制达托霉素主要作用于革兰阳性菌细胞膜[24-25],在中性pH条件下, 达托霉素带负电荷, 其抗菌活性依赖于钙离子[26]。钙离子能使达托霉素转化为活性构象, 更具有两亲性, 有助于增强离子化的达托霉素与带负电荷的磷脂相互作用[27]。当达托霉素靠近细菌细胞膜时, 其亲脂端插入到细胞膜磷脂分子的脂肪酸链中, 以非共价键的形式与细菌细胞膜不可逆地结合[28]。随后, 在钙离子的作用下, 达托霉素寡聚化, 在细胞膜上形成“离子通道”样结构, 使细胞内离子外流,细胞膜迅速去极化, RNA、DNA及大分子蛋白质的合成受阻, 导致细菌死亡[29-30]。由于达托霉素是钙离子浓度依赖型抗生素, 在钙离子缺乏时, 其抗菌活性很小或几乎没有, 当钙离子的浓度达到1.25 mmol/L时, 药物活性达到最大[31]。达托霉素在杀灭细菌的同时并不使细菌溶解, 炎症反应相对较轻。
2.3 达托霉素抗菌谱国内外研究均证明达托霉素对大多数临床分离革兰阳性菌株均具有抗菌活性,包括甲氧西林耐药和不耐药的葡萄球菌、万古霉素耐药和不耐药的肠球菌、草绿色链球菌群以及β溶血链球菌等。达托霉素对革兰阳性厌氧菌也有抗菌活性, 对消化链球菌属、梭菌属和乳杆菌属有效且MIC值较低。Sader等[32]连续收集欧洲34所医院2003—2009年临床分离的36 769株革兰阳性菌并进行达托霉素的体外药敏检测, 证实达托霉素对金黄色葡萄球菌和凝固酶阴性葡萄球菌具有强抗菌活性, 且不受甲氧西林耐药机制的影响。所有粪肠球菌对达托霉素敏感,万古霉素敏感和耐药的肠球菌均对达托霉素敏感,β溶血链球菌和草绿色链球菌群对达托霉素的敏感率分别为100.0%、99.8%。收集中国17所医院2010—2011年临床分离的2 679株革兰阳性球菌, 发现MRSA、MRCNS、肠球菌,以及PNSP和β溶血链球菌对达托霉素敏感率均为100%[33]。
2.4 达托霉素的PK/PD 2.4.1 药代动力学特点[34-35]达托霉素口服吸收差,静脉注射4~12 mg/(kg·d),每次给药时间大于30 min时药动学基本呈线性。达托霉素主要分布在细胞外间隙,不易穿透血脑屏障及胎盘屏障。其表观分布容积(Vd)约为0.1(0.096~0.101)L/kg,与血浆蛋白(主要为血清蛋白)可逆性结合, 血浆蛋白结合率范围为90%~93%。当成人肌酐清除率 < 30 mL/min,正接受血液透析或持续非卧床腹膜透析时, 血清蛋白结合率呈下降趋势。成人中度肝功能损伤(Child-Pugh Class B级)蛋白结合率与健康成人相似。
达托霉素不被CYP450同工酶代谢,也不受剂量影响。该药极少或者不发生代谢, 主要通过肾排泄, 78%以原型随尿液排出, 6%随粪便排出。因此其毒性小可能与代谢特点有关, 也不被代谢阻滞剂或竞争拮抗剂所改变, 不存在可预见的代谢性相互作用。达托霉素可被血液透析和腹膜透析清除,消除半衰期(t1/2)约为8(7.7~8.1) h。肾损伤患者中t1/2延长,严重肾损伤或终末期肾病的患者, t1/2延长至2~3倍, 需调整剂量。轻至中度肝功能损伤者无须调整剂量。目前尚缺乏达托霉素在严重肝功能损伤(Child-Pugh Class C级)患者中药代动力学的评价。
2.4.2 药效动力学特点达托霉素属于浓度依赖性抗生素,Cmax 58 μg/mL,AUC 494 μg/mL·h,抗菌活性与浓度-时间曲线下面积(AUC)/MIC比值有关。由于肺泡含有复杂的蛋白和脂类化合物构成的表面活性物质, 大大降低了达托霉素的疗效,因此不推荐其用于肺炎治疗。
3 达托霉素临床应用 3.1 达托霉素在我国医保目录的适应证 3.1.1 金黄色葡萄球菌菌血症(S. aureus bacteremia,SAB)金黄色葡萄球菌[甲氧西林敏感金黄色葡萄球菌(MSSA)、MRSA]是引起菌血症常见的病原菌[32]。美国的发病率为4.3/10万~38.2/10万,由MRSA引起的菌血症占所有医疗保健相关感染的14.0%[36-37]。SAB 30天全因病死率一直维持在20%左右[38],而MRSA是导致患者死亡的独立危险因素[39-40]。感染病灶未明的患者90天病死率更高(46% VS 25%)[40]。确诊为SAB时, 需排查是否合并感染性心内膜炎以及脑脓肿、骨髓炎等[41]。
评估是否为复杂性SAB对药物选择、疗程、预后判断等至关重要。复杂性SAB的预测指标包括:治疗48~96 h血培养仍呈阳性(OR=5.58,P < 0.001)、社区获得感染(OR=3.1,P < 0.002)、治疗72 h后仍发热(OR=2.23,P < 0.001)、皮肤迁徙病灶(OR=2.04,P < 0.001);非复杂性SAB需符合以下全部预测指标:中心静脉导管相关血流感染且已拔除导管、治疗后血培养监测为阴性、治疗72 h内体温正常、经食道心脏超声检查正常、关节或血管内没有人工植入物、没有提示发生迁徙病灶的症状/体征。
3.1.1.1 甲氧西林敏感的金黄色葡萄球菌(MSSA)菌血症的治疗治疗MSSA菌血症可选择具有抗葡萄球菌活性的β-内酰胺酶类抗菌药物。研究[42-45]显示,β-内酰胺酶类抗菌药物治疗MSSA菌血症的死亡率较低,不推荐选择糖肽类药物。在中枢神经系统或肺部等部位没有迁徙病灶的情况下,也可选择达托霉素。若β-内酰胺酶类抗菌药物过敏, 可选择达托霉素或糖肽类药物。
3.1.1.2 MRSA菌血症的治疗达托霉素和(去甲)万古霉素、替考拉宁均可作为MRSA菌血症的一线治疗[41]。达托霉素治疗MRSA菌血症可作为首选药物, 亦可以作为糖肽类治疗失败的补救治疗药物[41-42]。近年来万古霉素对MRSA的MIC增高(敏感,但≥2 mg/L),已引起关注[43], 万古霉素对此类患者的治疗失败率和全因死亡率明显增高[44]。
3.1.1.3 剂量及疗程对于非复杂性SAB, 达托霉素的推荐剂量为6 mg/(kg·d), 疗程至少2周。对于成人复杂性SAB, 剂量同非复杂性SAB, 但疗程至少为4~6周;也有专家推荐治疗复杂性或持续性SAB患者达托霉素剂量增加至8~10 mg/(kg·d)(证据质量低)[41]。高剂量达托霉素除能增强抗菌作用外, 还能预防耐药性的产生, 特别是对感染较重的患者[45]。
3.1.1.4 其他措施应详细了解病史、细致查体、进行必要的影像学检查(包括经食道心脏超声)、血培养以及适当的重复检查,必要的外科干预,如脓肿引流、去除人工装置或材料等是治疗SAB的重要潜在选择[41, 46-47]。
3.1.2 革兰阳性球菌中心静脉导管相关血流感染中心静脉导管相关血流感染以革兰阳性菌为主要致病菌, 特别是凝固酶阴性葡萄球菌和金黄色葡萄球菌。该类型感染是典型的原发性菌血症,治疗难度在于迁徙病灶的排查、是否拔除导管的判断、药物及剂量选择、疗程等判断。如确诊为金黄色葡萄球菌所致,应参考前述SAB的治疗推荐。
3.1.3 右心心内膜炎(MSSA、MRSA引起)右心感染性心内膜炎(RIE)主要见于静脉药瘾者,也见于心脏植入性电子装置(永久起搏器或除颤器)、中心静脉导管、右心结构性心脏病者。RIE最常见致病菌是金黄色葡萄球菌[48]。MSSA或MRSA引起的RIE是使用达托霉素的明确指征,敏感株亦可参考药敏结果,选择具有杀菌活性的药物且以实测MIC值/MIC90为1/2至1/8为宜。
研究[49-50]显示, 达托霉素治疗RIE成功率高达91%和88.6%,给药剂量≥8 mg/kg的病例成功率略高于6 mg/kg的病例(94.1% VS 86.9%)。金黄色葡萄球菌引起RIE可能伴发感染性肺栓塞和肺脓肿,可联合使用利奈唑胺或其他抗菌药物治疗[51]。植入性电子装置感染,病原学中各类葡萄球菌占60%~80%,治疗首先要移除电子装置[52]。报道[53]显示,达托霉素单药治疗葡萄球菌引起的植入性电子装置感染全部有效。
其他心脏及血管内植入物感染:包括动静脉留置管、血管内支架、左室辅助泵等发生的感染。体外实验发现,达托霉素在清除葡萄球菌生物膜时比其他药物(包括万古霉素)更高效、迅速[54],在个案或病例系列报道中,对难治性葡萄球菌植入物感染,达托霉素(常规剂量或高剂量)合并使用氟氯西林、利福平等,治愈率高,不良反应少且可逆[55-57]。
3.2 达托霉素其他适应证 3.2.1 复杂皮肤软组织感染(cSSTI)[58](敏感的革兰阳性球菌、MRSA、VRE引起)皮肤软组织感染(SSTI)又称皮肤及皮肤结构感染(SSSI),是化脓性致病菌侵犯表皮、真皮和皮下组织引起的感染性疾病。根据病情是否累及全身和严重程度, 又分为单纯性SSTI和cSSTI。美国IDSA将深部软组织感染、手术/创伤性伤口感染、脓肿、蜂窝织炎、感染溃疡和烧伤感染归为cSSTI。严格来说, 坏死性筋膜炎和坏死性肌炎不归入SSTI的范畴。
蜂窝织炎和丹毒(面部、非四肢、成人丹毒):常见病原菌为A、B、C、G族链球菌,金黄色葡萄球菌包括MRSA、肺炎链球菌。经验性治疗必须覆盖金黄色葡萄球菌,首选糖肽类药物如(去甲)万古霉素、替考拉宁,疗程7~10 d, 备选达托霉素或利奈唑胺, 如未并发菌血症, 疗程7~10 d。
糖尿病足:常见病原菌为A、B、C、G族链球菌,金黄色葡萄球菌,肠杆菌科,厌氧菌。轻症患者治疗选择复方磺胺甲
上述cSSTI推荐的达托霉素剂量为4 mg/(kg·d)。
烧伤脓毒症:常见病原菌为化脓性链球菌、肠杆菌科、金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、大肠埃希菌、铜绿假单胞菌。治疗推荐首选大剂量糖肽类药物+美罗培南(或头孢吡肟)+氟康唑,备选方案:达托霉素6~10 mg/(kg·d)。
3.3 达托霉素超说明书使用 3.3.1 MSSA、MRSA左心自体瓣膜感染(LIE)上市前研究显示,金黄色葡萄球菌引起的LIE患者达托霉素治疗组和对照药物组(入组病例极少)预后均很差,达托霉素说明书不推荐其用于治疗由金黄色葡萄球菌导致的LIE。上市后更多的研究发现, 达托霉素对于金黄色葡萄球菌引起自体瓣膜的LIE和RIE治疗有同样的疗效,因此,众多指南均推荐达托霉素用于RIE和LIE的治疗。《美国感染病学会成人和儿童MRSA感染的指南》中指出,达托霉素可用于MRSA血流感染和自身瓣膜IE的治疗(AⅠ);2011年英国抗菌化疗协会(BSAC)《成人心内膜炎的诊断和治疗指南》推荐达托霉素用于IE的经验性治疗以及达托霉素联合利福平或者庆大霉素治疗葡萄球菌IE(包括假体瓣膜)[59];2015年《欧洲心脏病年会在感染性心内膜炎的治疗》中指出,当MSSA或MRSA对万古霉素的MIC>1 mg/L时, 达托霉素的疗效优于万古霉素[60], 两者均未限定RIE或LIE。《2015年AHA科学声明:成人感染性心内膜炎的诊断、抗菌治疗及并发症管理》中明确指出,达托霉素可用于MSSA所致的左侧心内膜炎替代治疗(Ⅱb)[61]。因此,对于金黄色葡萄球菌引起的IE,无论是LIE还是RIE, 达托霉素都是有效的。如因各种因素导致达托霉素作为LIE的唯一治疗药物选择时,应注意达托霉素的剂量通常为10 mg/(kg·d)[62]。
3.3.2 MSSA、MRSA左心人工瓣膜感染(PVE)PVE的病原学主要为MRCNS及链球菌属[63]。如确定为金黄色葡萄球菌感染时,可参考LIE的治疗推荐,应注意优化剂量。此时,评估外科干预的可能性和时机同样重要。
3.3.3 IE补救治疗2006—2010年欧洲注册研究(EU-CORE),纳入了378例IE患者(左心IE占69%),有病原学检查记录351例,其中由SA引起的92例(26%),MRSCN 102例(29%),肠球菌30例(8%),无乳链球菌42例(12%),其他85例(24%)。312例(82%)为补救治疗;达托霉素高剂量组8~12 mg/(kg·d)疗效优于常规剂量组6 mg/(kg·d)[49]。高剂量达托霉素尤其适合于万古霉素治疗失败或其MIC增加(MIC>1~2 mg/L)的葡萄球菌IE的补救治疗[64]。
美国心脏病协会(AHA)和欧洲心脏病协会(ESC)IE诊疗指南均推荐达托霉素可作为初始治疗失败后的补救治疗(二线或三线治疗)。AHA和ESC均推荐对于葡萄球菌(MSSA、MRSA和CNS)所致IE,高剂量达托霉素是万古霉素合理替代药物(IIa或IIb)。对β-内酰胺类、万古霉素或氨基糖苷类耐药的肠球菌菌株引起的LIE,应尽量获得其对达托霉素体外敏感检测结果,若达托霉素敏感(MIC<4 mg/L),可用高剂量达托霉素10~12 mg/(kg·d)联合氨苄西林或头孢洛林(我国未上市)治疗(IIb)[65]。
3.3.4 MSSA、MRSA、肠球菌人工关节感染(PJI)PJI是人工关节植入术后最严重的并发症。美国2009年调查显示,进行全髋或全膝关节置换的近百万患者中,基于假体类型的差异以及初次或再次翻修术的不同, PJI的累积发病率介于1%~2%。目前, 我国还没有关于这类感染的具体数据。PJI的治疗几乎都需要外科干预和长时间的抗菌药物治疗。
手术治疗策略应由骨科医生决定, 必要时征求相关专家意见。对于假体固定良好、无窦道形成、假体植入30 d内或感染症状出现时间短于3周的PJI患者可考虑行清创术并保留假体;不符合上述标准, 但不能接受外科手术或具有手术高风险的患者也可考虑清创并保留假体, 但更容易复发。外科干预策略应遵照有经验的关节置换专家的意见。
对于葡萄球菌引起的PJI, 抗菌药物治疗建议如下:根据病原菌检测结果静脉给予抗菌药物(见表 1), 并联合利福平(300~450 mg口服bid)疗程2~6周;序贯利福平联合一种口服抗菌药物, 全髋关节置换术总疗程3个月, 全膝关节置换术总疗程6个月。全肘、全肩、全踝关节感染的诊疗方法同全髋关节置换术后感染。
| 表 1 治疗葡萄球菌人工关节感染(PJI)静脉注射抗菌药物推荐 |

|
建议与利福平联合应用的口服抗菌药物(见表 2),还可包括环丙沙星或左氧氟沙星。如因体外药敏结果、药物过敏、不耐受或潜在不耐受等原因,需使用喹诺酮类以外的二线联合应用药物时, 可使用但不限于复方磺胺甲
| 表 2 静脉注射抗菌药物治疗后可口服长期抑菌治疗的常用抗菌药物 |
|
葡萄球菌引起的PJI采用上述方法治疗后,还可能要根据体外药敏结果、过敏或不耐受情况选择口服头孢氨苄、双氯西林、复方磺胺甲
一期假体置换术后应根据病原菌特点选择静脉抗菌药物联合利福平300~450 mg bid, 总疗程共3个月。
截肢后抗菌药物应视情况决定:(1)手术清除所有感染的骨组织和软组织, 若未并发脓毒症或菌血症, 使用病原菌特异性抗菌药物治疗24~48 h;若并发了脓毒症或菌血症, 应遵循相关诊疗建议。(2)手术后仍有感染的骨组织和软组织残留,如全髋关节置换术后感染而行关节离断术, 或全膝关节置换术后假体延伸至截肢水平以上, 应选择病原菌特异性的静脉抗菌药物或口服生物利用度高的抗菌药物治疗4~6周。
3.3.5 细菌性骨髓炎临床治疗MSSA、MRSA及肠球菌导致的骨髓炎时需要注意,抗菌药物的应用必须建立在外科手术对感染病灶进行彻底清创的基础之上。达托霉素治疗骨髓炎应静脉给药,局部应用仅限于个案报道。推荐采用6~8 mg/kg的剂量, qd, 疗程至少4~6周。局部应用的报道多数为假体周围感染的治疗, 聚甲基丙烯酸甲酯(PMMA)为载体, 抗菌药物与载体配比在10%以下(W/W)。
3.3.6 VRE感染 3.3.6.1 心内膜炎国外研究[66]显示,万古霉素耐药粪肠球菌引起感染性心内膜炎的相关因素包括留置中心静脉导管、肝移植、二尖瓣受累。耐万古霉素屎肠球菌引起的感染性心内膜炎常累及三尖瓣, 感染常源自肠道或泌尿道。
VRE感染性心内膜炎治疗可选择的药物包括达托霉素和利奈唑胺。国外文献报道的达托霉素治疗VRE心内膜炎的病例数较少, 有效率45%~82.8%, 较MRSA所致感染性心内膜炎的疗效稍差(86% VS 45%)[67-68]。Hall等[69]研究显示,达托霉素治疗MIC 2~4 mg/L VRE感染性心内膜炎的剂量应提高至10 mg/(kg·d);Luther等[70]研究中达托霉素治疗最佳剂量为6~10 mg/(kg·d);研究[71-72]显示,达托霉素治疗VRE心内膜炎与利奈唑胺相比疗效更佳。对于难治性VRE心内膜炎, 国外研究显示达托霉素联合β-内酰胺类(氨苄西林、头孢吡肟、头孢洛林)或磷霉素可提高疗效[73-75]。
3.3.6.2 菌血症美国食品药品监督管理局(FDA)批准利奈唑胺用于治疗VRE菌血症。但由于利奈唑胺长时间应用的副作用、使用的局限性及耐利奈唑胺VRE-屎肠球菌的出现等, 达托霉素已经被广泛应用于治疗VRE菌血症。近年研究建议达托霉素可以作为VRE菌血症的首选治疗药物, 其疗效与剂量密切相关[76-78],但最佳剂量并没有确定。《桑福德抗微生物治疗指南》推荐达托霉素(8~12 mg/kg,静脉滴注,q24h)为治疗VRE全身性感染的首选药物之一(C级)[79]。
3.3.6.3 腹腔感染目前,尚缺乏达托霉素用于腹腔感染治疗的文献报道。
3.3.6.4 尿路感染VRE尿路感染的危险因素包括中性粒细胞减少、器官移植、血液透析、使用糖皮质激素、化疗、长期使用抗菌药物(主要包括万古霉素、三代头孢菌素、喹诺酮类和抗厌氧菌药物)、静脉营养、外科手术、入住重症监护病房、长期住院、留置导尿管等。达托霉素尿液浓度可达67 mg/L。达托霉素对万古霉素敏感和耐药的粪肠球菌MIC90均为1 mg/L, 对于万古霉素敏感和耐药的屎肠球菌的MIC90均为2 mg/L,达托霉素尿液中浓度远高于其MIC值,因此,对于VRE尿路感染,达托霉素具有良好用药指征[80-83]。
3.3.6.5 cSSTI在cSSTI中VRE并不多见。关于VRE的研究发现利奈唑胺较达托霉素有优势, 利奈唑胺已被批准用于治疗VRE感染。本文建议对于VRE所致cSSTI, 利奈唑胺应作为首选, 达托霉素可作为备选药物之一[58]。
3.3.6.6 中枢神经系统感染作为一类相对大分子物质, 达托霉素不容易进入中枢神经系统,一项达托霉素单剂量治疗脑室炎的研究发现, 脑脊液和血清的浓度时间曲线图比值仅为0.008。鉴于仍缺乏RCT研究证实达托霉素治疗中枢神经系统感染的有效性,且(去甲)万古霉素、利奈唑胺可以满足不同患者的治疗需要,不推荐达托霉素用于中枢神经系统感染的治疗。
4 达托霉素使用注意事项 4.1 达托霉素耐药现状及机制 4.1.1 耐药现状目前,国内尚无达托霉素大规模耐药监测的报道。国外文献中达托霉素主要的目标菌,如葡萄球菌、肠球菌和链球菌耐药率均非常低。2014年国内26所医院收集的2 127株革兰阳性菌中未发现达托霉素耐药株[84]。英国和美国2011年前大规模研究几乎没有发现达托霉素耐药的金黄色葡萄球菌[32, 85]。大规模调查发现在肠球菌中达托霉素的耐药率仅为0~0.6%[86-89]。
值得注意的是:(1)在治疗过程中,原本对达托霉素敏感的菌株可能会出现对达托霉素耐药的情况,从而可能导致治疗失败[90]。(2)万古霉素使用可能增加达托霉素耐药的发生,尤其是对万古霉素中介的葡萄球菌[91]。
4.1.2 耐药机制[91-93]达托霉素耐药机制复杂,迄今尚未完全阐明,且不同菌种对达托霉素耐药的机制也有所不同。
4.1.2.1 金黄色葡萄球菌金黄色葡萄球菌对达托霉素主要耐药机制是细胞膜阳性电荷增加和细胞壁增厚,导致达托霉素被排斥在细胞膜之外,不能与靶位结合。分子机制包括基因突变或者高水平表达,其中最常见的是mprF基因突变。该基因编码双功能酶,催化磷脂酰甘油(PG)的赖氨酰化,从而控制PG的浓度。mprF基因发生某些突变将降低PG浓度,从而影响达托霉素与其作用靶位的相互作用,造成耐药。其他与达托霉素耐药相关的基因还包括dlt操纵子(导致细胞膜电荷改变)、pgsA基因(参与PG合成)、cls基因(参与心磷脂合成)、tagA基因(参与细胞壁合成)、yycG基因(编码传感组氨酸激酶)、rpoB和rpoC(编码RNA多聚酶)。此外,研究发现葡萄球菌金黄色素合成减少也与达托霉素耐药有关。
4.1.2.2 肠球菌粪肠球菌与屎肠球菌对达托霉素的耐药机制不同。粪肠球菌通过复杂的机制使达托霉素从其主要靶位转移至细胞膜上的其他区域,而与错误的位置结合。目前认为这主要与调节细胞膜稳态和细菌对应激进行反应的LiaFSR基因系统发生突变有关。此外,cls基因(参与心磷脂合成)或gdpD基因(参与甘油合成)发生突变也可能导致达托霉素耐药。屎肠球菌对达托霉素耐药机制与金黄色葡萄球菌类似,是将达托霉素排斥在细胞膜外,不能与靶位结合。其机制也主要与LiaFSR基因系统发生突变有关,该系统功能多样,在不同肠球菌中作用可能有所不同。
4.2 达托霉素临床使用评估[94-96]达托霉素几乎对所有革兰阳性菌,包括MRSA和VRE均有效。对于VRE,高剂量的达托霉素(≥10 mg/kg)疗效优于普通常规剂量,安全性也较好。达托霉素主要以原型经肾排泄,可被血液透析清除。因此,除说明书适应证外,达托霉素用于敏感细菌尿路感染也有良好效果,但用于肾功能不全患者及血液透析患者时应注意剂量调整。研究显示,达托霉素血浆清除率在肥胖患者中下降,AUC增加,提示肥胖患者无需调整剂量。除重症患者外,该药不需常规进行治疗药物浓度监测。
4.3 达托霉素主要不良反应达托霉素总体不良反应轻微, 可能是因为其组织穿透性较弱, 表观分布容积较小。该药不良反应的总体发生率为5%~6.1%, 最常见的不良反应包括便秘、注射部位局部反应、恶心、头痛、腹泻和呕吐。达托霉素使用期间需引起重视的主要不良反应如下。
4.3.1 肌酸激酶升高达托霉素可能导致肌酸激酶升高, 甚至出现横纹肌溶解症。这一副作用与给药间隔时间的缩短密切相关, 而与AUC或Cmax关系较小, 即使在推荐剂量下亦可发生, 故目前推荐每日一次的给药方案。达托霉素谷浓度>24.3 mg/L,肌酸激酶升高的发生率显著增加[97]。给药过程中应密切监测肌酸激酶, 一旦出现肌酶>5倍上限且伴有肌痛等肌病症状, 或出现无症状的肌酶升高>10倍上限,应予以停药及对症支持治疗。
4.3.2 嗜酸性粒细胞肺炎2007年达托霉素的药品说明书中不良反应和上市后监测部分加入了肺嗜酸性粒细胞病不良事件。可能因为达托霉素与肺泡表面活性物质结合, 导致肺泡表面局部药物浓度较高, 进而诱发机体过度免疫应答。达托霉素所致嗜酸粒细胞肺炎多于用药后2周内发生, 小剂量用药亦可能诱发, 缓解后再次使用达托霉素可再次诱发或加重。其临床症状多为发热、呼吸困难、双肺湿啰音、双侧肺浸润影, 肺泡灌洗液或肺活检提示嗜酸性粒细胞比例增高。停药并使用糖皮质激素、氧疗等对症治疗后, 大部分患者临床症状均可在48 h内恢复。
4.3.3 二重感染长期应用本品可能出现二重感染, 尤其可出现严重的革兰阴性菌感染。用药期间出现腹泻、感染加重时宜特别注意, 反应程度轻者停药后可缓解, 严重者则须立即补充电解质或蛋白质等对症治疗。
4.4 药物相互作用在体外研究中发现,达托霉素并不被人肝微粒体所代谢,而且不抑制或诱导以下细胞色素P450同工酶的活性:1A2、2A6、2C9、2C19、2D6、2E1和3A4[98]。因此,达托霉素通过细胞色素P450同工酶导致药物-药物相互作用的可能性较小。体外研究[99]发现,达托霉素是转运体P-糖蛋白(P-glycoprotein, P-gp, MDR1)的底物,可由P-gp外排至细胞外。P-gp存在于人体的许多组织,其中肾、肾上腺、肝、肠道等器官或组织的表达水平较高。因此,达托霉素在肾排泄时可能与其他药物产生相互作用。在健康受试者中,未发现达托霉素与氨基糖苷类药物(如妥布霉素、阿米卡星)的相互作用[100-101]。P-gp的抑制剂(如茚地那韦、奈非那韦、利托那韦、沙奎那韦、红霉素、克拉霉素、伊曲康唑等)和诱导剂(如利福平、咪达唑仑等)可能影响达托霉素在肾的排泄,虽然目前未有基于转运体P-gp研究达托霉素药物-药物相互作用的文献报道,但当达托霉素与P-gp的抑制剂或诱导剂合用时需引起注意。其他有报道的药物相互作用包括氨曲南、华法林、辛伐他汀和丙磺舒等,都未发现与达托霉素存在药物相互作用[102]。
虽然达托霉素对辛伐他汀的体内药动学并没有影响, 但HMG-CoA还原酶抑制剂和达托霉素合用时可能导致肌病的发生率增加, 但差异无统计学意义[103],但在使用达托霉素时,宜避免使用他汀类药物。
4.5 特殊人群用药 4.5.1 老年人肾功能正常的老年人(>65岁)用法、用量同成年人, 其余根据肾功能进行调整。
4.5.2 儿童在儿童患者中达托霉素不作为一线常规治疗药物使用。说明书中指出, 由于在新生犬模型中观察到其对骨骼肌、神经肌肉和神经系统的不良反应, 因此应避免应用于12个月以内的患儿[104]。儿童应静脉输注, 不得静脉推注。推荐剂量如下表(见表 3)[105],由于婴儿数据非常有限, 药动学数据不足, 未确定最佳剂量。达托霉素治疗儿童cSSTI(未发生金黄色葡萄球菌菌血症)[104],静脉输注, 疗程≤14 d,见表 4。达托霉素治疗儿童金黄色葡萄球菌菌血症[104], 疗程≥14 d,见表 5。达托霉素用于儿童葡萄球菌心内膜炎的治疗见表 6。达托霉素治疗儿童MRSA引起的骨髓炎或细菌性关节炎,数据有限, 治疗骨髓炎的安全性和有效性待评价, 剂量范围为6~10 mg/(kg·d)[106]。肾功能不全的儿童剂量调整方案尚不明确。
| 表 3 达托霉素治疗儿童严重感染的剂量推荐 |
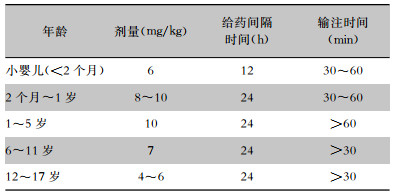
|
| 表 4 达托霉素治疗儿童cSSTI(未发生金黄色葡萄球菌菌血症)剂量推荐 |
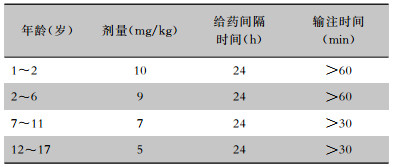
|
| 表 5 达托霉素治疗儿童金黄色葡萄球菌菌血症剂量推荐 |
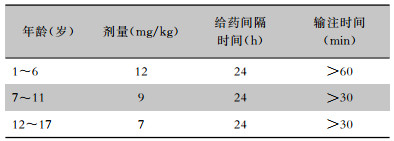
|
| 表 6 达托霉素治疗儿童心内膜炎的剂量推荐 |
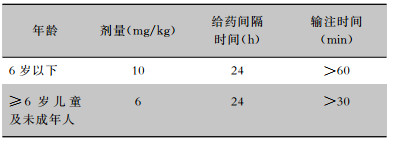
|
暂无妊娠期女性使用达托霉素的临床数据。动物研究未发现达托霉素对怀孕、胚胎发育、分娩或产后发育有直接或间接影响。个案报道中有在妊娠中期和晚期使用达托霉素成功的案例。除非必需, 且经有经验感染科医生评估获益大于可能风险, 否则,不推荐达托霉素用于妊娠期患者。
4.5.3.2 哺乳期达托霉素可分泌入乳汁, 浓度低于血药浓度, 为避免对婴儿的影响, 在用药期间应暂停哺乳。
4.6 达托霉素在重症感染患者中的应用达托霉素为浓度依赖性抗生素,水溶性,蛋白结合率高,Vd很小,患者病情越严重、炎症反应越强,达托霉素的Vd增加越明显[107]。达托霉素主要经肾代谢,肾功能障碍时对达托霉素清除减少,需要调整维持剂量[108],一般不调整负荷剂量,见表 7。反之由于创伤、感染、炎症反应等导致重症感染患者高血流动力学状态,出现肾功能亢进(肾小球滤过率>130 mL/min),需要增加达托霉素剂量[109]。
| 表 7 达托霉素治疗特殊基础疾病患者感染的剂量推荐 |

|
达托霉素主要经肾代谢,故肝功能轻中度障碍时对达托霉素的清除和代谢影响不大,一般不需要调整剂量[110]。持续肾替代治疗(CRRT)已广泛应用于重症患者,一般情况下,水溶性、蛋白结合率低、Vd小、分子量小、主要经过肾代谢的抗菌药物容易被CRRT清除。CRRT时需要调整剂量[108],推荐对CRRT治疗的患者,达托霉素应每48 h给药一次,能达到很好的PK/PD[111]。
体外膜氧合(ECMO)是急性呼吸循环衰竭时的重要治疗措施,越来越多应用于临床。ECMO通过改变分布容积及膜材料吸附等影响药物的分布和清除。ECMO还可显著增加高蛋白+高脂溶性药物的清除,对达托霉素清除是否存在显著影响还缺乏相应研究。
低蛋白血症在重症患者发病率高,高蛋白结合率药物在低蛋白血症时会出现分布容积显著增加、代谢清除率加快,因此,低蛋白血症时达托霉素无论负荷量还是维持量都需要考虑增加剂量。不同感染部位及病原菌,达托霉素推荐剂量有不同[112]。
4.7 达托霉素卫生经济学评价目前, 中国仅有两项达托霉素的快速卫生技术评估[114-115]。研究结果显示,达托霉素可以作为治疗感染性心内膜炎和SSTI感染的药物。国外学者评价达托霉素和万古霉素治疗MRSA菌血症的成本效果, 结果显示达托霉素相比于万古霉素为绝对优势方案[116]。美国学者采用决策分析模型进行成本效果分析,比较达托霉素、万古霉素和利奈唑胺治疗MRSA导致的cSSTI,相比于万古霉素, 达托霉素为绝对优势方案;相比于达托霉素, 利奈唑胺为绝对优势方案[117]。
需要注意的是, 国外同行的药物经济学研究结果是否适用于我国国情尚无结论,应开展达托霉素在我国目前医疗模式下的药物经济学研究,特别是对于传统方案可能导致预后不良的感染,如心内膜炎、菌血症等。
4.8 达托霉素超说明书使用的伦理与管理建议药品说明书是临床用药依据之一, 在与药品有关的纠纷中,其是主要的技术参照标准。由于药品上市后评价研究不充分、说明书内容更新滞后等因素, 仅有说明书的内容不能满足临床实践需要, 出现超说明书使用的情形并不少见。
由于目前我国相关的立法和制度尚未建立,超说明书使用可能会带来患者安全风险、医生执业风险以及药费报销争议等问题[118]。
本意见中, 以患者利益为出发点, 以循证医学为原则, 对国内外达托霉素的超说明书使用做了综合评价, 在充分考虑科学依据、临床需求、实践经验的基础上, 提出了相应的临床应用建议。实际工作中仍需遵从国家及医疗机构内部有关具体管理要求。另外,广东省药学会印发了《医疗机构超药品说明书用药管理专家共识》[119], 可作为医疗机构制定相应管理规定的参考之一。
本文简要提出以下几点建议:(1)临床科室、药学部、微生物检验等部门组织讨论后, 形成超说明书用药依据、用药方案、风险应急对策等材料, 递交所在医疗机构药事管理与药物治疗学委员会和伦理委员会批准并备案。(2)实施已备案的超说明书用药方案时应向患者或家属、监护人告知用药理由及可能出现的风险, 并征得患者或其家属的知情同意。(3)保留完整详细的病程记录,特别是可能的不良反应和疾病预后。(4)医疗机构应结合自身特点,针对超说明书用药开展监测、评估工作, 并在行业内加强信息共享, 充分交流意见和经验。本专家意见对用药(特别是超说明书用药)带来的相关风险、纠纷等不承担法律义务。
编写专家组(按姓氏笔画排序):马小军(中国医学科学院北京协和医院)、马青变(北京大学第三医院)、卢晓阳(浙江大学医学院附属第一医院)、史录文(北京大学医药管理国际研究中心)、吕晓菊(四川大学华西医院)、朱光发(首都医科大学附属北京安贞医院)、刘正印(中国医学科学院北京协和医院)、刘丽宏(首都医科大学附属北京朝阳医院)、齐文杰(首都医科大学附属北京友谊医院)、李秉璐(中国医学科学院北京协和医院)、杨文杰(天津市第一中心医院)、杨帆(复旦大学附属华山医院)、杨启文(中国医学科学院北京协和医院)、余斌(南方医科大学附属南方医院)、张文宏(复旦大学附属华山医院)、陈辉(北京积水潭医院)、林阳(首都医科大学附属北京安贞医院)、林进(中国医学科学院北京协和医院)、林丽开(武汉大学医院管理研究所)、卓超(广州医科大学附属第一医院呼吸疾病国家重点实验室)、易慧敏(中山大学附属第三医院)、罗国华(中国医学科学院阜外医院)、周宝桐(中国医学科学院北京协和医院)、郑波(北京大学第一医院)、宗志勇(四川大学华西医院)、封宇飞(北京大学人民医院)、侯宁(山东省立医院)、逄崇杰(天津医科大学总医院)、黄英姿(东南大学附属中大医院)、葛瑛(中国医学科学院北京协和医院)、童朝晖(首都医科大学附属北京朝阳医院)、曾军(广州市第一人民医院)、谢利霞(深圳市第六人民医院)、虞敏(上海市第一人民医院)、魏俊吉(中国医学科学院北京协和医院)。
| [1] |
Bai AD, Showler A, Burry L, et al. Impact of infectious disease consultation on quality of care, mortality, and length of stay in Staphylococcus aureus bacteremia: results from a large multicenter cohort study[J]. Clin Infect Dis, 2015, 60(10): 1451-1461. DOI:10.1093/cid/civ120 |
| [2] |
Tong SY, Davis JS, Eichenberger E, et al. Staphylococcus aureus infections:epidemiology, pathophysiology, clinical manifestations, and management[J]. Clin Microbiol Rev, 2015, 28(3): 603-661. DOI:10.1128/CMR.00134-14 |
| [3] |
Yombi JC, Yuma SN, Pasquet A, et al. Staphylococcal versus Streptococcal infective endocarditis in a tertiary hospital in Belgium: epidemiology, clinical characteristics and outcome[J]. Acta Clin Belg, 2017, 72(6): 417-423. DOI:10.1080/17843286.2017.1309341 |
| [4] |
World Health Organization. Antimicrobial resistance: global report on surveillance 2014[EB/OL].(2014-02)[2019-07]. http://www.searo.who.int/thailand/publications/2013/9789241564748_eng.pdf.
|
| [5] |
Tacconelli E, Carrara E, Savoldi A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327. DOI:10.1016/S1473-3099(17)30753-3 |
| [6] |
张静, 喻玮, 赵丽娜, 等. 我国细菌耐药现状与特征[J]. 中华临床感染病杂志, 2016, 9(2): 118-128. DOI:10.3760/cma.j.issn.1674-2397.2016.02.005 |
| [7] |
胡付品, 郭燕, 朱德妹, 等. 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2017, 17(5): 481-491. |
| [8] |
胡付品, 朱德妹, 汪复, 等. 2015年CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(6): 685-694. |
| [9] |
王传清, 王爱敏, 俞蕙, 等. 2016年儿童细菌耐药监测[J]. 中华儿科杂志, 2018, 56(1): 29-33. DOI:10.3760/cma.j.issn.0578-1310.2018.01.008 |
| [10] |
朱德妹, 汪复, 胡付品, 等. 2010年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2011, 11(5): 321-329. |
| [11] |
胡付品, 朱德妹, 汪复, 等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2014, 14(5): 365-374. DOI:10.3969/j.issn.1009-7708.2014.05.001 |
| [12] |
胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2015, 15(5): 401-410. DOI:10.3969/j.issn.1009-7708.2015.05.001 |
| [13] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [14] |
孙明月, 李丽, 张蓓, 等. 万古霉素耐药肠球菌属分子特征及遗传背景的研究[J]. 中华检验医学杂志, 2014, 37(3): 210-212. DOI:10.3760/cma.j.issn.1009-9158.2014.03.012 |
| [15] |
Pfaller MA, Flamm RK, Duncan LR, et al. Antimicrobial activity of ceftobiprole and comparator agents when tested against contemporary gram-positive and -negative organisms collected from Europe (2015)[J]. Diagn Microbiol Infect Dis, 2018, 91(1): 77-84. DOI:10.1016/j.diagmicrobio.2017.12.020 |
| [16] |
David MZ, Dryden M, Gottlieb T, et al. Recently approved antibacterials for methicillin-resistant Staphylococcus aureus (MRSA) and other gram-positive pathogens: the shock of the new[J]. Int J Antimicrob Agents, 2017, 50(3): 303-307. DOI:10.1016/j.ijantimicag.2017.05.006 |
| [17] |
van Hal SJ, Lodise TP, Paterson DL. The clinical significance of vancomycin minimum inhibitory concentration in Staphylococcus aureus infections: a systematic review and meta-analysis[J]. Clin Infect Dis, 2012, 54(6): 755-771. DOI:10.1093/cid/cir935 |
| [18] |
Debono M, Barnhart M, Carrell CB, et al. A21978C, a complex of new acidic peptide antibiotics: isolation, chemistry, and mass pectral structure elucidation[J]. J Antibiot(Tokyo), 1987, 40(6): 761-777. DOI:10.7164/antibiotics.40.761 |
| [19] |
Baltz RH, McHenney MA, Hosted TJ. Genetics of lipopeptide antibiotic biosynthesis in Streptomyces fradiae A54145 and Streptomyces roseosporus A21978C[J]. Dev Ind Microbiol, 1997, 34: 93-98. |
| [20] |
Allen NE, Hobbs JN, Alborn WE Jr. Inhibition of peptidoglycan biosynthesis in gram-positive bacteria by LY146032[J]. Antimicrob Agents Chemother, 1987, 31(7): 1093-1099. DOI:10.1128/AAC.31.7.1093 |
| [21] |
Huber FM, Pieper RL, Tietz AJ. The formation of daptomycin by supplying decanoic acid to Streptomyces roseosporus cultures producing the antibiotic complex A21978C[J]. J Biotechnol, 1988, 7(4): 283-292. DOI:10.1016/0168-1656(88)90040-5 |
| [22] |
Manfredi R, Sabbatani S. Novel pharmaceutical molecules against emerging resistant gram-positive cocci[J]. Braz J Infect Dis, 2010, 14(1): 96-108. DOI:10.1016/S1413-8670(10)70020-9 |
| [23] |
Bradley J, Glasser C, Patino H, et al. Daptomycin for complicated skin infections: a randomized trial[J]. Pediatrics, 2017, 139(3): e20162477. DOI:10.1542/peds.2016-2477 |
| [24] |
Cottagnoud P. Daptomycin: a new treatment for insidious infections due to gram-positive pathogen[J]. Swiss Med Wkly, 2008, 138(7-8): 93-99. |
| [25] |
Vilhena C, Bettencourt A. Daptomycin: a review of properties, clinical use, drug delivery and resistance[J]. Mini Rev Med Chem, 2012, 12(3): 202-209. DOI:10.2174/1389557511209030202 |
| [26] |
Müller A, Wenzel M, Strahl H, et al. Daptomycin inhibits cell envelope synthesis by interfering with fluid membrane microdomains[J]. Proc Natl Acad Sci USA, 2016, 113(45): E7077-E7086. DOI:10.1073/pnas.1611173113 |
| [27] |
Jujjavarapu SE, Dhagat S, Kurrey V. Identification of novel ligands for therapeutic lipopeptides daptomycin, surfactin and polymyxin[J]. Curr Drug Targets, 2018, 19(13): 1589-1598. DOI:10.2174/1389450119666171129164932 |
| [28] |
Baltz RH, Brian P, Miao V, et al. Combinatorial biosynthesis of lipopeptide antibiotics in Streptomyces roseosporus[J]. J Ind Microbiol Biotechnol, 2006, 33(2): 66-74. DOI:10.1007/s10295-005-0030-y |
| [29] |
Taylor R, Butt K, Scott B, et al. Two successive calcium-dependent transitions mediate membrane binding and oligomeri-zation of daptomycin and the related antibiotic A54145[J]. Biochim Biophys Acta, 2016, 1858(9): 1999-2005. DOI:10.1016/j.bbamem.2016.05.020 |
| [30] |
Silverman JA, Perlmutter NG, Shapiro HM. Correlation of daptomycin bactericidal activity and membrane depolarization in Staphylococcus aureus[J]. Antimicrob Agents Chemother, 2003, 47(8): 2538-2544. DOI:10.1128/AAC.47.8.2538-2544.2003 |
| [31] |
洪娟, 刘佳佳. 达托霉素的作用机制和药物来源的研究进展[J]. 广州化工, 2012, 40(9): 28-30. DOI:10.3969/j.issn.1001-9677.2012.09.010 |
| [32] |
Sader HS, Farrell DJ, Jones RN. Antimicrobial activity of daptomycin tested against gram-positive strains collected in European hospitals: results from 7 years of resistance surveillance(2003-2009)[J]. J Chemother, 2011, 23(4): 200-206. DOI:10.1179/joc.2011.23.4.200 |
| [33] |
张菲菲, 赵春江, 王占伟, 等. 达托霉素对2679株革兰阳性球菌外抗菌活性的研究[J]. 中华内科杂志, 2013, 52(6): 474-479. DOI:10.3760/cma.j.issn.0578-1426.2013.06.008 |
| [34] |
Sweetman SC. Martindale: the complete drug reference(马丁代尔药物大典)[M]. 37th ed, United Kingdom, Pharmaceutical Press, 2011: 250.
|
| [35] |
Bartlett JG, Auwaerter PG, Pham PA. Johns Hopkins ABX guide: diagnosis and treatment of infectious diseases 2012[M]. 3rd ed, USA, Jones & Bartlett Learning, 2012: 630.
|
| [36] |
Landrum ML, Neumann C, Cook C, et al. Epidemiology of Staphylococcus aureus blood and skin and soft tissue infections in the US military health system, 2005-2010[J]. JAMA, 2012, 308(1): 50-59. |
| [37] |
El Atrouni WI, Knoll BM, Lahr BD, et al. Temporal trends in incidence of Staphylococcus aureus bacteremia in Olmsted County, Minnesota, 1998 to 2005: a population-based study[J]. Clin Infect Dis, 2009, 49(12): e130-e138. DOI:10.1086/648442 |
| [38] |
van Hal SJ, Jensen SO, Vaska VL, et al. Predictors of mortality in Staphylococcus aureus bacteremia[J]. Clin Microbiol Rev, 2012, 25(2): 362-386. DOI:10.1128/CMR.05022-11 |
| [39] |
Cosgrove SE, Sakoulas G, Perencevich EN, et al. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis[J]. Clin Infect Dis, 2002, 36(1): 53-59. |
| [40] |
Kaasch AJ, Barlow G, Edgeworth JD, et al. Staphylococcus aureus bloodstream infection: a pooled analysis of five prospective, observational studies[J]. J Infect, 2014, 68(3): 242-251. DOI:10.1016/j.jinf.2013.10.015 |
| [41] |
Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J]. Clin Infect Dis, 2011, 52(3): e18-e55. DOI:10.1093/cid/ciq146 |
| [42] |
Culshaw D, Lamp KC, Yoon MJ, et al. Duration of prior vancomycin therapy and subsequent daptomycin treatment outcomes in methicillin-resistant Staphylococcus aureus bacteremia[J]. Diagn Microbiol Infect Dis, 2015, 83(2): 193-197. DOI:10.1016/j.diagmicrobio.2015.06.003 |
| [43] |
Deresinski S. Counterpoint: vancomycin and Staphylococcus aureus-an antibiotic enters obsolescence[J]. Clin Infect Dis, 2007, 44(12): 1543-1548. DOI:10.1086/518452 |
| [44] |
van Hal SJ, Lodise TP, Paterson DL. The clinical significance of vancomycin minimum inhibitory concentration in Staphylococcus aureus infections: a systematic review and meta-analysis[J]. Clin Infect Dis, 2012, 54(6): 755-771. DOI:10.1093/cid/cir935 |
| [45] |
Holubar M, Meng L, Deresinski S. Bacteremia due to methicillin-resistant Staphylococcus aureus: new therapeutic approaches[J]. Infect Dis Clin North Am, 2016, 30(2): 491-507. DOI:10.1016/j.idc.2016.02.009 |
| [46] |
Gould FK, Brindle R, Chadwick PR, et al. Guidelines (2008) for the prophylaxis and treatment of methicillin-resistant Staphylococcus aureus (MRSA) infections in the United Kingdom[J]. J Antimicrob Chemother, 2009, 63(5): 849-861. DOI:10.1093/jac/dkp065 |
| [47] |
Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 49(1): 1-45. |
| [48] |
Habib G, Hoen B, Tornos P, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the task force on the prevention, diagnosis, and treatment of infective endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer[J]. Eur Heart J, 2009, 30(19): 2369-2413. DOI:10.1093/eurheartj/ehp285 |
| [49] |
Dohmen PM, Guleri A, Capone A, et al. Daptomycin for the treatment of infective endocarditis: results from a European registry[J]. J Antimicrob Chemother, 2013, 68(4): 936-942. DOI:10.1093/jac/dks467 |
| [50] |
Guleri A, Utili R, Dohmen P, et al. Daptomycin for the treatment of infective endocarditis: results from European Cubicin(®) Outcomes Registry and Experience (EU-CORE)[J]. Infect Dis Ther, 2015, 4(3): 283-296. DOI:10.1007/s40121-015-0075-9 |
| [51] |
Yazaki M, Oami T, Nakanishi K, et al. A successful salvage therapy with daptomycin and linezolid for right-sided infective endocarditis and septic pulmonary embolism caused by methicillin-resistant Staphylococcus aureus[J]. J Infect Chemother, 2018, 24(10): 845-848. DOI:10.1016/j.jiac.2018.02.006 |
| [52] |
Baddour LM, Epstein AE, Erickson CC, et al. Update on cardiovascular implantable electronic device infections and their management: a scientific statement from the American Heart Association[J]. Circulation, 2010, 121(3): 458-477. DOI:10.1161/CIRCULATIONAHA.109.192665 |
| [53] |
Tascini C, Bongiorni MG, Di Cori A, et al. Cardiovascular implantable electronic device endocarditis treated with daptomycin with or without transvenous removal[J]. Heart Lung, 2012, 41(6): e24-e30. DOI:10.1016/j.hrtlng.2012.02.002 |
| [54] |
Raad I, Hanna H, Jiang Y, et al. Comparative activities of daptomycin, linezolid, and tigecycline against catheter-related methicillin-resistant Staphylococcus bacteremic isolates embedded in biofilm[J]. Antimicrob Agents Chemother, 2007, 51(5): 1656-1660. DOI:10.1128/AAC.00350-06 |
| [55] |
Vandenhende MA, Buret J, Camou F, et al. Successful daptomycin lock therapy for implantable intra-arterial catheter infection in a patient with liver metastases of colon cancer[J]. Diagn Microbiol Infect Dis, 2014, 78(4): 497-498. DOI:10.1016/j.diagmicrobio.2014.01.006 |
| [56] |
Arnaiz de Las Revillas F, Fernandez-Sampedro M, Arnaiz-García AM. Daptomycin treatment in gram-positive vascular graft infections[J]. Int J Infect Dis, 2018, 68: 69-73. DOI:10.1016/j.ijid.2018.01.009 |
| [57] |
Beiras-Fernandez A, Kur F, Kiefer S, et al. Multidrug-resis-tant gram-positive infections in patients with ventricular assist devices: the role of daptomycin[J]. Transplant Proc, 2009, 41(6): 2589-2591. DOI:10.1016/j.transproceed.2009.06.126 |
| [58] |
Fung HB, Chang JY, Kuczynski S. A practical guide to the treatment of complicated skin and soft tissue infections[J]. Drugs, 2003, 63(14): 1459-1480. DOI:10.2165/00003495-200363140-00003 |
| [59] |
Gould FK, Denning DW, Elliott TS, et al. Guidelines for the diagnosis and antibiotic treatment of endocarditis in adults: a report of the Working Party of the British Society for Antimicrobial Chemotherapy[J]. J Antimicrob Chemother, 2012, 67(2): 269-289. DOI:10.1093/jac/dkr450 |
| [60] |
Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis: the task force for the management of infective endocarditis of the European Society of Cardiology(ESC). Endorsed by: European Association for Cardio-Thoracic Surgery(EACTS), the European Association of Nuclear Medicine(EANM)[J]. Eur Heart J, 2015, 36(44): 3075-3123. DOI:10.1093/eurheartj/ehv319 |
| [61] |
Baddour LM, Wilson WR, Bayer AS, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association[J]. Circulation, 2015, 132(15): 1435-1486. DOI:10.1161/CIR.0000000000000296 |
| [62] |
Carugati M, Bayer AS, Miró JM, et al. High-dose daptomycin therapy for left-sided infective endocarditis: a prospective study from the international collaboration on endocarditis[J]. Antimicrob Agents Chemother, 2013, 57(12): 6213-6222. DOI:10.1128/AAC.01563-13 |
| [63] |
Siciliano RF, Randi BA, Gualandro DM, et al. Early onset prosthetic valve endocarditis definition revisited: prospective study and literature review[J]. Int J Infect Dis, 2018, 67(2): 3-6. |
| [64] |
Smith JR, Claeys KC, Barber KE, et al. High-dose daptomycin therapy for staphylococcal endocarditis and when to apply it[J]. Curr Infect Dis Rep, 2014, 16(10): 429. DOI:10.1007/s11908-014-0429-6 |
| [65] |
Baddour LM, Wilson WR, Bayer AS, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association[J]. Circulation, 2015, 132(15): 1435-1486. DOI:10.1161/CIR.0000000000000296 |
| [66] |
Levine DP. Clinical experience with daptomycin: bacteraemia and endocarditis[J]. J Antimicrob Chemother, 2008, 62(Suppl 3): ⅲ35-ⅲ39. |
| [67] |
Segreti JA, Crank CW, Finney MS. Daptomycin for the treatment of gram-positive bacteremia and infective endocarditis: a retrospective case series of 31 patients[J]. Pharmacotherapy, 2006, 26(3): 347-352. DOI:10.1592/phco.26.3.347 |
| [68] |
Lübbert C, Rodloff AC, Hamed K. Real-world treatment of enterococcal infections with daptomycin: insights from a large European registry(EU-CORE)[J]. Infect Dis Ther, 2015, 4(3): 259-271. DOI:10.1007/s40121-015-0072-z |
| [69] |
Hall AD, Steed ME, Arias CA, et al. Evaluation of standard- and high-dose daptomycin versus linezolid against vancomycin-resistant Enterococcus isolates in an in vitro pharmacokinetic/pharmacodynamic model with simulated endocardial vegetations[J]. Antimicrob Agents Chemother, 2012, 56(6): 3174-3180. DOI:10.1128/AAC.06439-11 |
| [70] |
Luther MK, Arvanitis M, Mylonakis E, et al. Activity of daptomycin or linezolid in combination with rifampin or gentamicin against biofilm forming Enterococcus faecalis or E. faecium in an in vitro pharmacodynamic model using simulated endocardial vegetations and an in vivo survival assay using Galleria mellonella larvae[J]. Antimicrob Agents Chemother, 2014, 58(8): 4612-4620. DOI:10.1128/AAC.02790-13 |
| [71] |
Britt NS, Potter EM, Patel N, et al. Comparison of the effectiveness and safety of linezolid and daptomycin in vancomycin-resistant enterococcal bloodstream infection: a national cohort study of Veterans Affairs patients[J]. Clin Infect Dis, 2015, 61(6): 871-878. DOI:10.1093/cid/civ444 |
| [72] |
Chuang YC, Wang JT, Lin HY, et al. Daptomycin versus linezolid for treatment of vancomycin-resistant enterococcal bacteremia: systematic review and meta-analysis[J]. BMC Infect Dis, 2014, 14: 687. DOI:10.1186/s12879-014-0687-9 |
| [73] |
Sakoulas G, Nonejuie P, Nizet V, et al. Treatment of high-level gentamicin-resistant Enterococcus faecalis endocarditis with daptomycin plus ceftaroline[J]. Antimicrob Agents Chemother, 2013, 57(8): 4042-4045. DOI:10.1128/AAC.02481-12 |
| [74] |
Smith JR, Barber KE, Raut A, et al. β-lactam combinations with daptomycin provide synergy against vancomycin-resistant Enterococcus faecalis and Enterococcus faecium[J]. J Antimicrob Chemother, 2015, 70(6): 1738-1743. |
| [75] |
Tang HJ, Chen CC, Zhang CC, et al. In vitro efficacy of fosfomycin-based combinations against clinical vancomycin-resis-tant Enterococcus isolates[J]. Diagn Microbiol Infect Dis, 2013, 77(3): 254-257. DOI:10.1016/j.diagmicrobio.2013.07.012 |
| [76] |
Casapao AM, Kullar R, Davis SL, et al. Multicenter study of high-dose daptomycin for treatment of enterococcal infections[J]. Antimicrob Agents Chemother, 2013, 57(9): 4190-4196. DOI:10.1128/AAC.00526-13 |
| [77] |
Foolad F, Taylor BD, Shelburne SA, et al. Association of daptomycin dosing regimen and mortality in patients with VRE bacteraemia: a review[J]. J Antimicrob Chemother, 2018, 73(9): 2277-2283. DOI:10.1093/jac/dky072 |
| [78] |
Balli EP, Venetis CA, Miyakis S. Systematic review and meta-analysis of linezolid versus daptomycin for treatment of vancomycin-resistant enterococcal bacteremia[J]. Antimicrob Agents Chemother, 2014, 58(2): 734-739. DOI:10.1128/AAC.01289-13 |
| [79] |
Gilbert DN, Chamber HF, Eliopoulos GM, et al. The Sanford guide to antimicrobial therapy(桑福德抗微生物治疗指南)[M]. 47th ed, USA, Antimicrobial Therapy, 2017: 82.
|
| [80] |
Zhanel GG, Laing NM, Nichol KA, et al. Antibiotic activity against urinary tract infection(UTI) isolates of vancomycin-resistant enterococci(VRE): results from the 2002 North American vancomycin resistant Enterococci susceptibility study(NAVRESS)[J]. J Antimicrob Chemother, 2003, 52(3): 382-388. DOI:10.1093/jac/dkg352 |
| [81] |
Fisher L, North D. Effectiveness of low-dose daptomycin in the treatment of vancomycin-resistant enterococcal urinary tract infections[J]. Int J Antimicrob Agents, 2009, 33(5): 493-494. DOI:10.1016/j.ijantimicag.2008.11.003 |
| [82] |
Heintz BH, Halilovic J, Christensen CL. Vancomycin-resis-tant enterococcal urinary tract infections[J]. Pharmacotherapy, 2010, 30(11): 1136-1149. DOI:10.1592/phco.30.11.1136 |
| [83] |
Ramaswamy DP, Amodio-Groton M, Scholand SJ. Use of daptomycin in the treatment of vancomycin-resistant enterococcal urinary tract infections: a short case series[J]. BMC Urol, 2013, 13: 33. DOI:10.1186/1471-2490-13-33 |
| [84] |
Li S, Guo Y, Zhao C, et al. In vitro activities of tedizolid compared with other antibiotics against gram-positive pathogens associated with hospital-acquired pneumonia, skin and soft tissue infection and bloodstream infection collected from 26 hospitals in China[J]. J Med Microbiol, 2016, 65(10): 1215-1224. DOI:10.1099/jmm.0.000347 |
| [85] |
Sader HS, Jones RN. The activity of daptomycin against wild-type Staphylococcus aureus and strains with reduced susceptibility to vancomycin[J]. Clin Infect Dis, 2006, 43(6): 798-799. DOI:10.1086/507109 |
| [86] |
Pfaller MA, Sader HS, Jones RN. Evaluation of the in vitro activity of daptomycin against 19 615 clinical isolates of gram-positive cocci collected in North American hospitals(2002-2005)[J]. Diagn Microbiol Infect Dis, 2007, 57(4): 459-465. DOI:10.1016/j.diagmicrobio.2006.10.007 |
| [87] |
Sader HS, Jones RN, Stilwell MG, et al. Tigecycline activity tested against 26, 474 bloodstream infection isolates: a collection from 6 continents[J]. Diagn Microbiol Infect Dis, 2005, 52(3): 181-186. DOI:10.1016/j.diagmicrobio.2005.05.005 |
| [88] |
Sader HS, Fritsche TR, Streit JM, et al. Daptomycin in vitro activity tested against gram-positive strains collected from European and Latin American medical centers in 2003[J]. J Chemother, 2005, 17(5): 477-483. DOI:10.1179/joc.2005.17.5.477 |
| [89] |
Kelesidis T, Humphries R, Uslan DZ, et al. Daptomycin nonsusceptible enterococci: an emerging challenge for clinicians[J]. Clin Infect Dis, 2011, 52(2): 228-234. DOI:10.1093/cid/ciq113 |
| [90] |
Munita JM, Murray BE, Arias CA. Daptomycin for the treatment of bacteraemia due to vancomycin-resistant enterococci[J]. Int J Antimicrob Agents, 2014, 44(5): 387-395. DOI:10.1016/j.ijantimicag.2014.08.002 |
| [91] |
Miller WR, Bayer AS, Arias CA. Mechanism of action and resistance to daptomycin in Staphylococcus aureus and enterococci[J]. Cold Spring Harb Perspect Med, 2016, 6(11): a026997. DOI:10.1101/cshperspect.a026997 |
| [92] |
Heidary M, Khosravi AD, Khoshnood S, et al. Daptomycin[J]. J Antimicrob Chemother, 2018, 73(1): 1-11. DOI:10.1093/jac/dkx349 |
| [93] |
Tran TT, Munita JM, Arias CA. Mechanisms of drug resis-tance: daptomycin resistance[J]. Ann N Y Acad Sci, 2015, 1354: 32-53. DOI:10.1111/nyas.12948 |
| [94] |
Britt NS, Potter EM, Patel N, et al. Comparative effectiveness and safety of standard-, medium-, and high-dose daptomycin strategies for the treatment of vancomycin-resistant enterococcal bacteremia among Veterans Affairs patients[J]. Clin Infect Dis, 2017, 64(5): 605-613. |
| [95] |
刘毅, 郑培浩, 岑坚, 等. 高剂量达托霉素挽救性治疗血液病感染19例临床观察[J]. 转化医学杂志, 2017, 6(6): 370-373. DOI:10.3969/j.issn.2095-3097.2017.06.013 |
| [96] |
王江峰, 范辉, 马珂. 以《中国药品综合评价指南参考大纲》为依据对达托霉素进行有效性评价[J]. 药品评价, 2016, 13(6): 19-23. DOI:10.3969/j.issn.1672-2809.2016.06.003 |
| [97] |
Bhavnani SM, Rubino CM, Ambrose PG, et al. Daptomycin exposure and the probability of elevations in the creatine phosphokinase level: data from a randomized trial of patients with bacteremia and endocarditis[J]. Clin Infect Dis, 2010, 50(12): 1568-1574. DOI:10.1086/652767 |
| [98] |
Oleson FB, Berman CL, Li AP. An evaluation of the P450 inhibition and induction potential of daptomycin in primary human hepatocytes[J]. Chem Biol Interact, 2004, 150(2): 137-147. DOI:10.1016/j.cbi.2004.08.004 |
| [99] |
Lemaire S, Van Bambeke F, Mingeot-Leclercq MP, et al. Modulation of the cellular accumulation and intracellular activity of daptomycin towards phagocytized Staphylococcus aureus by the P-glycoprotein(MDR1) efflux transporter in human THP-1 macrophages and madin-darby canine kidney cells[J]. Antimicrob Agents Chemother, 2007, 51(8): 2748-2757. DOI:10.1128/AAC.00090-07 |
| [100] |
Woodworth JR, Nyhart EH, Wolny JD, et al. Tobramycin and daptomycin disposition when co-administered to healthy volunteers[J]. J Antimicrob Chemother, 1994, 33(3): 655-659. DOI:10.1093/jac/33.3.655 |
| [101] |
Van der Auwera P. Ex vivo study of serum bactericidal titers and killing rates of daptomycin (LY146032) combined or not combined with amikacin compared with those of vancomycin[J]. Antimicrob Agents Chemother, 1989, 33(10): 1783-1790. DOI:10.1128/AAC.33.10.1783 |
| [102] |
Center for Drug Evaluation and Research. Approval package for: application number 21-572. Clinical pharmacology biopharmaceutics review[EB/OL]. (2004-10-22)[2019-06-21]. http://www.fda.gov/cder/foi/nda/2003/21-572_Cubicin_Biopharmr_PI.pdf.
|
| [103] |
Bland CM, Bookstaver PB, Lu ZK. Musculoskeletal safety outcomes of patients receiving daptomycin with HMG-CoA reductase inhibitors[J]. Antimicrob Agents Chemother, 2014, 58(10): 5726-5731. DOI:10.1128/AAC.02910-14 |
| [104] |
Cubicin(daptomycin) prescribing information[M]. UK: Merck Sharp & Dohme Corp, 2018.
|
| [105] |
Bradley JS, Nelson JD, Barnett E, et al. Nelson's pediatric antimicrobial therapy[M]. 23rd ed, USA, American Academy of Pediatrics, 2017.
|
| [106] |
Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines by the infectious diseases society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary[J]. Clin Infect Dis, 2011, 52(3): 285-292. DOI:10.1093/cid/cir034 |
| [107] |
Tsai D, Lipman J, Roberts JA. Pharmacokinetic/pharmacodynamic considerations for the optimization of antimicrobial delivery in the critically ill[J]. Curr Opin Crit Care, 2015, 21(5): 412-420. DOI:10.1097/MCC.0000000000000229 |
| [108] |
Vilay AM, Grio M, Depestel DD, et al. Daptomycin pharmacokinetics in critically ill patients receiving continuous venovenous hemodialysis[J]. Crit Care Med, 2011, 39(1): 19-25. |
| [109] |
Falcone M, Russo A, Venditti M, et al. Considerations for higher doses of daptomycin in critically ill patients with methicillin-resistant Staphylococcus aureus bacteremia[J]. Clin Infect Dis, 2013, 57(11): 1568-1576. DOI:10.1093/cid/cit582 |
| [110] |
Dvorchik B. Moderate liver impairment has no influence on daptomycin pharmacokinetics[J]. J Clin Pharmacol, 2004, 44(7): 715-722. DOI:10.1177/0091270004266619 |
| [111] |
Wenisch JM, Meyer B, Fuhrmann V, et al. Multiple-dose pharmacokinetics of daptomycin during continuous venovenous haemodiafiltration[J]. J Antimicrob Chemother, 2012, 67(4): 977-983. DOI:10.1093/jac/dkr551 |
| [112] |
Ulldemolins M, Roberts JA, Rello J, et al. The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients[J]. Clin Pharmacokinet, 2011, 50(2): 99-110. DOI:10.2165/11539220-000000000-00000 |
| [113] |
Mohr JF, Ostrosky-Zeichner L, Wainright DJ, et al. Pharmacokinetic evaluation of single-dose intravenous daptomycin in patients with thermal burn injury[J]. Antimicrob Agents Chemother, 2008, 52(5): 1891-1893. DOI:10.1128/AAC.01321-07 |
| [114] |
白向荣, 闫素英. 达托霉素治疗感染性心内膜炎的快速卫生技术评估研究[J]. 药物流行病学杂志, 2017, 26(2): 81-84. |
| [115] |
白向荣, 闫素英, 程红勤, 等. 达托霉素治疗皮肤及软组织感染的快速卫生经济技术评估研究[J]. 实用药物与临床, 2017, 20(2): 232-235. |
| [116] |
Rubio-Terrés C, Rubio-Rodríguez D, Majos N, et al. Pharmacoeconomic analysis of the treatment of methicillin-resistant Staphylococcus aureus with daptomycin or vancomycin[J]. Rev Esp Quimioter, 2012, 25(4): 283-292. |
| [117] |
Bounthavong M, Zargarzadeh A, Hsu DI, et al. Cost-effectiveness analysis of linezolid, daptomycin, and vancomycin in methicillin-resistant Staphylococcus aureus: complicated skin and skin structure infection using Bayesian methods for evidence synthesis[J]. Value Health, 2011, 14(5): 631-639. DOI:10.1016/j.jval.2010.12.006 |
| [118] |
刘皈阳, 王心慧, 陈召红. 超说明书用药问题的相关分析与思考[J]. 中国药物应用与监测, 2013, 10(3): 123-127. DOI:10.3969/j.issn.1672-8157.2013.03.001 |
| [119] |
广东省药学会. 医疗机构超药品说明书用药管理专家共识[J]. 今日药学, 2014, 24(12): 841-843. |



