内脏利什曼病(visceral leishmaniasis)亦称黑热病(kala-azar),是由利什曼原虫(Leishmania)引起的一种传染病,其传播媒介为白蛉。内脏利什曼病主要在印度、非洲及南美洲等地区流行,影响着贫困地区人们的健康,而且具有高度的潜在危害性,被世界卫生组织列入被忽视的热带病[1]。我国此病有明确的流行区域,虽然1958年内脏利什曼病被宣布消灭,但近年来,新疆、甘肃、内蒙、陕西、山西和四川等省份呈现散发态势[2]。内脏利什曼病是一种累及脾、肝、骨髓、淋巴结、肾、消化系统、呼吸系统、循环系统等多脏器、多系统损伤的疾病,其临床表现复杂且多样,如不治疗病死率可高达95%[3]。因此,本研究对2013年1月—2018年6月确诊的4例内脏利什曼病死亡患者的临床资料进行分析,以明确内脏利什曼病的临床特点和感染后实验室检测指标的变化特征,以期提高临床医生的诊治水平,正确诊治并判断预后,减少误诊,降低病死率。
1 对象与方法 1.1 研究对象首都医科大学附属北京友谊医院2013年1月—2018年6月收治的4例内脏利什曼病患者,均为死亡病例。收集患者的性别、年龄、民族、流行病学史(疫源地、发病季节、发病至确诊时间)、临床表现、既往史,以及入院期间血常规、肝功能、电解质、利什曼原虫IgG抗体、HIV抗体及骨髓涂片等实验室检验结果和影像学资料。
1.2 诊断标准参考《中华人民共和国卫生行业标准(WS 258-2006):黑热病诊断标准》,即有疫区流行病学史及临床症状,同时骨髓中查见利杜体为确诊病例。
1.3 试剂及仪器Giemsa染液、rk39免疫层析试条法检测利什曼原虫IgG抗体(美国INbios INS025 Kalazar DetectTM Rapid Test)、蔡司Axio Scope A1显微镜。
1.4 检测方法 1.4.1 Giemsa染色镜检采集患者骨髓液制作标准骨髓涂片,将其干燥、固定后使用Giemsa染色,再用蔡司Axio Scope A1显微镜镜检利什曼原虫(放大倍数×1 000)。
1.4.2 免疫学检测使用rk39免疫层析试条法对4例患者血样进行检测。取20 μL血清垂直加入检测卡,然后垂直滴加150 μL捕获缓冲液,10 min内判读结果。
1.5 统计学处理患者临床症状、体征及实验室结果等数据和资料,用Excel 2010建立数据库,应用SPSS 19.0软件进行描述性分析。
2 结果 2.1 一般资料4例患者均为男性,年龄44~74岁,均为汉族。患者均来自农村,地区分布为甘肃1例,安徽1例(发病前在甘肃打工),山西阳泉2例。发病季节为3、8、10、11月。
2.2 临床表现4例患者病程长短不一,但临床表现有相似之处,发热3例,最高体温为39~40℃,均为不规则热型,乏力、纳差2例,意识障碍(幻觉、胡言乱语、嗜睡) 2例。其他包括腹胀、腹痛、咳嗽、头晕等症状。常见体征为肝、脾大,双下肢肿胀,以及出血(口唇、鼻、血便、皮下出血点)。见表 1。
| 表 1 4例内脏利什曼病患者临床表现 Table 1 Clinical manifestations of 4 patients with visceral leishmaniasis |
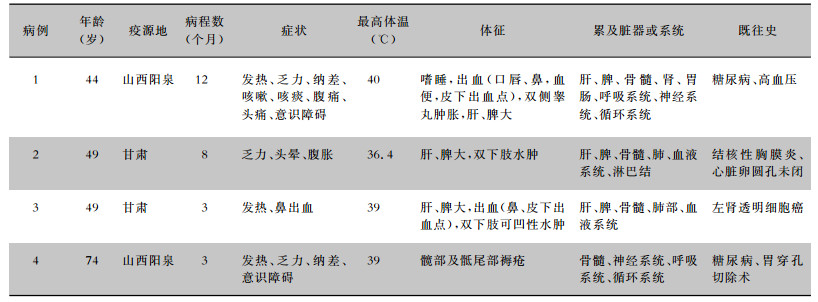
|
4例患者多次复查血常规均提示白细胞、红细胞及血小板明显降低,其中白细胞可低至0.7×109/L,最高未超过2.78×109/L[正常值(3.50~9.50)×109/L]。血小板最低可至8×109/L,最高未超过77×109/L[正常值(125~350)×109/L]。4例患者亦有贫血表现,血红蛋白降低,波动于49~77 g/L[正常值(130~175)×109/L]。见表 2。
| 表 2 4例内脏利什曼病患者实验室检查结果 Table 2 Laboratory findings in 4 patients with visceral leishmaniasis |
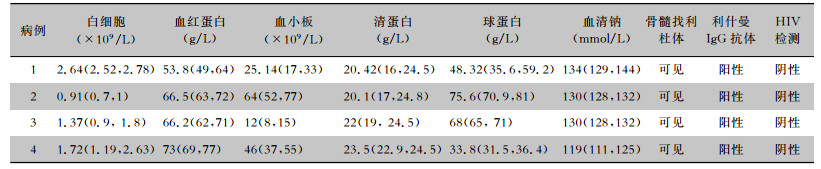
|
4例患者的血清清蛋白均降低,最低可至16 g/L,最高不超过24.8 g/L(正常值为40.0~55.0 g/L)。血清球蛋白,4例患者中有3例明显增高,最高可升高至81 g/L(正常值为20.0~40.0 g/L)。见表 2。
2.5 电解质变化4例患者均出现低钠血症,Na+的浓度最低可至111 mmol/L(正常值为137.0~147.0 mmol/L)。见表 2。
2.6 骨髓病原体检查4例患者骨髓涂片中均找到利什曼原虫无鞭毛体,证实均为内脏利什曼原虫感染,见表 2及图 1A。
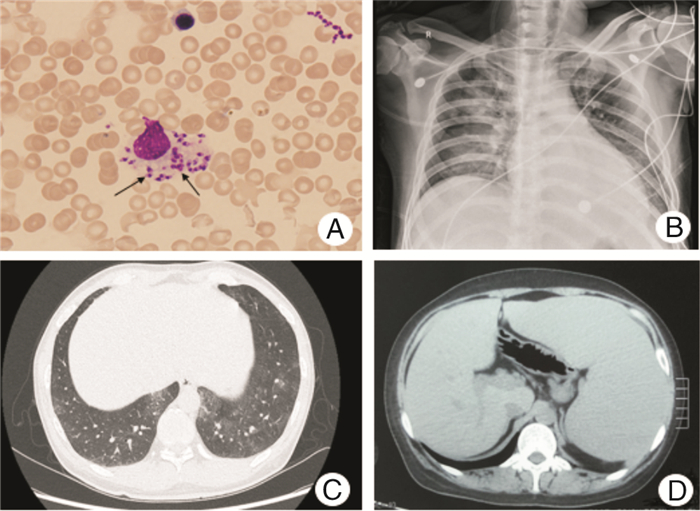 |
| A:患者骨髓涂片可见利杜体(箭头所指,× 1 000);B:X线提示右肺部病变;C:胸部CT可见肺部间质性病变;D:腹部CT提示肝、脾增大 图 1 内脏利什曼病患者骨髓涂片、胸部X线、CT及腹部CT结果 Figure 1 Bone marrow smear, chest X ray, chest CT, and abdominal CT for patients with visceral leishmaniasis |
采静脉血行利什曼原虫IgG抗体检测,4例患者均为阳性。HIV抗体检测均为阴性。见表 2。
2.8 影像学检查胸部X线检查:1例双肺斑片影及斑点影;1例右肺大片状实变影;1例右上肺野可见条索影,右肺门增大;1例胸部CT可见肺部间质性病变。腹部超声检查中3例脾大,2例肝大,1例肝脏密度欠均匀,肝脾大小正常。1例腹部CT提示肝增大。见图 1B~D。
2.9 误诊情况4例患者初诊时均被误诊,从发病到明确诊断间隔3~12个月,2例误诊肺炎,其余2例分别被误诊为菌血症、噬血细胞综合症。
3 讨论内脏利什曼病的临床表现多样而复杂,常被误诊为再生障碍性贫血,肝炎、慢性胃炎等消化系统疾病,以及上呼吸道、肺部感染等呼吸系统疾病。本组患者发病时表现为发热、咳嗽、腹痛等不典型症状,在初次就诊时均被误诊,经过3~12个月才得以确诊。疾病诊治的延误导致患者的病情加重、恶化,增加其病死率,即使给予葡萄糖酸锑钠的治疗,仍无法逆转病程,挽回生命。何芳[4]报道的46例黑热病患儿中,有3例因入院前的病程较长,合并严重并发症而死亡。因此,早期诊断,缩短患者的病程,可降低内脏利什曼病患者的病死率。
内脏利什曼病是一个累及多脏器、多系统的疾病[5]。本组病例中的患者均存在多系统、脏器的损伤,除常见的肝、脾、骨髓及淋巴结外,还出现了累及胃肠、呼吸、神经、循环等系统的损伤,与利什曼原虫的作用机制密切相关。引起内脏利什曼病的病原体利什曼原虫,其无鞭毛体侵入单核吞噬细胞后不会被杀死,反而可以在细胞内进行繁殖。吞噬细胞被胀破后,释放出的无鞭毛体又被其他吞噬细胞所吞噬,继续繁殖。单核吞噬细胞系统包括结缔组织巨噬细胞、肝库普弗细胞、神经组织小胶质细胞等,全身各脏器系统均存在被利什曼原虫损伤的可能。苏桂华等[6]报道228例儿童黑热病中,4例患儿出现多脏器功能衰竭而死亡。内脏利什曼病的患者累及的脏器或系统越多,病死率越高。
徐俊梅等[7]研究表明,在儿童内脏利什曼病中,中枢神经系统并不受累。而本组4例成年病例中,有3例患者出现中枢神经系统的症状,其中2例表现为意识障碍(瞻望及胡言乱语)。国内学者虽未提及成年人内脏利什曼病是否有中枢神经系统的受累,但有文献中提到患者有头晕、头痛等症状[8]。虽然内脏利什曼病患者的神经系统表现甚为罕见,但有学者提出此病可以累及神经系统,其中包括中枢神经系统和周围神经系统。中枢神经则表现为脑膜炎的症状,而周围神经系统的损伤表现为双足灼烧感、足下垂、耳聋[9]。个案报道显示,在10岁患儿脑脊液中发现了无鞭毛体,16月龄内脏利什曼病患儿头颅核磁显示脑萎缩,以白质萎缩为著[10-11]。利什曼原虫侵入神经系统的方式未知,其作用机制还需进一步去探究。本组患者在发病初期即出现中枢神经系统表现,与其高病死率可能存在一定的关系,所以在临床工作中遇到此类患者,考虑内脏利什曼病的同时也要警惕其高病死率的风险。
全血细胞的减少,伴有肝、脾大是临床考虑内脏利什曼病的重要线索。脾功能的亢进,加重外周血常规三系的降低。本研究中有3例患者存在不同程度的肝、脾大。同时4例患者外周血的白细胞、血红蛋白及血小板水明显降低,与高芹等[12]研究内脏利什曼病患者96%的病例出现外周血常规三系减低的结果一致。本组病例中,患者的白细胞可低至0.7×109/L,血红蛋白49 g/L,血小板为8×109/L,而刘真真等[13]报道的未死亡患者,49%的白细胞>2×109/L,91%的血红蛋白>60 g/L及95%的血小板> 20×109/L,推测利什曼原虫病患者的血常规三系降低的幅度越大,其死亡风险越高,当然仍需进一步扩大样本量去验证。因此,内脏利什曼病患者外周血常规三系降低的同时伴有肝、脾大,是内脏利什曼病的重要临床特征。三系降低得越明显,死亡的风险越高,预后越差。
低蛋白血症是内脏利什曼病常见的表现之一,肝功能紊乱,合成的清蛋白减少及肠道病变造成清蛋白吸收障碍,均可造成血清中清蛋白的降低。本研究中患者均存在血清清蛋白降低的表现,血清清蛋白减少,有效渗透压减低,使组织间水分潴留,出现不同程度的水肿。4例患者中3例出现双下肢及睾丸皮肤的水肿。血清清蛋白也是机体营养状况的指标之一,本组病例中1例患者因长期的营养状况低下,发展到后期氮负平衡,皮下脂肪和骨骼肌显著消耗,患者日益消瘦,长期卧床,致使身体的低垂部位形成褥疮,创面经久不愈。清蛋白的水平与内脏利什曼病的严重程度密切相关,文献[14]报道低蛋白血症及其所致的水肿是内脏利什曼病患者死亡的重要危险因素。一项队列研究[15]显示,血清清蛋白低于25g/L是内脏利什曼病预后差的重要因素。因此,血清清蛋白水平可作为一种预测指标,判断重症患者的预后。
本组4例患者均存在低钠血症,与国外报道一致,在内脏利什曼病中低钠血症的发生率达90%以上[16]。巴西一项研究显示,285例内脏利什曼病患者,34例死亡患者的血钠平均为(130.6±5.4)mmol/L。死亡患者与非死亡患者低钠血症的发生率分别为41.9%、24.1%(P=0.035)[17],说明低钠血症是内脏利什曼病死亡的高风险因素。此病中低血钠症发生的机制较为复杂,可包括患者呕吐,腹泻, 体液丢失过多; 或组织间隙中液体集聚, 水钠储留, 而出现低钠血症; 也可以是激素分泌水平的改变,肾素-血管紧张素-醛固酮系统的激活,激素分泌的增加, 引起体内水和钠的潴留。本组4例患者低蛋白血症的同时存在低钠血症,这种现象在肾病综合征、肝硬化、蛋白丢失性的胃肠道疾病,以及充血性心力衰竭的患者中也常伴随出现。内脏利什曼病的低蛋白血症可能加重或促进低血钠症的出现,可能与其生理基础相关,清蛋白在表面为负电荷,可以吸引带正电荷的钠离子,当清蛋白降低,这种吸引的作用降低。低蛋白血症与低血钠症的伴随出现与内脏利什曼病死亡高度相关[17],因此,临床中需要高度关注此类患者。
由此可见,内脏利什曼病患者出现病程长,多脏器损伤,累及中枢神经系统,外周血三系降低,低蛋白血症,以及低钠血症均与临床预后密切相关,是引起死亡的危险因素,临床医生在工作中要提高对黑热病多系统、多脏器损伤的认识,拓宽自己的诊疗思路,同时及时发现患者临床表现及指标的变化,重视其警示作用,给予正确诊治并判断预后。
| [1] |
Hotez PJ, Pecoul B, Rijal S, et al. Eliminating the neglected tropical diseases:translational science and new technologies[J]. PLoS Negl Trop Dis, 2016, 10(3): e0003895. DOI:10.1371/journal.pntd.0003895 |
| [2] |
Lun ZR, Wu MS, Chen YF, et al. Visceral leishmaniasis in China:an endemic disease under control[J]. Clin Microbiol Rev, 2015, 28(4): 987-1004. DOI:10.1128/CMR.00080-14 |
| [3] |
Silva Junior GB, Barros EJ, Daher Ede F. Kidney involvement in leishmaniasis-a review[J]. Braz J Infect Dis, 2014, 18(4): 434-440. DOI:10.1016/j.bjid.2013.11.013 |
| [4] |
何芳. 儿童黑热病46例临床分析[J]. 临床儿科杂志, 2017, 35(3): 191-194. DOI:10.3969/j.issn.1000-3606.2017.03.009 |
| [5] |
Georgiadou SP, Stefos A, Spanakos G, et al. Current clinical, laboratory, and treatment outcome characteristics of visceral leishmaniasis:results from a seven-year retrospective study in Greece[J]. Int J Infect Dis, 2015, 34: 46-50. DOI:10.1016/j.ijid.2015.02.021 |
| [6] |
苏桂华, 李修萍. 黑热病31例误诊原因分析[J]. 临床误诊误治, 2010, 23(10): 959-960. DOI:10.3969/j.issn.1002-3429.2010.10.040 |
| [7] |
徐俊梅, 邹洋. 儿童黑热病的诊治及分析[J]. 中国医刊, 2015, 50(11): 108-110. DOI:10.3969/j.issn.1008-1070.2015.11.037 |
| [8] |
吴红卫, 李书武, 胡丹, 等. 黑热病流行病学及临床特征分析[J]. 湖南师范大学学报(医学版), 2013, 10(3): 88-89, 93. |
| [9] |
Petersen CA, Greenlee MH. Neurologic manifestations of leishmania spp. infection[J]. J Neuroparasitology, 2011, 2, pii: N110401. |
| [10] |
Prasad LS, Sen S. Migration of Leishmania donovani amastigotes in the cerebrospinal fluid[J]. Am J Trop Med Hyg, 1996, 55(6): 652-654. DOI:10.4269/ajtmh.1996.55.652 |
| [11] |
Diniz LM, Duani H, Freitas CR, et al. Neurological involvement in visceral leishmaniasis:case report[J]. Rev Soc Bras Med Trop, 2010, 43(6): 743-745. DOI:10.1590/S0037-86822010000600031 |
| [12] |
高芹, 刘焱斌, 钟册俊, 等. 137例内脏利什曼病患者临床分析[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(2): 135-137. |
| [13] |
刘真真, 唐光敏, 叶慧, 等. 黑热病79例临床诊治回顾性分析[J]. 临床荟萃, 2015, 30(3): 316-318. |
| [14] |
Belo VS, Struchiner CJ, Barbosa DS, et al. Risk factors for adverse prognosis and death in American visceral leishmaniasis:A Meta-analysis[J]. PLoS Negl Trop Dis, 2014, 8(7): e2982. DOI:10.1371/journal.pntd.0002982 |
| [15] |
Mourão MV, Toledo A Jr, Gomes LI, et al. Parasite load and risk factors for poor outcome among children with visceral leishmaniasis.A cohort study in Belo Horizonte, Brazil, 2010-2011[J]. Mem Inst Oswaldo Cruz, 2014, 109(2): 147-153. DOI:10.1590/0074-0276140257 |
| [16] |
Agenor Araújo Lima Verde F, Araújo Lima Verde F, De Francesco Daher E, et al. Renal tubular dysfunction in human visceral leishmaniasis (Kala-azar)[J]. Clin Nephrol, 2009, 71(5): 492-500. DOI:10.5414/CNP71492 |
| [17] |
Daher EF, Soares DS, Filho SL, et al. Hyponatremia and risk factors for death in human visceral leishmaniasis:new insights from a cross-sectional study in Brazil[J]. BMC Infect Dis, 2017, 17(1): 168. DOI:10.1186/s12879-017-2257-4 |



