磷霉素(fosfomycin,C3H7PO4)是一种磷酸盐衍生物,1969年美国MERCK公司和西班牙CEP公司从西班牙土壤中分离了几种链霉菌(S. fradiae, S. wedomorensis和S. viridochromogenes)[1-2],从其发酵液中得到了这种天然广谱抗生素。2006年美国伊利诺伊大学成功将磷霉素合成的必需基因克隆到非原始宿主内,获得了磷霉素产量大幅增高的基因工程菌,使磷霉素得以人工合成,大规模用于临床[3]。磷霉素作用于细菌细胞壁合成的早期阶段,通过与催化肽聚糖合成的磷酸烯醇丙酮酸转移酶(MurA)不可逆结合,抑制该酶活性,影响细胞壁合成发挥作用,属繁殖期快速杀菌药,对临床常见革兰阳性菌和阴性菌均具有良好的抗菌活性,且与其他抗菌药物无交叉耐药性[4]。磷霉素具有以下特点:分子量小,穿透性好,体内分布广,几乎不与血浆蛋白结合,血药浓度高,不需肝代谢,不降解,大多数以原型经肾排出体外,酶稳定性好,用药安全性高[5]。近年来,细菌耐药性不断加剧,磷霉素对多重耐药菌仍有较好的抗菌活性,且与多种抗菌药联合应用时呈现协同作用,因而备受重视[6]。本次试验评价磷霉素钠联合临床常用抗菌药物对医院感染中常见病原菌金黄色葡萄球菌、肺炎克雷伯菌和铜绿假单胞菌的体外抗菌活性。
1 材料与方法 1.1 试验药品注射用磷霉素钠:批号4160419,规格3.96 g/每瓶,东北制药集团沈阳第一制药有限公司产品;盐酸左氧氟沙星:批号KYLH-M20091202B,效价86.8%,浙江普洛康裕制药有限公司产品;盐酸米诺环素:批号027M4012V,效价82.9%,SIGAM-ALDRICH公司产品;头孢呋辛:批号130493-201105,效价92.1%;头孢曲松:批号130480-201504,效价83.9%;苯唑西林:批号0482-9901,效价90.4%;克林霉素:批号0422-9502,效价85.5%;庆大霉素:批号130326-201015,效价63.0%;万古霉素:批号130360-201302,效价106.6%;头孢他啶:批号130484-201205,效价85.7%,以上药品购自中国食品药品检定研究院(或中国药品生物制品检定所);亚胺培南:批号MO38098,效价43.2%,杭州默沙东制药有限公司产品。
1.2 试验菌株标准菌株:金黄色葡萄球菌ATCC 29213,大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853。临床分离菌331株,包括113株金黄色葡萄球菌,108株肺炎克雷伯菌和110株铜绿假单胞菌。每株细菌于试验前经过平板转种分纯,以新鲜菌体用于试验。每次实验均用标准菌株作为药敏敏感试验质控菌,用不含抗菌药物的平皿作为试验菌株生长对照。
1.3 培养基与孵育条件将16 mL 44℃左右的MH琼脂培养基倒入已含1 mL不同浓度药物的90 mm培养皿,轻摇混匀。待凝固后,将细菌接种于培养皿上,35 ℃孵育16~20 h,读取结果。
1.4 联合最低抑菌浓度测定药物联合采用棋盘法,最低抑菌浓度(minimal inhibitory concentration, MIC)测定采用标准琼脂二倍稀释法[7]。联合抑菌浓度(fractional inhibitory concentration,FIC)根据公式FIC=(A药联合后MIC值/A药单药MIC值)+ (B药联合后MIC值/B药单药MIC值)计算,所得最低FIC值即FIC指数(FIC index,FICI)。分别以两种标准判定两药联合后的关系:标准Ⅰ[8]:FICI≤0.5为协同,>0.5~1为相加,>1~2为无关,>2为拮抗。标准Ⅱ[9]:FICI≤0.5为协同,>0.5~4为无关,>4为拮抗。
2 结果 2.1 磷霉素钠及对照药单药药敏结果除万古霉素,磷霉素钠及其他对照药对耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)的抗菌作用均较甲氧西林敏感金黄色葡萄球菌(methicillin-susceptible Staphylococcus aureus, MSSA)有所下降。对于碳青霉烯类抗生素敏感且不产超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)肺炎克雷伯菌,磷霉素和对照药均显示出很好的体外抗菌活性。对于碳青霉烯类抗生素不敏感和ESBLs阳性菌株,头孢呋辛和头孢曲松均高度耐药,但磷霉素仍表现出一定抗菌活性,MIC50≤32 mg/L。对于铜绿假单胞菌,磷霉素对亚胺培南敏感或不敏感菌株的抗菌作用基本一致,但对照药均受亚胺培南敏感性下降影响,对亚胺培南不敏感菌的抗菌活性低于敏感菌株。见表 1。
| 表 1 磷霉素钠及对照药对不同菌种的MIC结果(mg/L) Table 1 MICs of fosfomycin sodium and control antimicrobials against different strains (mg/L) |
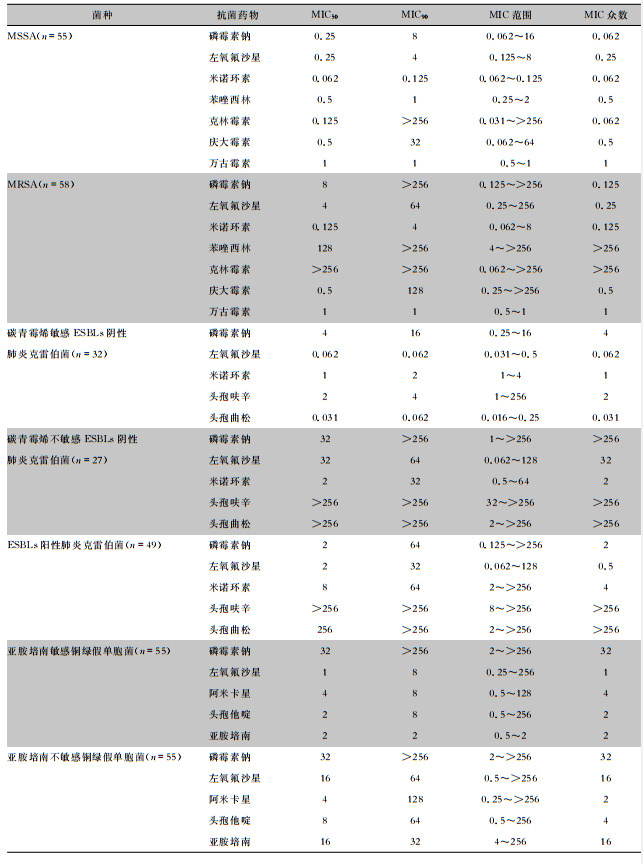
|
对于MRSA,磷霉素钠与多个常用抗菌药物表现出较好的协同作用,协同率>43%。此外,磷霉素钠与苯唑西林、庆大霉素联合,对MSSA也有较好协同作用,协同率>49%,但磷霉素钠与庆大霉素联合对MRSA的协同率仅5.2%,低于MSSA菌株。见表 2。磷霉素钠与头孢呋辛、头孢曲松联合,对碳青霉烯敏感ESBLs阴性肺炎克雷伯菌的协同率高于对碳青霉烯不敏感的菌株。对于亚胺培南敏感铜绿假单胞菌,磷霉素与左氧氟沙星和头孢他啶的协同率>60%,与阿米卡星协同率为36.4%;对于亚胺培南不敏感铜绿假单胞菌,磷霉素钠与各药物的协同作用弱于敏感菌株;但与亚胺培南联合无论铜绿假单胞菌对亚胺培南是否敏感,其协同率均为41.8%。按照标准Ⅰ,磷霉素钠与万古霉素联合,对MSSA和MRSA均是相加或无关。对于ESBLs阳性肺炎克雷伯菌和亚胺培南不敏感铜绿假单胞菌也以相加和无关为主。按照标准Ⅱ,除协同外,均为无关。见表 3。
| 表 2 磷霉素钠体外联合其他药物对金黄色葡萄球菌的药敏结果[株数(%)] Table 2 In vitro susceptibility of S. aureus to fosfomycin sodium combined with other antimicrobial agents (No. of isolates[%]) |
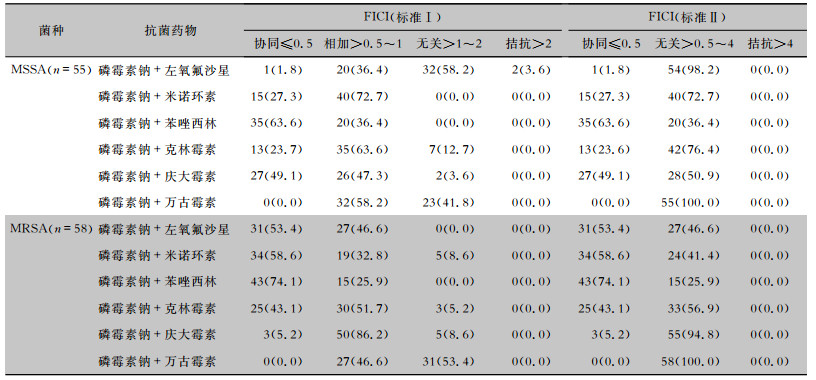
|
| 表 3 磷霉素钠体外联合其他药物对肺炎克雷伯菌和铜绿假单胞菌的药敏结果[株数(%)] Table 3 In vitro susceptibility of K. pneumoniae and P. aeruginosa to fosfomycin sodium combined with other antimicrobial agents (No. of isolates[%]) |
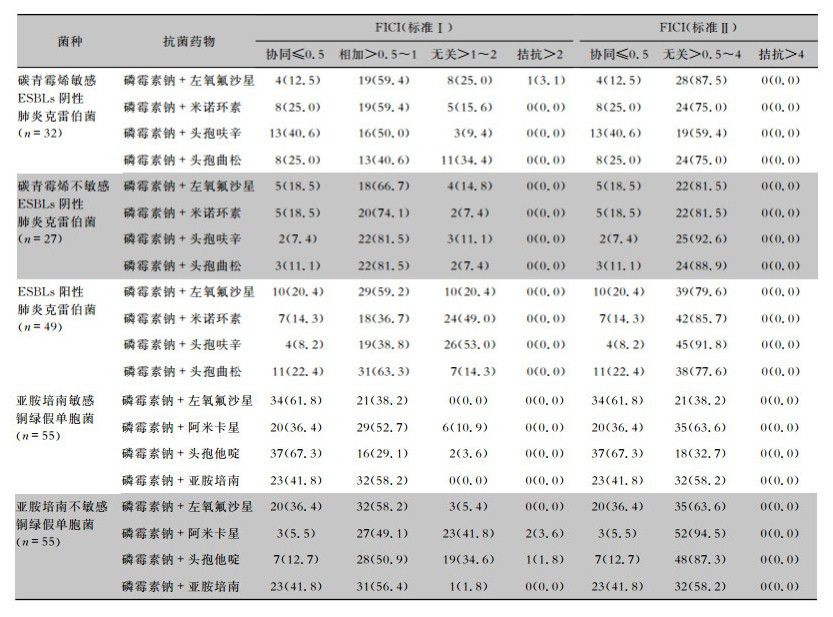
|
与磷霉素有关的联合药敏报道很多[6.10],由于磷霉素独特的作用机制及较好的抗菌活性,使得其从理论上具有更大的与其他抗菌药物产生协同作用的可能。对于MRSA,磷霉素与头孢孟多、头孢唑林等多数头孢类药物,碳青霉烯类,米诺环素和利奈唑胺具有协同作用,协同率在50%以上;与青霉素类的协同率为10%~30%;而与庆大霉素、甲氧苄氨嘧啶的协同率小于10%;与夫西地酸、利福平、万古霉素在不同研究中结果不一致[6.10]。本研究中,磷霉素与苯唑西林对MRSA表现出较好的协同作用,协同率74.1%,优于之前报道的18.7%[11]。
对于肠杆菌科细菌,近年来联合药敏研究多集中于产ESBLs及碳青霉烯类耐药的肺炎克雷伯菌。多数研究显示磷霉素与碳青霉烯类、氨曲南有协同作用;其次与氨基糖苷类、替加环素也有部分协同,但协同率多在50%以下;与多粘菌素协同率多在20%以下且有个别拮抗报道[10, 12]。本研究结果显示,对于产酶耐药的肺炎克雷伯菌,磷霉素钠与喹诺酮类,四环素类,第二、三代头孢菌素协同率基本低于20%,提示针对此类耐药菌,磷霉素与上述几种抗菌药物的联合应用协同效果有限。对于碳青霉烯类耐药或多重耐药铜绿假单胞菌,磷霉素与第三、四代头孢菌素,氨曲南,碳青霉烯类,氨基糖苷类,喹诺酮类和多粘菌素等多种药物均有联合药敏研究报道[10],结果不尽相同。虽然磷霉素与上述药物均有协同作用,但协同率通常低于50%。本研究中,对于亚胺培南不敏感铜绿假单胞菌,磷霉素与左氧氟沙星和亚胺培南有36.4%~41.8%的协同率。
对于联合药敏结果的判定,以往常用标准Ⅰ,即协同、相加、无关和拮抗4段法。但考虑到MIC测定为二倍稀释法,同一株细菌的MIC值不同次测定时可能出现±1个稀释度的变化,因而,近年来国外较推崇标准Ⅱ,即协同、无关和拮抗3段法[9]。本研究中将两种判定结果均展示以供比较。已有的联合药敏报道显示,研究者通常关注的是协同率与拮抗率,而两种判定中协同标准是一致的,因此不同标准对最终定性影响不大。
磷霉素与其他抗菌药物联合应用的临床研究[13-15]显示,对于碳青霉烯类耐药肺炎克雷伯菌感染患者的治疗也展现出较好的临床效果。
总之,磷霉素钠对临床常见耐药菌,如MRSA、产ESBLs肺炎克雷伯菌等仍有较好的抗菌作用,且与多种其他类抗菌药物可产生协同作用,提示针对耐药菌所致感染,在有限的治疗手段中,含磷霉素的联合用药不失为一种选择。如何采用简便的方法测定联合药敏,满足临床需求,也日益受到重视[16]。未来如能更深入地开展协同机制研究,并引入临床数据,考察体外与临床相关性,将对临床联合用药的选择更有指导意义。
| [1] |
Christensen BG, Leanza WJ, Beattie TR, et al. Phosphonomycin:structure and synthesis[J]. Science, 1969, 166(3901): 123-125. DOI:10.1126/science.166.3901.123 |
| [2] |
Hendlin D, Stapley EO, Jackson M, et al. Phosphonomycin, a new antibiotic produced by strains of streptomyces[J]. Science, 1969, 166(3901): 122-123. DOI:10.1126/science.166.3901.122 |
| [3] |
Woodyer RD, Shao Z, Thomas PM, et al. Heterologous production of fosfomycin and identification of the minimal biosynthetic gene cluster[J]. Chem Biol, 2006, 13(11): 1171-1182. DOI:10.1016/j.chembiol.2006.09.007 |
| [4] |
Michalopoulos AS, Livaditis IG, Gougoutas V. The revival of fosfomycin[J]. Int J Infect Dis, 2011, 15(11). |
| [5] |
权菊香, 赖蓓. 磷霉素临床应用的研究现状[J]. 中国临床药理学杂志, 2015, 31(20). |
| [6] |
Kastoris AC, Rafailidis PI, Vouloumanou EK, et al. Synergy of fosfomycin with other antibiotics for Gram-positive and Gram-negative bacteria[J]. Eur J Clin Pharmacol, 2010, 66(2): 359-386. |
| [7] |
CLSI. Performance standards for antimicrobial susceptibility testing, 27th edition. CLSI supplement M100[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2017.
|
| [8] |
Eliopoulos GM, Moellering RC. Antibiotic combinations[M]//Lorian V. Antibiotics in laboratory medicine, 3rd ed. Baltimore: Williams and Wilkins, 1991: 432-492.
|
| [9] |
Odd FC. Synergy, antagonism, and what chequerboard puts between them[J]. J Antimicrob Chermother, 2003, 52(1): 1. DOI:10.1093/jac/dkg301 |
| [10] |
Falagas ME, Vouloumanou EK, Samonis G, et al. Fosfomycin[J]. Clin Microbiol Rev, 2016, 29(2): 321-347. DOI:10.1128/CMR.00068-15 |
| [11] |
Ferrara A, Dos Santos C, Cimbro M, et al. Effect of different combinations of sparfloxacin, oxacillin, and fosfomycin against methicillin-resistant Staphylococci[J]. Eur J Clin Microbiol Infect Dis, 1997, 16(7): 535-537. DOI:10.1007/BF01708239 |
| [12] |
Evren E, Azap OK, Çolakoǧlu Ş, et al. In vitro activity of fosfomycin in combination with imipenem, meropenem, colistin and tigecycline against OXA 48-positive Klebsiella pneumoniae strains[J]. Diagn Microbiol Infect Dis, 2013, 76(3): 335-338. DOI:10.1016/j.diagmicrobio.2013.04.004 |
| [13] |
Liao Y, Hu GH, Xu YF, et al. Retrospective analysis of fosfomycin combinational therapy for sepsis caused by carbape-nem-resistant Klebsiella pneumoniae[J]. Exp Ther Med, 2017, 13(3): 1003-1010. DOI:10.3892/etm.2017.4046 |
| [14] |
Grabein B, Graninger W, Rodríguez Baño J, et al. Intravenous fosfomycin-back to the future.Systematic review and meta-analysis of the clinical literature[J]. Clin Microbiol Infect, 2017, 23(6): 363-372. DOI:10.1016/j.cmi.2016.12.005 |
| [15] |
Bowers DR, Huang V. Emerging issues and treatment strategies in carbapenem-resistant Enterobacteriaceae(CRE)[J]. Curr Infect Dis Rep, 2016, 18(12): 48. DOI:10.1007/s11908-016-0548-3 |
| [16] |
Brennan-Krohn T, Truelson KA, Smith KP, et al. Screening for synergistic activity of antimicrobial combinations against carbapenem-resistant Enterobacteriaceae using inkjet printer-based technology[J]. J Antimicrob Chemother, 2017, 72(10): 2775-2781. DOI:10.1093/jac/dkx241 |



