2. 广西玉林市妇幼保健院药剂科, 广西 玉林 537000
 唑的耐药率分别为21.79%、7.66%和13.37%,其中对左氧氟沙星的耐药率呈现年度升高的趋势(P < 0.05)。嗜麦芽窄食单胞菌对左氧氟沙星的耐药率与β-内酰胺酶抑制剂复合剂、碳青霉烯类、氟喹诺酮类、恶唑烷酮类的使用强度呈正相关(均P < 0.05);对复方磺胺甲
唑的耐药率分别为21.79%、7.66%和13.37%,其中对左氧氟沙星的耐药率呈现年度升高的趋势(P < 0.05)。嗜麦芽窄食单胞菌对左氧氟沙星的耐药率与β-内酰胺酶抑制剂复合剂、碳青霉烯类、氟喹诺酮类、恶唑烷酮类的使用强度呈正相关(均P < 0.05);对复方磺胺甲 唑的耐药率与大环内酯类的使用强度呈正相关(P < 0.05)。结论 嗜麦芽窄食单胞菌对左氧氟沙星和复方磺胺甲
唑的耐药率与大环内酯类的使用强度呈正相关(P < 0.05)。结论 嗜麦芽窄食单胞菌对左氧氟沙星和复方磺胺甲 唑的耐药率变化与某些常用类别的抗菌药物使用强度呈现正相关,降低抗菌药物使用强度有利于控制和降低嗜麦芽窄食单胞菌的耐药性。
唑的耐药率变化与某些常用类别的抗菌药物使用强度呈现正相关,降低抗菌药物使用强度有利于控制和降低嗜麦芽窄食单胞菌的耐药性。2. Department of Pharmacy, The Maternal and Child Health-care Hospital of Yulin City, Yulin 537000, China
嗜麦芽窄食单胞菌是非发酵革兰阴性杆菌,属于机会致病菌。长期使用广谱抗菌药物、免疫缺陷、接受侵入性操作或入住重症监护病房等是嗜麦芽窄食单胞菌感染的高危因素,可导致呼吸系统和血流系统的严重感染,具有很高的发病率和病死率[1]。近年来,嗜麦芽窄食单胞菌的临床检出率明显升高。2017年CHINET中国细菌耐药性监测数据[2]显示,国内主要地区34所医院(29所综合性医院、5所儿童医院)的嗜麦芽窄食单胞菌占检出细菌的2.87%,占非发酵革兰阴性杆菌的11.9%,已成为重要的医院感染病原体。因其本身含有β-内酰胺酶和产生氨基糖苷类修饰酶,对多种β-内酰胺类和氨基糖苷类等抗菌药物天然耐药,临床上可选择的治疗药物非常少,给临床感染防控和抗感染治疗带来了很大的困难[3]。研究[4]显示,使用3种以上广谱抗菌药物是嗜麦芽窄食单胞菌感染的独立危险因素之一,左氧氟沙星容易诱发其多种耐药表型的表达以及产生突变株,最终导致抗感染治疗失败。细菌耐药机制复杂,其中有些机制与抗菌药物使用密切相关。目前,国内有关抗菌药物使用强度对嗜麦芽窄食单胞菌耐药率影响的研究文献报道非常罕见,本文通过研究抗菌药物使用强度对嗜麦芽窄食单胞菌耐药率变化的影响,探讨导致其耐药的抗菌药物危险因素,以期为临床合理使用抗菌药物和减少耐药菌株的产生提供参考依据。
1 材料与方法 1.1 菌株来源分离自2012—2017年广西玉林市第一人民医院临床科室送检的各种培养标本,主要包括痰、血、尿、伤口分泌物、腹腔积液、脓液、支气管和肺泡灌洗液等标本,剔除同一患者相同部位检出的重复菌株,同一患者相同部位的重复菌株仅取第一次分离株。
1.2 菌株鉴定与药敏试验按《全国临床检验操作规程》(第三版)培养分离菌株,采用法国生物梅里埃公司的VITEK Compact自动细菌鉴定仪和法国生物梅里埃公司的VITEK GPI和GNI鉴定卡对嗜麦芽窄食单胞菌菌株进行鉴定。药敏试验采用K-B纸片扩散法测定,结果判断标准参考当年美国临床实验室标准化协会(CLSI)制定的标准进行评定。质控菌株包括金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853和肺炎克雷伯菌ATCC 700603,均由国家卫生计生委临床检验中心提供。
1.3 抗菌药物使用强度通过医院计算机信息系统提取2012—2017年医院住院病区常用抗菌药物的年消耗量,根据世界卫生组织推荐的限定日剂量(DDD值),计算常用抗菌药物的累计用药频度(DDDs),抗菌药物使用强度=累计DDDs×100/(同期出院患者例数×同期患者平均住院日数)。
1.4 统计学处理应用WHONET 5.5软件分析细菌耐药监测数据,应用SPSS 17.0软件对数据进行统计学分析。细菌检出率和耐药率随时间的变化趋势采用线性趋势χ2检验,数据资料符合双变量正态分布,抗菌药物使用强度与细菌耐药率的相关性采用Pearson相关分析。检验水准α=0.05,P≤0.05表示差异具有统计学意义。
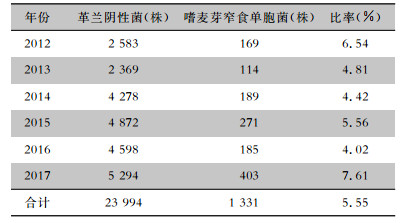
2 结果 2.1 嗜麦芽窄食单胞菌的检出情况2012—2017年从临床送检的各类培养标本中共检出革兰阴性菌23 994株,其中嗜麦芽窄食单胞菌1 331株,占革兰阴性菌的5.55%,检出率呈现升高的趋势(χ2=7.278,P=0.007)。见表 1。
| 表 1 嗜麦芽窄食单胞菌在革兰阴性菌中的检出情况 Table 1 Detection rate of SM in gram-negative bacteria |
|
1 331株嗜麦芽窄食单胞菌,标本来源多样,其中主要来源于痰(719株,54.02%),其次为支气管灌洗液(210株,15.78%)、伤口拭子(82株,6.16%)、气管插管分泌物(35株,2.63%)和支气管分泌物(33株,2.48%)。检出的科室主要为重症监护病房(286株,21.49%),其次为呼吸内科(240株,18.03%)、神经内科(146株,10.97%)、神经外科(98株,7.36%)和新生儿科(69株,5.18%)。
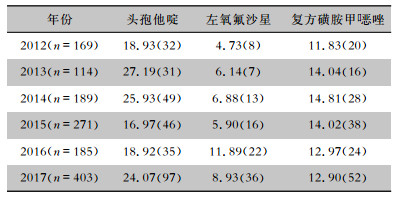
2.3 耐药率变化趋势2012—2017年嗜麦芽窄食单胞菌对左氧氟沙星耐药率呈现升高的趋势,经趋势χ2检验显示,差异有统计学意义(χ2=5.113,P=0.024),平均耐药率为7.66%;而对头孢他啶和复方磺胺甲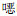 唑的平均耐药率分别为21.79%、13.37%,耐药率随时间变化差异无统计学意义(均P>0.05)。见表 2。
唑的平均耐药率分别为21.79%、13.37%,耐药率随时间变化差异无统计学意义(均P>0.05)。见表 2。
| 表 2 2012—2017年嗜麦芽窄食单胞菌耐药率变化趋势[%(株)] Table 2 Changing trend of antimicrobial resistance of SM from 2012 to 2017(%[No. of isolates]) |
|
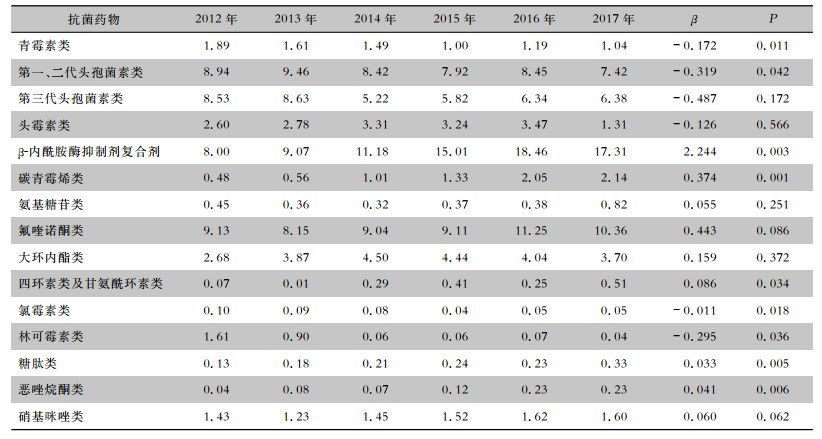
医院常用的15种抗菌药物类别中,β-内酰胺酶抑制剂复合剂、碳青霉烯类、四环素类及甘氨酰环素类、糖肽类和恶唑烷酮类的使用强度总体呈上升趋势(均P<0.05);而青霉素类、第一、二代头孢菌素类、氯霉素类和林可霉素类的使用强度总体呈下降趋势(均P<0.05)。见表 3。
| 表 3 2012—2017年常用抗菌药物使用强度(DDDs/100人天) Table 3 Antimicrobial use density from 2012 to 2017(DDDs/100 person-day) |
|
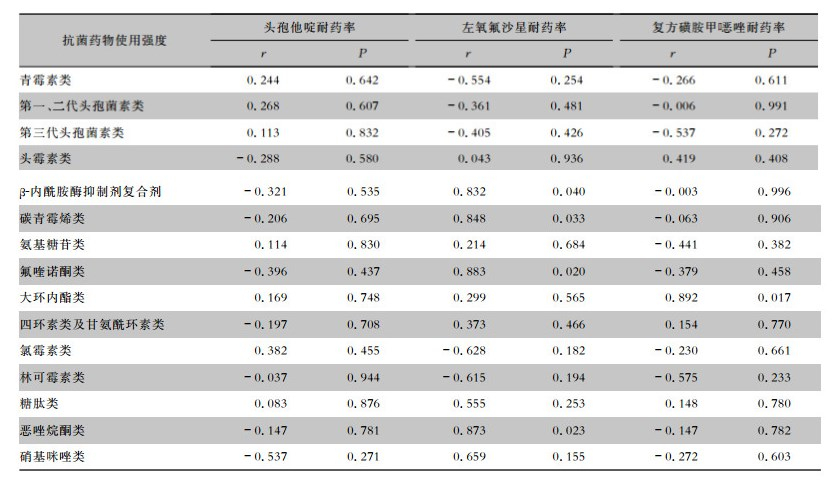
Pearson相关分析结果显示,嗜麦芽窄食单胞菌对左氧氟沙星的耐药率与β-内酰胺酶抑制剂复合剂、碳青霉烯类、氟喹诺酮类、恶唑烷酮类的使用强度呈正相关(均P<0.05);对复方磺胺甲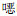 唑的耐药率与大环内酯类的使用强度呈正相关(P<0.05)。见表 4。
唑的耐药率与大环内酯类的使用强度呈正相关(P<0.05)。见表 4。
| 表 4 抗菌药物使用强度与嗜麦芽窄食单胞菌耐药率的Pearson相关分析 Table 4 Pearson correlation analysis between AUD and antimicrobial resistance rates of SM |
|
2012—2017年该院嗜麦芽窄食单胞菌的年度分离率呈现升高的趋势,菌株主要来自痰、支气管灌洗液等呼吸道标本,提示呼吸道是其主要感染或定植的部位,而且主要分布于重症监护病房、呼吸内科和神经内科等科室,与相关文献[5-6]研究结果相同。这些科室患者大多病情危重,需要接受气管插管和机械通气等侵入性操作,往往接受广谱抗菌药物尤其是碳青霉烯类抗生素治疗,是嗜麦芽窄食单胞菌感染的高危人群,极易发生嗜麦芽窄食单胞菌的感染或定植。有研究[7]显示,伴有多种基础疾病、长期住院、免疫力降低、气管插管和大量使用广谱抗菌药物是嗜麦芽窄食单胞菌感染的独立危险因素。
本研究药敏试验结果显示,嗜麦芽窄食单胞菌对头孢他啶、左氧氟沙星和复方磺胺甲 唑的总体耐药率低于30%、10%和15%,一直保持较低的耐药率,与文献[8-10]报道的结果相同,其中对头孢他啶和左氧氟沙星耐药率低于2017年CHINET中国细菌耐药监测网[2]报道的结果。复方磺胺甲
唑的总体耐药率低于30%、10%和15%,一直保持较低的耐药率,与文献[8-10]报道的结果相同,其中对头孢他啶和左氧氟沙星耐药率低于2017年CHINET中国细菌耐药监测网[2]报道的结果。复方磺胺甲 唑对嗜麦芽窄食单胞菌具有较好的体外抗菌活性,国内外文献[2, 11]报道嗜麦芽窄食单胞菌对其耐药率均<10%。目前研究[11-12]显示,复方磺胺甲
唑对嗜麦芽窄食单胞菌具有较好的体外抗菌活性,国内外文献[2, 11]报道嗜麦芽窄食单胞菌对其耐药率均<10%。目前研究[11-12]显示,复方磺胺甲 唑仍是治疗嗜麦芽窄食单胞菌感染的首选药物。虽然嗜麦芽窄食单胞菌对复方磺胺甲
唑仍是治疗嗜麦芽窄食单胞菌感染的首选药物。虽然嗜麦芽窄食单胞菌对复方磺胺甲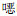 唑的年度耐药率无明显变化趋势,但本研究中2012—2017年的平均耐药率为13.37%,高于2017年CHINET中国细菌耐药监测网[2]报道的5.5%。有研究[13-14]显示,近年来嗜麦芽窄食单胞菌耐药菌株检出株数逐年增多,其对复方磺胺甲
唑的年度耐药率无明显变化趋势,但本研究中2012—2017年的平均耐药率为13.37%,高于2017年CHINET中国细菌耐药监测网[2]报道的5.5%。有研究[13-14]显示,近年来嗜麦芽窄食单胞菌耐药菌株检出株数逐年增多,其对复方磺胺甲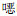 唑的耐药机制主要与获得二氢叶酸合成酶(编码基因sul)有关,同时和二氢叶酸还原酶(编码基因dfrA)可协同发挥作用,增加了复方磺胺甲
唑的耐药机制主要与获得二氢叶酸合成酶(编码基因sul)有关,同时和二氢叶酸还原酶(编码基因dfrA)可协同发挥作用,增加了复方磺胺甲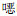 唑的耐药性,并诱导嗜麦芽窄食单胞菌对其他抗菌药物的多重耐药。复方磺胺甲
唑的耐药性,并诱导嗜麦芽窄食单胞菌对其他抗菌药物的多重耐药。复方磺胺甲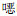 唑与头孢他啶、米诺环素等联合使用对多重耐药菌株具有部分协同抗菌活性[15]。因此,临床治疗广泛耐药嗜麦芽窄食单胞菌感染时,推荐采用以复方磺胺甲
唑与头孢他啶、米诺环素等联合使用对多重耐药菌株具有部分协同抗菌活性[15]。因此,临床治疗广泛耐药嗜麦芽窄食单胞菌感染时,推荐采用以复方磺胺甲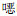 唑为基础联合替卡西林/克拉维酸钾、头孢哌酮/舒巴坦、氟喹诺酮类、米诺环素、头孢他啶或多粘菌素的方案,或采用以氟喹诺酮类为基础联合头孢他啶、替卡西林/克拉维酸钾或头孢哌酮/舒巴坦的方案,或采用以多粘菌素为基础联合替卡西林/克拉维酸钾的方案[16],以延缓或避免其耐药性的产生。复方磺胺甲
唑为基础联合替卡西林/克拉维酸钾、头孢哌酮/舒巴坦、氟喹诺酮类、米诺环素、头孢他啶或多粘菌素的方案,或采用以氟喹诺酮类为基础联合头孢他啶、替卡西林/克拉维酸钾或头孢哌酮/舒巴坦的方案,或采用以多粘菌素为基础联合替卡西林/克拉维酸钾的方案[16],以延缓或避免其耐药性的产生。复方磺胺甲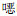 唑容易引起过敏反应和骨髓抑制,对于使用复方磺胺甲
唑容易引起过敏反应和骨髓抑制,对于使用复方磺胺甲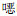 唑有禁忌的患者,可以考虑选择米诺环素作为理想的替代药物。
唑有禁忌的患者,可以考虑选择米诺环素作为理想的替代药物。
本研究结果显示,嗜麦芽窄食单胞菌对左氧氟沙星的耐药率呈现年度升高的趋势(P<0.05),值得关注。其对左氧氟沙星的耐药率与β-内酰胺酶抑制剂复合剂、碳青霉烯类、氟喹诺酮类、恶唑烷酮类的使用强度呈高度正相关(均P<0.05),表明高强度使用这4种类别的抗菌药物是嗜麦芽窄食单胞菌对左氧氟沙星耐药率升高的重要原因之一。有研究[17]显示,增加氟喹诺酮类和碳青霉烯类的使用可增加嗜麦芽窄食单胞菌对氟喹诺酮类和复方磺胺甲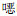 唑的耐药性,同时高强度使用碳青霉烯类抗生素可促进嗜麦芽窄食单胞菌的生长和加重感染[18]。本研究结果侧面提示了即使嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药,高强度使用碳青霉烯类也可导致嗜麦芽窄食单胞菌对左氧氟沙星耐药率的升高。至于恶唑烷酮类可导致嗜麦芽窄食单胞菌对左氧氟沙星耐药率升高的机制和原因不明,推测可能与采用碳青霉素类治疗严重感染性疾病时往往需要经验性覆盖阳性菌而同时使用了恶唑烷酮类导致其使用强度增大有关,两者之间高度正相关的真实性可能不大。
唑的耐药性,同时高强度使用碳青霉烯类抗生素可促进嗜麦芽窄食单胞菌的生长和加重感染[18]。本研究结果侧面提示了即使嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药,高强度使用碳青霉烯类也可导致嗜麦芽窄食单胞菌对左氧氟沙星耐药率的升高。至于恶唑烷酮类可导致嗜麦芽窄食单胞菌对左氧氟沙星耐药率升高的机制和原因不明,推测可能与采用碳青霉素类治疗严重感染性疾病时往往需要经验性覆盖阳性菌而同时使用了恶唑烷酮类导致其使用强度增大有关,两者之间高度正相关的真实性可能不大。
此外,研究尚发现嗜麦芽窄食单胞菌对复方磺胺甲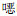 唑的耐药率与大环内酯类的使用强度呈高度正相关(P<0.05)。具体原因和机制不明,推测可能与大环内酯类可诱导嗜麦芽窄食单胞菌的二氢叶酸合成酶编码基因sul的突变或过表达从而增加对复方磺胺甲
唑的耐药率与大环内酯类的使用强度呈高度正相关(P<0.05)。具体原因和机制不明,推测可能与大环内酯类可诱导嗜麦芽窄食单胞菌的二氢叶酸合成酶编码基因sul的突变或过表达从而增加对复方磺胺甲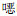
此次研究也发现部分抗菌药物的使用未对嗜麦芽窄食单胞菌耐药率变化产生明显的影响。国外研究[19]显示,抗菌药物使用强度与细菌耐药率相关性的研究结果差异较大。细菌耐药原因复杂,受多种因素影响,抗菌药物的选择性压力可能只是其中的原因之一,还可能与细菌耐药机制、感染时间段、消毒剂使用、收治患者人群的临床特征等诸多因素有关,这些问题有待今后进一步研究解决。此次研究仅纳入抗菌药物使用强度单个因素,但其研究结果对规范抗菌药物的使用和防控嗜麦芽窄食单胞菌耐药率的升高仍具有重要的参考价值。
| [1] |
赵进, 刘运喜, 倪文涛, 等. 嗜麦芽寡养单胞菌感染管理与临床治疗研究进展[J]. 中华医院感染学杂志, 2017, 27(10): 2397-2400. |
| [2] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [3] |
段忠亮, 秦娟秀, 李敏, 等. 上海某医院临床分离嗜麦芽窄食单胞菌分子流行病学分析[J]. 中国感染与化疗杂志, 2017, 17(3): 283-288. |
| [4] |
刘阳, 汤雪萍, 尚学义, 等. 嗜麦芽窄食单胞菌感染危险因素和耐药性分析[J]. 中国消毒学杂志, 2018, 35(4): 258-261. |
| [5] |
谢朝云, 熊芸, 孙静, 等. ICU感染嗜麦芽窄食假单胞菌分布与耐药性分析[J]. 中国微生态学杂志, 2016, 28(9): 1059-1065. |
| [6] |
王亚华, 祝永明, 吴晓燕, 等. 1212株嗜麦芽窄食单胞菌的临床分布及耐药性分析[J]. 中国医药导报, 2017, 14(13): 124-127. |
| [7] |
Kang CI, Baek JY, Jeon K, et al. Bacteremic pneumonia caused by extensively drug-resistant Streptococcus pneumoniae[J]. J Clin Microbiol, 2012, 50(12): 4175-4177. DOI:10.1128/JCM.01642-12 |
| [8] |
张秀红, 宋惠珠, 耿先龙. 654株嗜麦芽窄食单胞菌的分布及耐药性分析[J]. 现代预防医学, 2016, 43(15): 2814-2816. |
| [9] |
熊丽蓉, 冯伟, 向荣凤, 等. 我院2005-2017年嗜麦芽窄食单胞菌的临床分布及耐药性分析[J]. 中国药房, 2018, 29(16): 2248-2251. DOI:10.6039/j.issn.1001-0408.2018.16.19 |
| [10] |
施新颜, 沈强. 嗜麦芽窄食单胞菌感染的临床分布和耐药性分析[J]. 中国卫生检验杂志, 2015, 25(15): 2626-2628. |
| [11] |
Abbott IJ, Slavin MA, Turnidge JD, et al. Stenotrophomonas maltophilia:emerging disease patterns and challenges for treatment[J]. Expert Rev Anti Infect Ther, 2011, 9(4): 471-488. DOI:10.1586/eri.11.24 |
| [12] |
Looney WJ, Narita M, Mühlemann K. Stenotrophomonas maltophilia:an emerging opportunist human pathogen[J]. Lancet Infect Dis, 2009, 9(5): 312-323. DOI:10.1016/S1473-3099(09)70083-0 |
| [13] |
Hu LF, Chang X, Ye Y, et al. Stenotrophomonas maltophilia resistance to trimethoprim/sulfamethoxazole mediated by acquisition of sul and dfrA genes in a plasmid-mediated class 1 integron[J]. Int J Antimicrob Agents, 2011, 37(3): 230-234. DOI:10.1016/j.ijantimicag.2010.10.025 |
| [14] |
赵苏瑛, 杨琳, 李鹏飞, 等. 嗜麦芽寡养单胞菌获得性耐药的机制研究及整合子分布调查[J]. 中华医院感染学杂志, 2017, 27(2): 263-266, 271. |
| [15] |
Milne KE, Gould IM. Combination antimicrobial susceptibility testing of multidrug-resistant Stenotrophomonas maltophilia from cystic fibrosis patients[J]. Antimicrob Agents Chemother, 2012, 56(8): 4071-4077. DOI:10.1128/AAC.00072-12 |
| [16] |
Guan X, He L, Hu B, et al. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli:a Chinese consensus statement[J]. Clin Microbiol Infect, 2016, 22(Suppl 1): S15-S25. |
| [17] |
Pien CJ, Kuo HY, Chang SW, et al. Risk factors for levofloxacin resistance in Stenotrophomonas maltophilia from respiratory tract in a regional hospital[J]. J Microbiol Immunol Infect, 2015, 48(3): 291-295. |
| [18] |
Safdar A, Rolston KV. Stenorophomonas maltophilia:changing spectrum of a serious bacterial pathogen in patients with cancer[J]. Clin Infect Dis, 2007, 45(12): 1602-1609. DOI:10.1086/522998 |
| [19] |
Ogutlu A, Guclu E, Karabay O, et al. Effects of Carbapenem consumption on the prevalence of Acinetobacter infection in intensive care unit patients[J]. Ann Clin Microbiol Antimicrob, 2014, 13: 7. DOI:10.1186/1476-0711-13-7 |



