马尔尼菲篮状菌病(Talaromyces marneffei infection)为我国南方及东南亚国家获得性免疫缺陷综合症(AIDS, 即艾滋病)患者中最常见的机会性感染之一。随着湖南地区艾滋病患者数量的逐渐上升, 马尔尼菲篮状菌的感染率也在上升。研究[1]表明, 马尔尼菲篮状菌病病死率为20.7%~29.4%。笔者在长期的临床实践中发现, 播散型马尔尼菲篮状菌病患者常存在血红蛋白(Hb)下降, 血小板减少, 血清腺苷脱氨酶(ADA)和乳酸脱氢酶(LDH)升高, 以及肝功能受损等情况。而笔者所在科室前期的临床研究显示, 合并马尔尼菲篮状菌病的艾滋病患者血清ADA水平明显增高, 以23.50 U/L为诊断界值, 有较高的灵敏度和特异度。ADA检测可作为艾滋病患者合并马尔尼菲篮状菌病的辅助诊断方法之一[2]。本研究旨在评价多个指标对艾滋病合并马尔尼菲篮状菌病预后的价值, 寻找可以评估其预后的生化检查标志物。
1 对象与方法 1.1 研究对象2016年1月-2017年12月长沙市第一医院收治的艾滋病合并马尔尼菲篮状菌病患者。
1.2 纳入及排除标准纳入标准:符合艾滋病诊疗指南[3]中的艾滋病诊断标准, 且血或者骨髓培养结果为马尔尼菲篮状菌的患者, 根据患者预后分为死亡组和存活组。排除标准:(1)未完成治疗(血培养复查正常)即出院的患者; (2)合并结核病、病毒性肝炎感染、心脏病、淋巴瘤等疾病的患者。
1.3 实验室检查所有患者入院后第二天空腹静脉采血行白细胞计数(WBC)、血小板计数(PLT)、Hb、ADA、肌酸激酶同工酶(CK-MB)、LDH、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、CD4+ T细胞计数等检测。入院后3 d内留取骨髓、血标本行真菌及细菌培养。WBC、PLT、Hb检测仪器及试剂为深圳迈瑞BC-6800全自动血细胞分析仪及专用试剂, ADA、CK-MB、LDH、AST、TBIL检测仪器及试剂为深圳迈瑞BS-400全自动生化分析仪及浙江宁波美康生物科技股份有限公司生化试剂, CD4+ T细胞计数(T细胞亚群)检测仪器及试剂为美国BD公司流式细胞分析仪及专用试剂, 骨髓或血培养检测仪器及试剂为法国生物梅里埃公司BACT/ALERT 3D 240全自动微生物检测系统及专用培养瓶。
1.4 抗真菌药物及治疗方案抗真菌药物:伊曲康唑胶囊(0.1 g/粒, 西安杨森制药有限公司)0.2 g/次, 2次/天; 两性霉素B(25 mg/支, 华北制药)注射液5 mg起, 每日加5~10 mg至0.7 mg/kg·d。抗真菌方案(住院2周内):先用伊曲康唑, 诊断马尔尼菲篮状菌病后改两性霉素B用至治疗量14 d, 之后再继续伊曲康唑巩固治疗。
1.5 统计学方法各实验室指标具体分层见表 1。应用SPSS 23.0软件包进行分析, 计数资料的比较采用卡方检验。有统计学意义的变量与艾滋病合并马尔尼菲篮状菌病的死亡关系应用多因素logistic回归(进入法)分析, 以找到有主要作用的影响指标, 以P ≤ 0.05为差异有统计学意义。
| 表 1 实验室检查结果赋值表 Table 1 Assignment value of laboratory examination results |
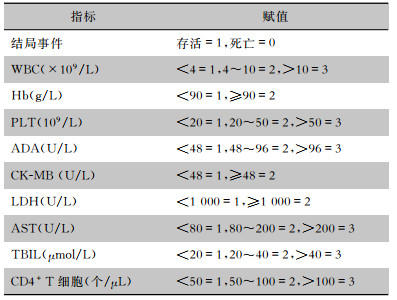
|
2016年1月-2017年12月长沙市第一医院共收治186例艾滋病合并马尔尼菲篮状菌病的患者, 其中22例患者未完成治疗即出院, 15例患者合并结核感染, 4例患者合并耶氏肺孢子菌肺炎, 3例患者合并慢性乙型肝炎, 1例合并扩张型心肌病, 1例合并弥漫大B细胞淋巴瘤, 最终符合纳入标准的患者140例。140例患者中, 男性115例(82.1%), 女性25例(17.9%); 年龄17~70岁, 中位数为38岁。死亡组32例, 均为住院期间死亡, 住院日数为1~13 d; 存活组108例, 住院日数为30~ 50 d, 均治疗好转出院。
2.2 死亡组与存活组患者实验室检查结果的比较对所有数据采取单因素统计分析卡方检验, WBC、PLT、ADA、CK-MB、LDH、AST、TBIL死亡组与存活组患者比较, 差异有统计学意义(均P<0.01), 而Hb、CD4+ T细胞数比较差异均无统计学意义(均P>0.05), 见表 2。
| 表 2 死亡组与存活组患者实验室检查结果的比较 Table 2 Comparison of laboratory examination results between patients in death group and survival group |
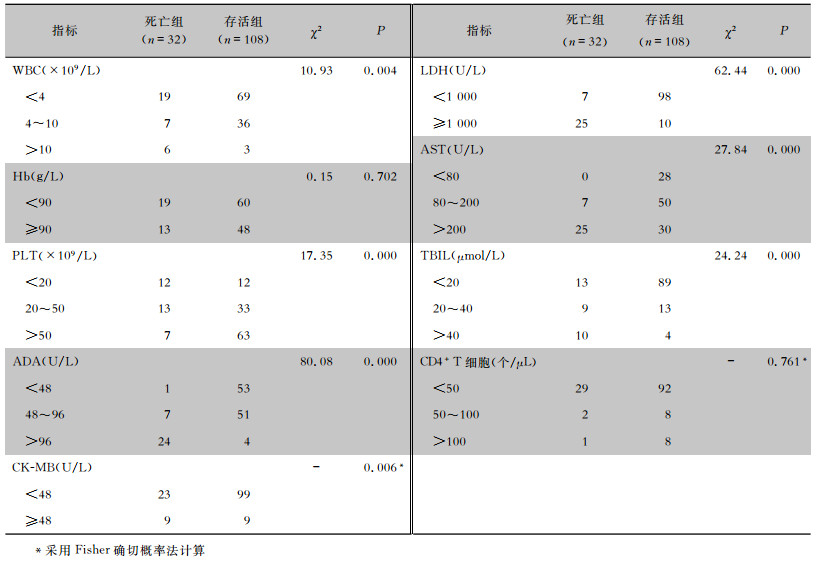
|
以艾滋病合并马尔尼菲篮状菌病患者结局事件为因变量, WBC、PLT、ADA、CK-MB、LDH、AST、TBIL为协变量, 进行多因素logistic回归分析, 筛选出ADA及LDH升高为艾滋病合并马尔尼菲篮状菌病死亡患者预后不良的评价指标。见表 3。
| 表 3 艾滋病合并马尔尼菲篮状菌病死亡患者评价指标多因素logistic回归分析 Table 3 Multivariate logistic regression analysis on marks for evaluating death patients with AIDS and T. marneffei infection |
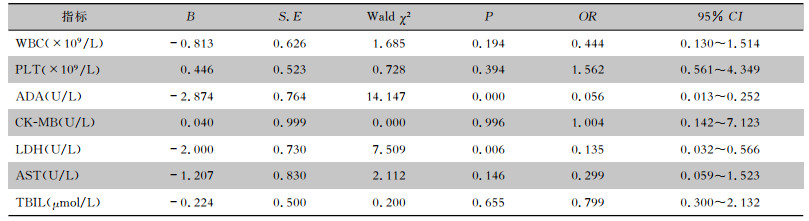
|
马尔尼菲篮状菌是一种细胞内病原体, 机体抵御其入侵主要依靠细胞免疫, 马尔尼菲篮状菌感染机体后被巨噬细胞识别、吞噬从而将其杀灭。艾滋病患者由于免疫力低下, 巨噬细胞不能及时吞噬和杀灭入侵的马尔尼菲篮状菌孢子, 使该菌在体内迅速繁殖, 最终导致巨噬细胞变性、坏死, 该菌在体内广泛播散[4-5]。
ADA在淋巴细胞内含量较高, 主要由T淋巴细胞产生, 是T淋巴细胞增殖分化过程中嘌呤代谢产生的一种与机体细胞免疫活性有重要关系的核酶[6]。ADA包含ADA1和ADA2两种同工酶, 当单核-巨噬细胞系统激活后, ADA2活性则明显增加。Zavialov等[7-8]通过一系列研究发现, ADA2由单核-巨噬细胞系统产生, 是单核细胞分化为巨噬细胞或树突细胞过程中由抗原提呈细胞(antigen- presenting cell, APC)分泌的, 并且是APC分泌的唯一的ADA产物。分泌水平由细胞激酶-生长因子调节, 可能通过细胞表面ADA受体(adenosine deaminase receptor, ADR)和蛋白聚糖类结合到细胞表面, 与细胞表面分子相互作用, 参与细胞内信号转导; 同时研究揭示了ADA2的生长因子样活性, 提出ADA2在T细胞依赖性单核细胞分化中起到特异性作用, 能促进CD4+ T细胞依赖性单核细胞分化为巨噬细胞并出现巨噬细胞增殖。在细胞免疫中, ADA在淋巴细胞的分化及单核细胞转化为巨噬细胞中活性会有很大程度的提高[9]。本研究中140例艾滋病合并马尔尼菲篮状菌病的患者, 血清ADA水平均升高, 尤其死亡组血清ADA水平异常升高(114.94±29.92 U/L), 高于存活组ADA水平(52.16±22.22 U/L), 差异有统计学意义(P<0.05)。多因素logistic回归结果分析显示ADA数值越高, 则患者死亡风险越大(OR为0.056, P= 0.000), 因此, ADA是评价艾滋病合并马尔尼菲篮状菌病预后的重要指标之一。ADA水平明显升高可能提示体内存在细胞免疫活性异常激活, 导致机体发生严重的炎症反应, 进一步发展使患者出现多脏器功能损伤, 血清ADA水平升高是艾滋病合并播散型马尔尼菲篮状菌病患者预后不良的评价指标。
LDH是一种糖酵解过程中的关键酶, 主要作用在糖酵解的最后一步, 催化丙酮酸生成乳酸。LDH广泛存在于肝、心、骨骼肌、肺、脾、脑、肾、红细胞等组织细胞的胞浆和线粒体中, 引起各器官组织损伤的许多疾病均可导致血清LDH水平及活性的升高, 因此, LDH在脓毒症、感染、急性心肌梗死、肝硬化、恶性肿瘤等许多疾病中都可以作为患者预后的预测指标[10-12]。可能机制为组织细胞低氧状态下, 细胞所需的主要能量是由糖酵解而非有氧磷酸化提供, 被称为瓦博格效应, 通常发生在肿瘤细胞[13], 瓦博格效应同样也发生在脓毒症阶段[14], 脓毒症或者感染患者免疫细胞尤其是巨噬细胞刺激葡萄糖代谢重编程(glucose metabolic reprogramming), 在低氧环境中为效应器功能提供充足的ATP[15-16], 巨噬细胞释放大量炎性介质所需要的ATP由糖酵解提供[17]。在脂多糖的激活下, 巨噬细胞的三羧酸循环被抑制, 而三羧酸循环的中间代谢产物柠檬酸及琥珀酸累积, 柠檬酸及琥珀酸可以增加低氧诱导因子1α的表达, 后者可以升高关键酶如M2丙酮酸激酶、己糖激酶、磷酸果糖激酶的表达及活性, 糖酵解的速率增加, 最终炎症介质白细胞介素(IL)-1β、IL- 6释放到循环中的数量增加[18-19]。除了提供免疫细胞释放炎症介质需要的能量, 糖酵解还导致大量乳酸的堆积, 因此增加脓毒症治疗的难度。乳酸水平>4 mmol/L与脓毒症的病死率相关[20]。Lu等[21]一项回顾性研究发现, LDH与炎症因子、乳酸堆积呈正相关。血清LDH高水平与脓毒症患者28天高病死率相关, 播散型马尔尼菲篮状菌病是真菌感染所导致的脓毒症之一, 马尔尼菲篮状菌常通过淋巴和血液循环播散、累及多个脏器。本研究中两组患者血清LDH均明显升高, 死亡组患者与存活组患者比较, 差异存在统计学意义(P<0.05), 表明播散型马尔尼菲篮状菌病患者血清LDH水平越高, 患者病情则越严重。logistic回归分析显示, 血清LDH数值越高, 患者死亡风险越大(OR为0.135, P=0.006), 所以血清LDH是艾滋病合并马尔尼菲篮状菌病预后的重要指标之一。血清LDH水平明显升高提示受累组织葡萄糖代谢重编程, 糖酵解速率增快, 炎症介质释放增加, 乳酸水平增加, 代表体内严重的炎症反应, 从而加速艾滋病合并马尔尼菲篮状菌病的进展, 导致患者病死率升高。
总之, 血清ADA和LDH水平是艾滋病合并马尔尼菲篮状菌病预后的重要指标, 二者升高提示预后不良。在临床工作中如果发现该类患者出现ADA及LDH明显升高, 应尽早采取干预措施, 积极采取抗真菌感染治疗及保护各脏器功能, 可改善部分重症患者预后, 降低病死率。
本文首次将ADA及LDH作为艾滋病合并马尔尼菲篮状菌病预后预测指标, 可以为临床治疗提供参考, 加强针对病原及预防感染所致器官功能障碍的治疗, 尽可能降低病死率。但本临床研究为回顾性分析, 且样本量偏小, 只针对部分实验室指标, 需要进一步扩大样本量, 并设置前瞻性研究, 对艾滋病合并马尔尼菲篮状菌病的发展机制进行更深入研究, 以及采取干预措施, 以降低该疾病的病死率。
| [1] |
Kawila R, Chaiwarith R, Supparatpinyo K. Clinical and labora-tory characteristics of penicilliosis marneffei among patients with and without HIV infection in Northern Thailand:a retrospective study[J]. BMC Infect Dis, 2013, 5(13): 464. |
| [2] |
周国强, 王敏, 肖钢. 血清腺苷脱氨酶对马尔尼菲青霉菌病的诊断价值[J]. 中国艾滋病性病, 2015, 21(8): 720-722. |
| [3] |
中华医学会感染病学分会艾滋病学组. 艾滋病诊疗指南[J]. 中华传染病杂志, 2006, 24(2): 133-134. DOI:10.3760/j.issn:1000-6680.2006.02.021 |
| [4] |
Vanittannkom N, Coopee CR Jr, Fisher MC, et al. Penicillium marneffei infection and recent advances in the epidemiology and molecular biology aspects[J]. Clin Microbiol Rev, 2006, 19(1): 95-110. DOI:10.1128/CMR.19.1.95-110.2006 |
| [5] |
Wong SS, Wong KH, Hui WT, et al. Differences in clinical and laboratory diagnostic characteristics of penicilliosis marneffei in human immundoficiebcy virus (HIV) and non-HIV-infec-ted patients[J]. Clin Microbiol, 2001, 39(12): 4535-4540. DOI:10.1128/JCM.39.12.4535-4540.2001 |
| [6] |
Heard DJ, Norby PL, Holloway J, et al. Human ERRgamma, a third member of the estrogen receptor-related receptor(ERR) subfamily of orphan nuclear receptors:Tissue-specific isoforms are expressed during development and in the adult[J]. Mol Endocrinol, 2000, 14(3): 382-392. |
| [7] |
Zavialov AV, Gracia E, Glaichenhaus N, et al. Human adeno-sine deaminase 2 induces differentiation of monocytes into macrophages and stimulates proliferation of T helper cells and macrophages[J]. J Leukoc Biol, 2010, 88(2): 279-290. DOI:10.1189/jlb.1109764 |
| [8] |
Zavialov AV, Engström A. Human ADA2 belongs to a new family of growth factors with adenosine deaminase activity[J]. Biochem J, 2005, 391(Pt 1): 51-57. |
| [9] |
曾静, 程多智. 腺苷脱氨酶在胸水性质鉴别的临床应用[J]. 临床肺科杂志, 2013, 18(12): 2302-2303. DOI:10.3969/j.issn.1009-6663.2013.12.087 |
| [10] |
Li H, Xiong W, Liu H, et al. Serum LDH level may predict outcome of chronic lymphocytic leukemia patients with a 17p deletion:a retrospective analysis of prognostic factors in China[J]. Chin J Cancer Res, 2017, 29(2): 156-165. DOI:10.21147/j.issn.1000-9604.2017.02.09 |
| [11] |
Marmorino F, Salvatore L, Barbara C, et al. Serum LDH predicts benefit from bevacizumab beyond progression in metasta-tic colorectal cancer[J]. Br J Cancer, 2017, 116(3): 318-323. DOI:10.1038/bjc.2016.413 |
| [12] |
Terragni R, Morselli-Labate AM, Vignoli M, et al. Is serum total LDH evaluation able to differentiate between alimentary lymphoma and inflammatory bowel disease in a real world cli-nical setting?[J]. PLoS One, 2016, 11(3): e0151641. DOI:10.1371/journal.pone.0151641 |
| [13] |
Warburg O, Wind F, Negelein E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8(6): 519-530. DOI:10.1085/jgp.8.6.519 |
| [14] |
Yang L, Xie M, Yang M, et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis[J]. Nat Commun, 2014, 5: 4436. DOI:10.1038/ncomms5436 |
| [15] |
Kelly B, O'Neill LA. Metabolic reprogramming in macrophages and dendritic cells in innate immunity[J]. Cell Res, 2015, 25(7): 771-784. DOI:10.1038/cr.2015.68 |
| [16] |
Corcoran SE, O'Neill LA. HIF1α and metabolic reprogramming in inflammation[J]. J Clin Invest, 2016, 126(10): 3699-3707. DOI:10.1172/JCI84431 |
| [17] |
Arts RJ, Gresnigt MS, Joosten LA, et al. Cellular metabolism of myeloid cells in sepsis[J]. J Leukoc Biol, 2017, 101(1): 151-164. DOI:10.1189/jlb.4MR0216-066R |
| [18] |
Tannahill GM, Curtis AM, Adamik J, et al. Succinate is an inflammatory signal that induces IL-1 through HIF-1[J]. Nature, 2013, 496(7444): 238-242. DOI:10.1038/nature11986 |
| [19] |
Rodríguez-Prados JC, Través PG, Cuenca J, et al. Substrate fate in activated macrophages:a comparison between innate, classic and alternative activation[J]. J Immunol, 2010, 185(1): 605-614. |
| [20] |
Mikkelsen ME, Miltiades AN, Gaieski DF, et al. Serum lactate is associated with mortality in severe sepsis independent of organ failure and shock[J]. Crit Care Med, 2009, 37(5): 1670-1677. DOI:10.1097/CCM.0b013e31819fcf68 |
| [21] |
Lu J, Wei ZH, Jiang H, et al. Lactate dehydrogenase is associated with 28-day mortality in patients with sepsis:a retrospective observational study[J]. J Surg Res, 2018, 228: 314-321. DOI:10.1016/j.jss.2018.03.035 |



