2. 上海市第六人民医院金山分院护理部, 上海 201500
2. Nursing Department, Jinshan Branch Hospital Affiliated to Shanghai No.6 People's Hospital, Shanghai 201500, China
我国将外来医疗器械定义为由器械供应商租借给医院、可重复使用的,且主要用于与植入物相关手术的器械。美国国际医疗中心服务物资管理协会(IAHCSMM)对外来医疗器械的定义为:医院依据租赁或试用新器械的协议所使用的关键或半关键器械[1]。外来医疗器械可来源于外院、医生个人所有、器械公司。随着外科技术的持续发展及手术复杂性的不断增加,手术器械和植入物也发生了飞速的变化[2]。医院器械库存不足,财务紧张,缺乏足够储存空间,手术设备特殊,需要同时开展多台手术,器械遗失等原因导致医疗机构常需采用租赁模式解决手术器械供不应求的问题。医疗机构一旦开始实施外来器械租赁方案便会面临众多挑战,包括由于送达时间太晚导致使用前无法规范地处理外来器械,外来医疗器械的使用说明书不完善,以及消毒供应中心(central sterile supply department,CSSD)工作人员和围手术期护士缺乏相应的培训,均可能导致手术取消、延迟或手术时间延长。
2009年医院消毒供应中心卫生行业标准颁布实施,规定CSSD负责外来医疗器械的清洗消毒灭菌工作。但2012—2013年,卫生部医院管理研究所对我国9省365所医院的CSSD三项标准实施情况进行了调查与追踪评价,调查结果显示CSSD对外来器械进行集中化处置和管理仍有待加强[3]。2016年国家卫生和计划生育委员会修订了医院消毒供应中心的卫生行业标准,修订后的行业标准根据原标准在执行过程中的经验、反馈意见以及国内外专业发展要求,进一步细化和完善了外来医疗器械和植入物的管理,如何按照规范要求,降低外来医疗器械在医院清洗、消毒、包装及灭菌管理过程中的风险,确保手术的安全性,已成为医疗机构及CSSD的研究重点,本文就CSSD外来医疗器械质量管理的国内外要求及差异进行回顾,综述如下。
1 外来医疗器械的制度建设要降低外来医疗器械相关的医院感染,医疗机构需要制定标准的、完善的制度来管理外来医疗器械、植入物和设备。在外来医疗器械的管理制度建设方面,研究[4-6]显示国内各家医疗机构普遍存在制度不完善和执行欠佳的情况。因此,医疗机构应完善外来医疗器械管理制度,规范使用程序并加强督查考核。
一份完善的外来医疗器械系统性管理方案起始于多科室参与制定的书面制度[7]。医院内所有的利益相关者如外科医生、手术室、CSSD、感染控制科、行政管理/采购部门均应参与外来医疗器械管理制度的制定,器械供应商也应是外来器械管理方案中重要合作者之一,器械供应商须熟悉医院申请、接收和归还外来器械的要求,知晓管理流程中每个步骤的负责人;但不能让器械供应商主导外来医疗器械的管理流程,供应商对于管理流程的相关建议是有价值的,他们的参与以及理解医院的需求是关键。多科室协作团队必须确立外来器械管理方案的终极目标是准时地为手术室提供完整、绝对清洁无菌的外来医疗器械[8]。
完善的外来医疗器械管理制度应囊括外来医疗器械在医院闭环运转的全过程,即从外科医生计划手术产生外来医疗器械需求开始,到CSSD对污染的器械进行清洁去污归还器械供应商结束。外来医疗器械在每个流转的环节上均需要制度进行规范。具体的制度可包括外来医疗器械申请、运输、接收、手术前处置要求,记录和过程追溯,收费的方法,使用后的处理,归还器械商。除了列出具体的责任和步骤,制度中还应包括监管制度依从性的控制措施。
如何获得医院管理层的支持是落实外来医疗器械管理制度的关键,必要时可以向医院管理层解释行业的最新标准和规范,这些标准和规范是制定医院外来医疗器械管理制度的理论基础;还可以邀请管理层参观外来医疗器械处置,更直观了解外来医疗器械的处理流程,从而支持外来医疗器械的管理制度。
2 外来医疗器械的接收IAHCSMM建议所有的外来医疗器械均要送到CSSD的指定区域。所有器械商送来的外来器械应该封闭在有生物性危险物标识的容器中[9]。外来医疗器械的管理最大挑战之一就是要在医院要求的时间框架内管理和协调这些器械的接收。大多数医院普遍存在外来器械处置时间不足的问题,其原因主要包括器械送达时间晚,器械送达时处于CSSD工作高峰时段,以及处理能力不足。
CSSD处理一套器械大约需要6.5~7 h[10]。美国IAHCSMM建议现有的器械在择期手术前至少2个工作日(48 h)送达;新的器械至少提前3个工作日(72 h)送达,多预留1 d时间是为了确保对新器械进行灭菌测试,以及准备合适的清洁剂、清洗工具和硬质容器。我国卫生行业标准《医院消毒供应中心管理规范》(WS 310.1-2016)要求择期手术最晚应于术前日15时前将器械送达CSSD,急诊手术应及时送达。
实际上外来医疗器械总是无法按照既定时间送达,导致CSSD工作人员没有充分的时间按照标准和规范进行清洁、检查、清点、包装、灭菌、冷却、记录和追溯。CSSD工作人员仓促处理这些外来器械,会导致处理过程中忽略某些重要的工作步骤,甚至出现工作差错[7],如果器械未经充分地清洗,将无法保障器械的灭菌效果,使患者处于感染的风险之中,同样会将医护人员置于风险之中。
器械供应商必须积极配合医院及时将外来器械运送到医疗机构,以便于医院能有充足的时间根据器械说明书彻底处置外来医疗器械,未能将器械及时送达医院会对患者的治疗造成负面的影响,有时为了手术的正常进行,不得不对这些外来医疗器械采取快速灭菌的方法,快速灭菌并非是最佳实践方法,而是除非在紧急情况下不得已采用的方法,而且很多外来医疗器械并没有经过快速灭菌的验证。
如何约束器械供应商在制度规定的时间内将外来器械送达医院,建议从医院管理部门下手,如果外来医疗器械未能在规定时间内送达或器械说明书未同时送达,器械供应商将会收到医院管理部门出具的有关供应商未能遵从医院外来医疗器械管理制度的报告,医院将会与第3次违反制度的供应商终止合作。
3 外来医疗器械的说明书我国卫生行业标准《医院消毒供应中心管理规范》(WS 310.1-2016)要求器械供应商提供植入物与外来医疗器械的说明书(内容应包括清洗、消毒、包装、灭菌方法与参数)。美国IAHCSMM建议如果厂商的器械清单或美国食品药品管理局(FDA)批准的器械拆卸、清洗和灭菌方法的说明书未能与器械同时送达,CSSD工作人员将拒绝接受这些外来医疗器械。美国FDA要求所有的器械供应商提供详细的器械说明书,获取厂商说明书是CSSD的职责,要确保使用最新的说明书(厂商会经常更新使用说明书),当接收外来医疗器械时要在说明书上标注接收的日期。而详细的说明书应包括以下内容:彻底清洁去污的方法和微生物致死性定义;可重复性的操作流程;清晰易懂的流程说明(图表和步骤说明);可在医院采用并完成这些流程的常见化学试剂、耗材、设备;操作流程遵循专业组织的指南和美国职业安全与健康管理局(OSHA)的规范,最大程度的降低血源性病原微生物的暴露风险(OSHA 21 CFR 1910.1030);验证去污有效性方法的说明;清洁剂使用说明书包括稀释/浓度、温度、水质(pH值、硬度)和暴露的时间(浸泡或接触);水的类型和所需的水质(过滤水、去离子水、反渗透水、软化水等)说明;清洁剂的类型和质量、所需的清洁辅助工具;清洗设备的使用说明;手工、机械清洗、漂洗、干燥的说明;机械清洗的时间、温度和水压等参数;去污后功能和清洁度测试的说明;重新装配后使用任何必须的辅助添加剂(润滑剂)的说明;包装材料兼容性的说明;使用商业医用包装材料的说明;包装操作和包装技术兼容性的说明;包装器械与计划灭菌流程兼容性的说明[11]。
4 外来医疗器械的清洗与去污美国急救医学研究所(ECRI)2017年公布的十大医疗技术危害,其中包括“复杂的可复用医疗器械清洗不彻底可能导致感染”,2018年又将“不合理清洗可能导致器械功能异常、设备故障,以及对患者造成潜在的伤害”列为十大医疗技术危害之一,可见器械的清洗对保障患者安全的重要性。
外来医疗器械清洗去污的原则是将所有的外来医疗器械均视为污染的器械[7],需要根据器械厂商书面说明书,确保从最开始的清洗去污环节对外来器械进行处理。另外,外来医疗器械会以不同的方式送达医院,很多运输方式下环境不可控,使得包装的完整性在运输过程中无法得到保障,即使送达医院的器械包装完好,也应该打开重新进行清洗。国外研究[9]显示,在2个月内对139套包装完好的外来器械进行检测,其中23套(16.5%)血液残留测试阳性。2009年美国德州某医院在2周内发生7例铜绿假单胞菌导致的器官/腔隙感染的暴发,经脉冲凝胶电泳证实致病菌具有同源性,流行病学调查[12]显示,感染暴发最大可能是因为器械清洗不彻底导致关节镜套管和吸引器管腔中有组织残留,残留的组织为细菌污染提供了保护,导致灭菌最终失败。
不合格的清洗可能会导致手术器械成为传播医院感染的宿主[13],对使用过的器械进行清洗去污是为了有效减少器械上的生物负荷、蛋白质和无机污物以提高灭菌的可靠性,另外可保护工作人员,避免在处理器械时发生意外伤害获得外源性感染[14]。尽管清洗能有效地降低手术器械上的生物负荷,但还是能在很多清洗过的器械上检测出高水平蛋白类物质和来源不明的非蛋白类污物(非蛋白、微生物、内毒素)的残留,而残留的物质即使经过灭菌处理,仍然可能通过手术进入人体导致严重的并发症[15]。因此,对清洗质量进行监测是手术器械安全的重要保障,WS 310规范指出清洗质量的监测主要包括每年采用清洗效果测试物对清洗消毒器的清洗效果进行监测,以及用目测法或定量检测的方法对诊疗器械、器具和物品的清洗效果进行评价。美国医疗仪器促进协会(AAMI ST79)则建议至少应每周对机械清洗消毒器的清洗效果进行1次监测,但如何对手术器械清洁程度的基线值进行设定依旧缺乏统一的标准。AAMI TIR 34:2007和AAMI TIR 30:2011曾提到清洁后的软式内镜管腔内蛋白残留应<6.4 mg/cm2、血红蛋白应<2.2 mg/cm2。但值得注意的是,这些基线值只是厂商使用说明书的要求,并不一定能反映器械真实存在的感染传播风险。
国内调查[16]显示,医院在外来医疗器械清洗方面还存在一些问题,有些外来器械未经过清洗程序就直接包装灭菌,还有部分医院的外来医疗器械由器械供应商负责清洗[17]。CSSD应该按照WS 310.1-2016及供应商提供说明书的要求选择合适的方法对外来医疗器械进行清洗与处置。
5 外来医疗器械的检查与包装外来医疗器械在包装前必须检查器械清洗质量及器械功能。清洁质量检查的常规方法包括目测法及镜检法,如有必要,可采用残留蛋白测试、ATP检测、甚至微生物培养等客观评价方法。器械功能检查包括所有的活动零部件、头部、盒锁、棘齿、螺丝、边缘是否有缺陷以及功能是否正常。
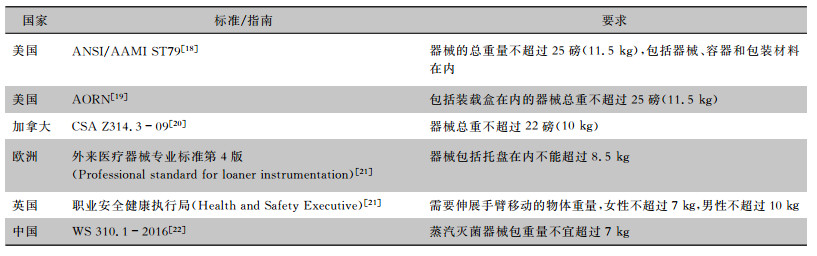
外来医疗器械往往器械多、重、体积大,多采用硬质容器包装,器械包的规格往往超出行业标准对器械包的要求。各国标准和指南对器械包裹的重量均有要求,见表 1。
| 表 1 器械包裹重量指南/标准要求归纳表 |
|
经过比较,笔者认为我国行业标准对器械包重量的规定似乎更多是从职业安全的角度出发,这条标准从2002年国家卫生部颁布实施的《消毒技术规范》一直沿用至WS 310.1-2016,只是在描述的程度上从“不应超过”改成了“不宜超过”,国内有研究[23]指出器械包总重在不超过11 kg的情况下,严格遵照厂家说明书进行灭菌参数设置也可保障灭菌效果,且操作人员满意程度也较高。
6 外来医疗器械的灭菌与监测任何情况下器械供应商提供的所有外来器械均应被视为“非无菌器械”[1],因为医院无法验证外来器械是否真的无菌,所以必须从清洗去污开始处理。如果直接使用在外院已经灭菌过的器械,一旦发生召回事件,医院无法提供灭菌过程的记录,而且医院无法知晓“经灭菌的器械”在器械供应商的运输工具中停留了多长时间以及真实的储存环境,外来医疗器械在运输的过程中器械无菌状态遭到破坏的可能性极大。
目前外来医疗器械灭菌首选高压蒸汽灭菌,湿包是外来医疗器械蒸汽灭菌后普遍存在的问题,残留的水分可能会为微生物从外界环境移行至器械包裹内创造有力的条件,从而导致器械被污染[24]。而湿包的主要原因是灭菌器超载和外来医疗器械超重。尤其是采用硬质容器包装的器械,不易透气,产生的冷凝水多,湿包发生率高,容易导致灭菌失败[25]。美国AORN强调外来器械送达时间晚不应成为采用快速灭菌的正当理由,植入物不能采用快速灭菌的方式灭菌。
美国ANSI/AAMI ST79建议器械要有标签,标签上注明“厂商已经验证过的清洗、灭菌的具体方法”,很多器械只在长灭菌周期下进行过验证,例如5、8、10、18、20 min,而非传统的预真空132 ℃下4 min,如果实际暴露时间短于建议时间,物品可能无法达到灭菌状态。ANSI/AAMI ST79同时还建议对需要进行长灭菌周期灭菌的器械进行产品测试,从而提供灭菌有效性额外的数据以及验证厂商的使用说明书,每个测试包均包括化学指示物和生物指示物,指示物的数量根据测试包的大小和形状,位置放置在灭菌挑战最大的地点[26]。需要注意的是自含式生物指示剂或许并不适合延长的灭菌周期,ISO12161提到:用户不应长时间加热培养基,延长的灭菌周期会影响培养基促进微生物生长的特性。如果器械中包含植入物,必须使用生物指示剂进行监测,而且要待生物监测的阴性结果出来后才能放行。所有含有植入物的装载可采用生物PCD(过程挑战装置)和5类化学综合指示物PCD,PCD代表了灭菌器已知的挑战,模拟了医院实际处理的物品,测试结果也能确保灭菌过程的有效性及避免湿包。
当接收 新的外来医疗器械时需验证器械是否可以遵循使用说明书和CSSD的灭菌流程进行灭菌处理。WS 310也要求首次灭菌时对灭菌参数和有效性进行测试,虽然医院通常没有合适的工具在某个特定的灭菌循环中验证某件器械的灭菌参数,但医院可以要求器械生产商进行测试和验证并提供充分的证据;验证灭菌的有效性可将化学指示物和生物指示物放置在最难灭菌包裹的最难灭菌位置进行测试。
7 外来医疗器械的术后管理国内医院的调查[3]发现,使用后的外来医疗器械大部分由公司或厂家负责清洗,仅有小部分器械使用后送至CSSD按规范处理,因为公司或厂家人员未经专业培训,无法做到规范的清洗消毒,清洗的质量得不到保障。
器械使用后做到规范及时清洗非常关键,因为有些微生物在复杂器械上有形成生物膜的倾向,生物膜的形成与器械相关感染密切相关,因为生物膜中的微生物对抗菌药物的抵抗能力比游离的微生物强[27]。生物膜相关的感染是术后致死致残的主要原因[28]。生物膜的形成需要特定的条件,有微生物存在,有定植的物体表面,有足够的营养和水,适宜生长的温度,以及生物膜形成所需的时间,其中最容易控制的因素是时间,一些革兰阴性菌每隔20~30 min会发生一次细胞分裂,成熟的生物膜形成可能需要数小时[29]。所以,可复用器械使用后处理的速度是预防生物膜形成的关键[30]。外来器械使用后及时清洗和终末灭菌可将生物膜形成的机会降至最低。
美国IAHCSMM建议外来器械在术后2个工作日内由器械供应商取回;欧洲外来医疗器械专业标准建议外来器械在医院停留的时间应该限制在4 d内,第1~2 d由CSSD做术前处理,手术使用1 d,手术后CSSD清洁去污归还占用1 d,归还器械时附有器械的去污声明。国内也有医院自行设计“外来手术器械用后清洗消毒单”,在归还外来器械时一并交于器械供应商[31]。有些国外医院使用器械供应商管理软件,器械供应商送达器械时需要在CSSD进行系统登录、取回器械时必须在CSSD退出系统,这样可以杜绝器械供应商直接从手术室取回未经清洁去污的外来手术器械[32]。
8 总结对外来医疗器械进行有效的管理是手术室和CSSD当下面临的最大挑战之一,因为外科手术的技术越来越先进,器械的成本也在不断增加,因此在医院内使用外来医疗器械也会愈来愈普遍。由于多重耐药菌、克雅病、生物恐怖威胁的出现,处理外来医疗器械的问题对感染控制以及患者、医护人员、器械供应商的安全均会产生影响[9]。对外来医疗器械进行规范化、程序化管理需要供应商、医院相关科室、手术室和CSSD相互协作。尽管各级医疗机构对外来医疗器械的管理比较重视,但管理环节及细节还有待完善,对工作环节的督查更需加强。因此,医疗机构应严格按照卫生与计划生育委员会的行业标准要求将外来医疗器械纳入医院的程序化管理,规范供应商的行为,重视器械在接收、清洗、消毒、包装、灭菌、发放及使用后回收处理等环节的质量管理,以确保外来医疗器械的使用质量,最终达到保障患者利益和安全的目的[33]。
确保外来医疗器械无污染和及时妥善处理是医疗机构的伦理职责,医疗机构必须为患者提供安全的医疗器械和植入物。外来医疗器械的所有利益相关者组成的团队来评估和制定处理的流程和制度并加以落实是各方共赢的解决方案。团队的所有成员均须意识到每件外来医疗器械均与患者的手术安全息息相关。
| [1] |
Duro M. New IAHCSMM loaner instrumentation position paper and policy template[J]. Aorn J, 2011, 94(3): 287-289. DOI:10.1016/j.aorn.2011.07.002 |
| [2] |
Huter-Kunish GG. Processing loaner instruments in an ambulatory surgery center[J]. AORNJ, 2009, 89(5): 861-870. DOI:10.1016/j.aorn.2009.02.002 |
| [3] |
张宇, 冯秀兰, 任伍爱, 等. 中国9省市医院消毒供应中心3项标准执行现状与分析[J]. 中华医院感染学杂志, 2014, 24(10): 2549-2551. |
| [4] |
陆蕾, 董卫红, 黄明芬. 医院外来医疗器械管理存在的问题与对策[J]. 中华医院管理杂志, 2014, 30(5): 370-371. DOI:10.3760/cma.j.issn.1000-6672.2014.05.017 |
| [5] |
周彬, 巩玉秀, 张宇, 等. 外来医疗器械与植入物处理现况分析[J]. 中国医院, 2014, 18(11): 3-4. DOI:10.3969/j.issn.1671-0592.2014.11.002 |
| [6] |
俞桂珍, 叶旭琴, 汤秋芳, 等. 外来医疗器械管理现状及管理对策研究[J]. 中华医院感染学杂志, 2017, 27(10): 2393-2396. |
| [7] |
Seavey R. Reducing the risks associated with loaner instrumentation and implants[J]. AORN J, 2010, 92(3): 322-331. DOI:10.1016/j.aorn.2009.12.032 |
| [8] |
Nestman C, Mckinley M. Loaner instrument tray management: A shared responsibility[EB/OL].(2010-1)[2018-5]. https://www.hpnonline.com/.
|
| [9] |
Winthrop TG, Sion BA, Gaines C. Loaner instrumentation: processing the unknown[J]. AORN J, 2007, 85(3): 566-573. DOI:10.1016/S0001-2092(07)60128-8 |
| [10] |
Young M. Putting teeth in your loaner set policy[J]. OR Manager, 2011, 27(9): 22-23, 26. |
| [11] |
Chobin N. Effective management of loaner instrumentation[J]. Perioperative Nurs Clin, 2010, 5(3): 393-396. DOI:10.1016/j.cpen.2010.04.003 |
| [12] |
Tosh PK, Disbot M, Duffy JM, et al. Outbreak of Pseudomonas aeruginosa surgical site infections after arthroscopic procedures: Texas, 2009[J]. Infect Control Hosp Epidemiol, 2011, 32(12): 1179-1186. DOI:10.1086/662712 |
| [13] |
Lipscomb IP, Sihota AK, Keevil CW. Comparative study of surgical instruments from sterile-service departments for presence of residual gram-negative endotoxin and proteina-ceous deposits[J]. J Clin Microbiol, 2006, 44(10): 3728-3733. DOI:10.1128/JCM.01280-06 |
| [14] |
Rutala WA, Gergen MF, Jones JF, et al. Levels of microbial contamination on surgical instruments[J]. Am J Infect Control, 1998, 26(2): 143-145. DOI:10.1016/S0196-6553(98)80034-5 |
| [15] |
Huys J. The sterile supply cycle: cleaning, sterilisation of medical devices by steam: general theory[M]. Heart Consultancy, Renkum, The Netherlands, 2006.
|
| [16] |
刘卫红, 周万丹. 手术室外来器械的使用与管理现状调查[J]. 中国感染控制杂志, 2008, 7(4): 264-265,271. DOI:10.3969/j.issn.1671-9638.2008.04.014 |
| [17] |
张宇, 冯秀兰, 任伍爱, 等. 医院消毒供应中心落实三项标准的调查[J]. 中国感染控制杂志, 2014, 13(4): 193-197. DOI:10.3969/j.issn.1671-9638.2014.04.001 |
| [18] |
Association for the Advancement of Medical Instrumentation. ANSI/AAMI ST79: 2006-Comprehensive guide to steam sterilization and sterility assurance in health care facilities[S]. Arlington, VA: Association for the Advancement of Medical Instrumentation, 2006, 60.
|
| [19] |
Graybill-D'Ercole P. Implementing AORN recommended practices for sterilization[J]. AORN J, 2013, 97(5): 521-533. DOI:10.1016/j.aorn.2013.03.002 |
| [20] |
Canadian Standards Association. CAN/CSA-Z314. 3-09 Effective sterilization in health care facilities by the steam process[S]. Rexdale, Ont.: Canadian Standards Association, 2009.
|
| [21] |
The Project Group Loaner Instrumentation. Professional standard for loaner instrumentation-Standard for loaning or renting of surgical instruments[S]. Netherlands: The Project Group Loaner Instrumentation, 2010.
|
| [22] |
巩玉秀, 冯秀兰, 付强, 等. 医院消毒供应中心第1部分:管理规范WS 310.1—2016[J]. 中国感染控制杂志, 2017, 16(9): 887-892. |
| [23] |
黄浩, 周晓丽, 陈慧. 超重器械包装及灭菌效果的实验研究[J]. 中国消毒学杂志, 2013, 30(6): 577-578. |
| [24] |
Basu D. Reason behind wet pack after steam sterilization and its consequences: An overview from central sterile supply department of a cancer center in eastern India[J]. J Infect Public Health, 2017, 10(2): 235-239. DOI:10.1016/j.jiph.2016.06.009 |
| [25] |
王凤勤. 外来骨科医疗器械接管中存在的问题与对策[J]. 护理实践与研究, 2012, 9(20): 97-98. DOI:10.3969/j.issn.1672-9676.2012.20.056 |
| [26] |
Association for the Advancement of Medical Instrumentation. AAMI TIR31: 2008 Process challenge devices/test packs for use in health care facilities[R]. AAMI, 2008.
|
| [27] |
Donlan RM. Biofilm formation: a clinically relevant microbiological process[J]. Clin Infect Dis, 2001, 33(8): 1387-1392. DOI:10.1086/cid.2001.33.issue-8 |
| [28] |
Edmiston CE, McBain AJ, Kiernan M, et al. A narrative review of microbial biofilm in postoperative surgical site infections: clinical presentation and treatment[J]. J Wound Care, 2016, 25(12): 693-702. DOI:10.12968/jowc.2016.25.12.693 |
| [29] |
Roberts CG. The role of biofilms in reprocessing medical devices[J]. Am J Infect Control, 2013, 41: S77-S80. |
| [30] |
Mittelman MW. Bacterial biofilms in pharmaceutical water systems[J]. Drugs Pharmaceut Sci, 2008, 174: 699. |
| [31] |
杨风, 赵自云, 杨杰书, 等. 外来手术器械使用后规范化处理探讨[J]. 中华医院感染学杂志, 2015, 25(15): 3583-3585. |
| [32] |
Burns J. Loaner inventory management system and method: U.S. Patent Application 10/100,007[P]. 2003-9-25.
|
| [33] |
黄玉华, 李焕平, 陈雯玮, 等. 医院外来手术器械管理现状及清洗质量调查[J]. 护理研究, 2013, 27(6): 1815-1817. |



