2. 陆军军医大学第二附属医院中心实验室, 重庆 400037
2. Central Laboratory, The Second Affiliated Hospital of Military Medical University, Chongqing 400037, China
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种广泛存在于自然环境的革兰阴性条件致病菌[1],也是医院感染最常见的病原体之一[2-3]。PA强大的环境适应能力及复杂的毒力调控机制是导致其感染后高耐药、高死亡的重要原因。PA的毒力组分众多,包括菌体组分相关的菌毛、鞭毛及脂多糖[4],胞外的分泌性毒力因子/蛋白,如绿脓素、绿色荧光素、蛋白酶、氰化物等[5-6]。此外,PA的Ⅲ型毒力蛋白分泌系统(type Ⅲ secretion system,T3SS),其可将毒性效应蛋白ExoS、ExoT、ExoY和/或ExoU注入宿主细胞,促进宿主细胞的凋亡及炎症反应,并在PA的急性感染中发挥重要作用[7]。PA的群体感应(quorum sensing,QS)系统根据其化学信号分子组成的不同,可分为3类,即las、rhl系统和喹诺酮(Pseudomonas quinolone signal,PQS)系统,其信号分子分别为N-3-氧代十二烷基-L-高丝氨酸内酯(N-(3-oxododecanoyl)-L-homoserine lactone,3-oxo-C12-HSL)、N-丁酰基-L-高丝氨酸内酯(N-butyryl-L-homoserine lactone,C4-HSL)和2-庚基-3-羟基-4-喹诺酮(2-heptyl-3-hydroxy-4-quinolone,PQS)[8]。
PA具有目前已知的最大的细菌基因组,其中大量基因功能仍不清楚[9]。根据Pseudomonas Genome Database数据库(http://www.pseudomonas.com)提供的生物信息学预测,PA1864蛋白可能具有DNA结合能力,并可能作为一种转录调节因子调节基因表达。然而,PA1864基因及其基因编码蛋白的实际生物学功能与PA毒力及致病性间是否有关联,目前仍无相关报道。本研究拟通过对比铜绿假单胞菌PAO1野生菌株及其PA1864基因敲除菌株(△PA1864)在细菌毒力表型及致病性中的差异,探讨PA1864基因在PA毒力及致病性中的作用,为进一步揭示PA1864基因的实际生物学功能提供依据。
1 材料与方法 1.1 材料 1.1.1 试验菌株与引物PAO1/pUCP-Red、△PA1864、E.coli JM109/pSB1075、E.coli JM109/pSB536菌株均为本实验室前期构建及保存。试验所用的荧光定量引物见表 1。
| 表 1 荧光定量引物 Table 1 Fluorescence quantitative primers |

|
人非小细胞肺癌A549细胞购于中科院上海细胞库。试验动物BALB/c小鼠,6~8周,雄性,体重20~25 g,购于陆军军医大学实验动物中心。动物试验经过陆军军医大学实验动物福利伦理审查委员会审批,符合动物伦理和动物福利要求。
1.1.3 主要试剂和仪器免疫组化试剂盒购于北京中杉金桥生物技术有限公司,CCK8细胞活性检测试剂盒购自于上海碧云天生物技术有限公司,Annexin V-FITC凋亡试剂盒购于BD bioscience,荧光定量PCR酶、RNAiosplus、逆转录试剂盒购自TaKaRa,HPLC色谱柱TSKgelODS-100Z(4.6×250 mm,5 μm)购于日本东曹。电转仪、凝胶成像系统购于Bio-Rad公司,Nanodrop微量核酸仪购于美国Thermo fisher,实时荧光定量PCR仪购于美国ABI公司,流式细胞检测仪购于美国Beckman,高效液相色谱仪购自于美国Waters公司。
1.2 方法 1.2.1 生长曲线测定挑取PAO1、△PA1864单菌落于20 mL LB液体培养基中37℃,200 r/min培养至对数生长期。取活化后菌液用无菌PBS缓冲液调整细菌浓度至OD600/mL=1.0。以OD600/mL=0.005的初始浓度,将PAO1接种于200 mL LB液体培养基中,37℃,200 r/min培养36 h。培养期间,每2 h取样测定吸光度值OD600。
1.2.2 宿主致病性研究 1.2.2.1 小鼠急性肺感染模型建立取30只6~8周BALB/c小鼠,按随机数字表法分为PBS对照组、PAO1和△PA1864感染组,每组10只小鼠。小鼠经乙醚麻醉后,取20 μL经PBS调整后的菌液(浓度为3×109/mL)进行小鼠滴鼻感染,10 μL/鼻孔。对照组使用无菌PBS缓冲液进行相同处理。各组小鼠分笼饲养,每日记录小鼠的健康状况,统计小鼠的死亡数。感染后7日为观察终点,若7日内死亡,则以死亡时间作为观察终点。
1.2.2.2 小鼠体重检测感染前称量小鼠体重并标记为W0, 观察终点时体重记为Wlast。小鼠体重变化= Wlast/W0×100%。
1.2.2.3 小鼠肺水肿检测取小鼠肺组织,测定湿重(wet weight,WW),将肺组织置于70℃烤箱内烘干后测定肺组织干重(dry weight,DW)。肺水肿表示为肺组织湿重与干重之比,即WW/DW。
1.2.2.4 小鼠肺组织病变及炎症的检测(1) HE染色:采用4%多聚甲醛固定液固定小鼠肺部组织,经脱水、石蜡包埋、切片后,采用苏木素染细胞核5 min,1%盐酸乙醇分化30 s后温水返蓝。采用伊红复染30 s后,乙醇梯度脱水,二甲苯透明后使用中性树胶封片。(2)免疫组化:取小鼠肺组织石蜡经脱蜡、水化、抗原修复后,3% H2O2封闭内源性过氧化物酶体。采用抗白细胞表面抗原CD45抗体和抗巨噬细胞F4/80抗体作为一抗(均购自Abcam),以1 :200比例,4℃孵化过夜。漂洗后二抗室温孵育,以DAB显色,苏木精染液复染后,1%盐酸乙醇分化、温水返蓝、脱水、透明后封片。
1.2.3 细胞毒性检测 1.2.3.1 细胞活力采用含10%FBS的DMEM培养基培养A549细胞,待其生长至80%汇合度,取细胞经0.25%胰酶消化后制备单细胞悬液。按照1×104个细胞/100 μL每孔将细胞加入至96孔板中,37℃,5% CO2培养至80%汇合度。菌体感染试验:按照感染复数MOI=50的比例加入细菌;上清液感染试验:每孔加入100 μL过滤后的细菌培养上清液处理细胞;对照组加入等体积的含10%FBS的DMEM培养基,每组设置6个平行孔。37℃,5% CO2培养2 h,每孔加入10 μL CCK-8溶液培养2 h,酶标仪检测A450吸光度值,计算抑制率=(1-A处理/A对照)×100%。
1.2.3.2 细胞凋亡A549细胞按照1×106个细胞/孔铺于6孔板,37℃,5% CO2培养至80%汇合度。按照感染复数MOI=50的比例加入细菌,37℃,5% CO2培养2 h。采用0.25%胰酶消化细胞获取单细胞悬液。采用1×binding buffer调整细胞浓度至1×106个/mL,加入5 μL Annexin V-FITC染液,室温避光孵育15 min后加入5 μL PI染液染色5 min,应用流式细胞术检测菌株对细胞凋亡的影响。
1.2.4 毒力因子检测 1.2.4.1 细菌胞外蛋白酶活性(1) 细菌培养:挑取PAO1、△PA1864单菌落于10 mL LB培养基中,37℃,200 r/min振荡培养至对数生长期。将细菌接种于200 mL LB培养基中,至初始浓度OD600/mL= 0.01。37℃,200 r/min振荡培养24 h并于第3、6、9、12和24 h收集细菌上清-80℃保存备用。(2)牛奶平板制备:称取叠氮钠0.03 g、SDS 0.02 g、琼脂粉1.0 g,溶解于0.05 mol/L Tris-HCl(pH 7.5)中,121℃高压蒸汽灭菌30 min,加入2.0 g脱脂奶粉,充分混匀后倾倒平板,并打孔。(3)蛋白酶活性检测:取上述细菌培养上清,按照100 μL/孔加入至牛奶平板相应孔中,37℃放置12 h,观察透明环形成情况。
1.2.4.2 绿脓素取上述细菌上清4 mL加入等体积氯仿,充分振荡混匀, 静置2 h后,取下层有机相2 mL加入800 μL 2 mol/L HCl溶液。充分振荡后静置待其分层。取上层粉红色盐酸相测定A520吸光度值。
1.2.4.3 绿色荧光素(1) 金氏B培养基制备:称取K2HPO4 1.5 g、MgSO4 1.5 g、蛋白胨20.0 g、琼脂粉15.0 g,溶解于ddH2O并定容至1 000 mL,调整pH至7.2±0.2。(2)样品制备:将活化细菌接种于20 mL金氏B培养基中,至初始浓度OD600/mL=0.01,37℃,200 r/min振荡培养12 h,取4 mL菌液,12 000 r/min常温离心5 min,分别收集细菌菌体和上清。菌体沉淀用于细菌浓度(A600)测定,上清用于绿色荧光素检测。(3)绿色荧光素检测:取上述细菌上清加入0.1 mol/L Tris-HCl(pH 8.0)稀释3倍。取稀释液后菌液测定其A405吸光度值。按照A450/A600矫正细菌绿色荧光素含量。
1.2.4.4 细菌泳动能力(1) 泳动平板制备:称取胰蛋白胨10.0 g、NaCl 5.0 g、Difco琼脂粉5.0 g,加入ddH2O中溶解并定容至1 000 mL。121℃高压蒸汽灭菌30 min,倾倒平板。(2)泳动能力检测:取1.2.4.1步骤中收集的12 h菌液上清1 μL点于平板中央,30℃静置培养12 h,观察细菌运动情况。
1.2.5 T3SS系统(1) RT-qPCR检测基因表达:取1.2.4.1步骤获取的菌体沉淀,加入1.0 mL RNAios plus裂解菌体,提取细菌RNA。RT-qPCR检测exoS、pcrV基因表达水平,并设置rplU为内参基因。(2)Western blot检测蛋白表达水平:取1.2.4.1步骤获取的细菌沉淀加1 mL mol/L RIPA裂解液(PMSF终浓度1 mmol/L),冰上超声破碎(振幅30%,超5 s,停10 s,超声5 min),4℃,12 000 r/min离心10 min收集菌体蛋白。采用抗ExoS和PcrV多克隆抗体Western blot检测蛋白表达水平。
1.2.6 QS系统(1) 信号分子提取:取1.2.4.1步骤获取的菌液上清8 mL与等体积乙酸乙酯(0.5%甲酸酸化)混合,涡旋振荡,静置分层后取有机相,蒸发干燥后,50%甲醇溶解,-20℃保存。(2)报告菌株平板法检测3-oxo-C12-HSL或C4-HSL含量:分别接种信号分子报告菌株E.coli JM109/pSB1075(检测3-oxo-C12-HSL)和E.coli JM109/pSB536(检测C4-HSL)于LB液体培养基中,30 ℃,200 r/min振荡培养至对数生长期。取70 mL培养菌液,加入至140 mL含2.1%琼脂的LB培养基中(终浓度0.7%)。倾倒平板,凝固后打孔,每孔加入50 μL信号分子样品。30℃避光培养12 h,凝胶成像仪曝光,检测报告菌株的生物发光环。(3)高效液相色谱法(HPLC)检测PQS含量:采用等度洗脱法进行检测。流动相:86%甲醇(1%冰醋酸酸化)和14%超纯水(1%冰醋酸酸化),流速1 mL/min,Waters 2998 Photodiode Array检测器检测样品A325吸光值。PQS标准品进样浓度250 μg/mL。通过比较标准品和样品峰面积,计算样品中PQS含量。
1.3 统计学分析应用GraphPad Prism 5.0软件作图,应用SPSS 20.0软件进行统计分析,组间比较采用单因素方差分析或t检验,P<0.05为差异有统计学意义。
2 结果 2.1 PA生长情况检测PAO1及△PA1864菌株在LB液相培养条件下的菌体浓度,PA细菌生长曲线结果显示,0~6 h为生长迟缓期,6~16 h为对数期,16~28 h为稳定期,在28 h后细菌处于衰亡期。PAO1与△PA1864的生长曲线无明显差别。见图 1。
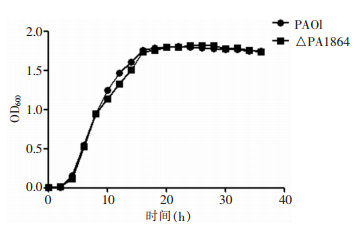 |
| 图 1 野生菌株PAO1与基因敲除菌株△PA1864生长曲线 Figure 1 Growth curves of PAO1 wild type strain and gene knockout strain △PA1864 |
与PAO1感染组相比,△PA1864菌株感染组小鼠死亡率降低,体重降低减缓,肺水肿情况明显改善。HE染色结果显示,△PA1864感染小鼠肺组织炎症细胞浸润、组织损伤及肺泡腔内出血严重程度低于PAO1感染组。免疫组化检测白细胞表面抗原CD45及巨噬细胞表面抗原F4/80,△PA1864感染小鼠肺组织浸润的白细胞及巨噬细胞低于PAO1感染组。见图 2。
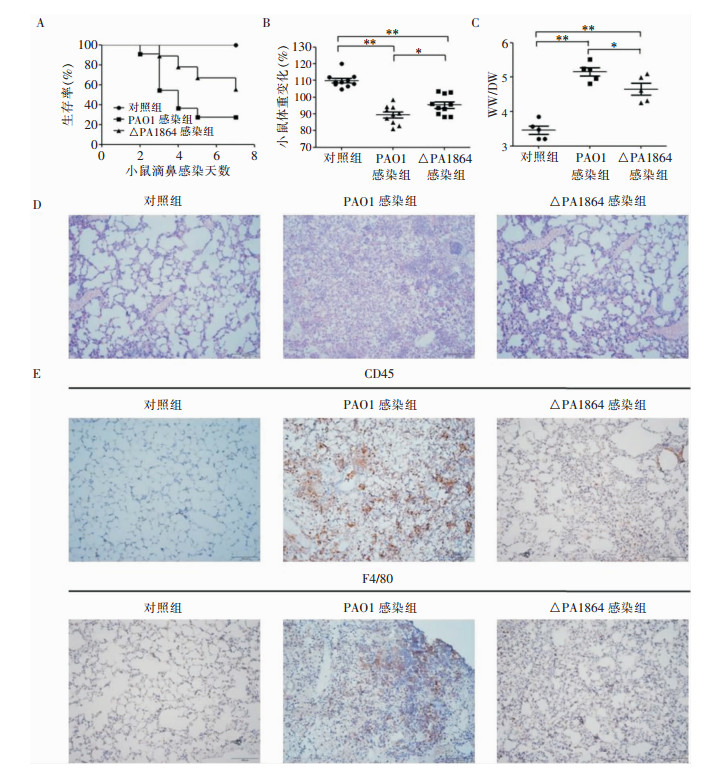 |
| A:小鼠生存曲线;B:小鼠体重变化;C:小鼠肺组织水肿检测;D:小鼠肺组织HE染色;E:小鼠肺组织免疫组化染色(CD45、F4/80);**:P<0.01;*:P<0.05 图 2 PA1864基因敲除对PA宿主致病性的影响 Figure 2 Effect of PA1864 gene knockout on pathogenicity of PA to host |
采用PAO1、△PA1864细菌及其分泌上清分别感染A549细胞,并通过CCK-8法检测细胞活性,结果显示,与PAO1感染组相比,△PA1864菌体感染组的细胞抑制率明显降低,差异具有统计学意义;△PA1864分泌上清感染细胞组细胞活性略有下降,但不具有统计学意义。△PA1864菌体感染的A549细胞凋亡(早期凋亡+晚期凋亡)情况较PAO1感染组更轻。△PA1864菌体感染A549细胞的细胞凋亡率低于PAO1组,且差别具有统计学意义。见图 3。
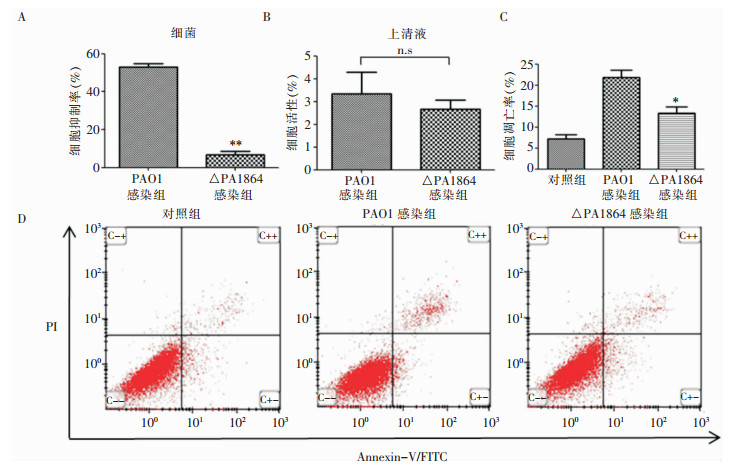 |
| A:CCK-8法检测菌体感染对细胞的毒性;B:CCK-8法检测细菌培养上清液对细胞的毒性;C:细胞凋亡比例统计;D:流式细胞术检测细菌感染后细胞凋亡情况(C--象限为活细胞, C+-象限为早期凋亡细胞, C+ +象限为晚期凋亡细胞, C-+象限为坏死细胞);**:P<0.01;*:P<0.05;n.s:与PAO1感染组相比,差异无统计学意义 图 3 PA1864基因敲除对PA细胞毒性的影响 Figure 3 Effect of PA1864 gene knockout on cytotoxicity of PA |
绿脓素含量检测结果显示,随着培养时间的延长,细菌产生的绿脓素逐渐增加,且在培养24 h后△PA1864菌株产生的绿脓素含量高于PAO1菌株。△PA1864菌株在对数生长期产生的绿色荧光素略低于PAO1菌株,但差异无统计学意义。△PA1864与PAO1菌株分泌性蛋白酶(主要是弹性蛋白酶)的产生未见明显差别。观察细菌运动方式,试验结果显示,与PAO1菌株相比,△PA1864菌株的泳动环直径明显减小,泳动环直径检测证实该差异具有统计学意义。见图 4。
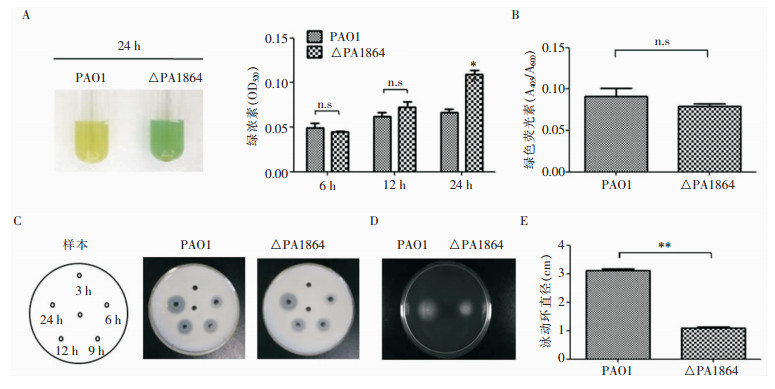 |
| A:绿脓素含量检测;B:绿色荧光素含量检测;C:牛奶平板法检测蛋白酶活性;D:运动平板法检测细菌泳动能力; E:泳动环直径测定;**:P<0.01;*:P<0.05;n.s:与PAO1组相比差异无统计学意义 图 4 PA1864基因敲除对PA毒力相关表型的影响 Figure 4 Effect of PA1864 gene knockout on PA virulence -related phenotypes |
与PAO1野生株相比,△PA1864的exoS、pcrV和exsA基因表达水平在细菌培养的早期(3 h和6 h)明显下调,而在细菌对数生长中晚期(12 h)未有明显变化。Western blot也证实,在细菌生长的早期(3 h和6 h),△PA1864菌株的ExoS和PcrV蛋白表达量低于PAO1野生菌株。见图 5。
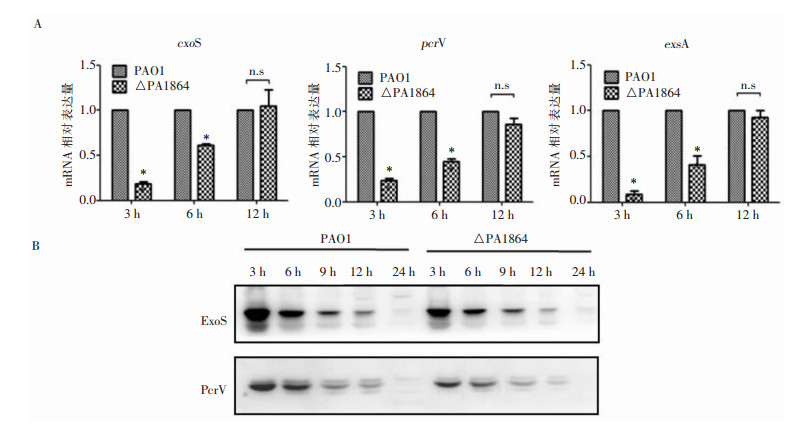 |
| A:RT-qPCR检测T3SS相关蛋白编码基因exoS、pcrV和exsA的表达水平;B:Western blot检测ExoS和PcrV蛋白表达情况;*:P<0.05;n.s:与PAO1组相比差异无统计学意义 图 5 PA1864基因敲除对T3SS相关基因及蛋白表达的影响 Figure 5 Effect of PA1864 gene knockout on T3SS -related genes and protein expression |
检测las、rhl系统信号分子,结果显示,3-oxo-C12-HSL含量在细菌培养至6 h时即可明显检测到,而C4-HSL含量在细菌对数生长的中晚期(12 h)明显升高;与野生株PAO1相比,△PA1864菌株培养上清中3-oxo-C12-HSL和C4-HSL合成量无明显区别。见图 6。HPLC法检测细菌培养上清中PQS信号分子的合成量,结果显示,在细菌培养至12 h即可明显检测到PQS产生,且随着培养时间延长至24 h,其产量逐渐增加。与PAO1相比,△PA1864菌株的PQS信号分子合成量明显高于PAO1菌株。见图 7。
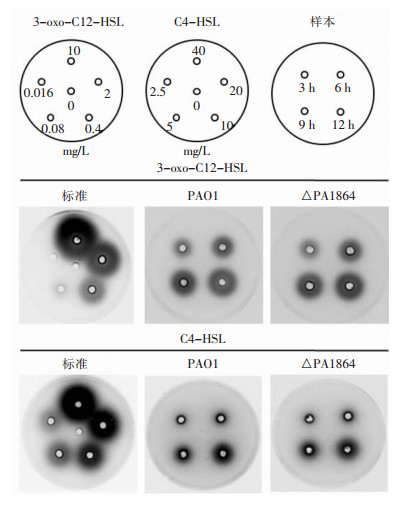 |
| 图 6 报告菌株平板法检测AHL信号分子合成情况 Figure 6 Synthesis of AHL signal molecule detected by strain plate method |
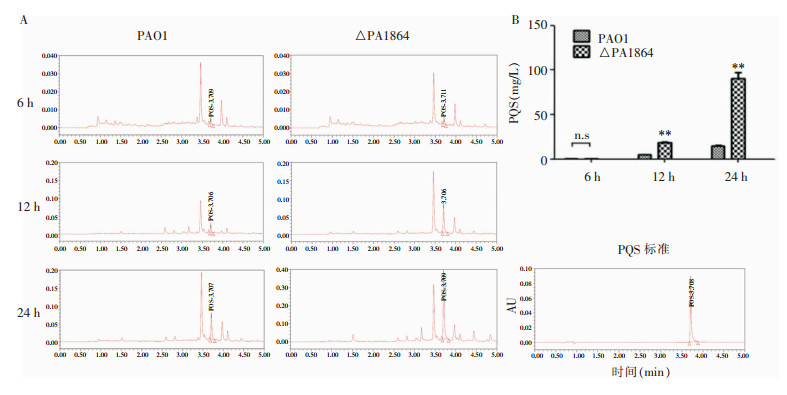 |
| A:HPLC检测PQS信号分子峰图;B:HPLC检测后PQS信号分子含量计算结果;**:P<0.01;n.s:与PAO1组相比差异无统计学意义 图 7 HPLC法检测PQS信号分子合成情况 Figure 7 Synthesis of PQS signal molecule detected by high performance liquid chromatography |
PA1864基因是PA的一个未知功能基因,位于PA基因组负义链上(2023281~2023931),编码基因长度为648 bp,基因编码蛋白由216个氨基酸组成,分子量为23.9 KDa。本研究使用的△PA1864菌株为课题组前期构建保存。构建方法是采用融合PCR方法获得含有四环素抗性基因的打靶片段,基因测序证实融合成功后,利用Red同源重组系统使基因打靶片段与目的基因发生同源重组,从而实现PA1864基因的原位敲除[10]。菌株构建后通过交叉PCR方法鉴定证实△PA1864菌株构建成功。
研究比较野生菌株PAO1与敲除菌株△PA1864对急性肺感染小鼠致病性的差异,发现与PAO1感染组相比,△PA1864感染组的小鼠死亡率下降,肺部水肿和炎症细胞浸润降低,提示PA1864基因敲除可抑制PA急性感染。PA1864基因敲除后PA的细胞抑制率明显下降,并且可抑制细菌感染诱导的细胞凋亡,提示PA1864基因敲除会导致PA细胞毒性下降,说明PA1864基因敲除在体内和体外环境中均可导致PA致病性下降。
细菌的致病性与其毒力密切相关。为进一步评价PA1864基因敲除对PA毒力因子/蛋白的分泌及泳动能力的影响,对PA分泌性毒力因子/蛋白和细菌泳动能力进行检测。PA毒力相关表型检测发现,PA1864基因敲除对PA绿色荧光素和分泌性弹性蛋白酶的合成及分泌无明显影响,但是可以抑制PA T3SS蛋白(如ExoS和PcrV)表达及泳动能力,可以促进PA绿脓素的分泌。尽管PA绿脓素分泌水平在PA1864基因敲除后有所上升,但由于绿脓素主要在细菌培养的中晚期产生,且其主要与PA的长期慢性感染相关。因此,推测PA1864基因敲除引起的绿脓素产量增加在PA的急性期感染中并不起主要作用。T3SS是加剧PA急性期感染最关键的毒力系统,PA1864基因敲除后引起的T3SS下降很可能是导致△PA1864菌株急性期感染致病性及细胞毒性降低的关键。
QS系统是细菌密度依赖性的基因调控系统,其可通过细菌分泌的化学信号分子彼此感知、交流、相互协调,与细菌的毒力及环境适应性密切相关。当3-oxo-C12-HSLs、C4-HSLs和PQS信号分子与其相应的转录调节因子LasR、RhlR和PqsR结合后可形成复合物,该复合物可通过调节PA毒力因子/蛋白合成相关基因,从而调节PA的毒力[11]。据报道,PA多种毒力表型与QS系统调节有关,如弹性蛋白酶的分泌主要受las系统正向调节[12],绿脓素的合成受rhl、pqs系统正向调节[13-14],T3SS可受pqs系统和rhl系统负向调节[15]。为探讨PA1864基因敲除对PA QS系统的影响,采用信号分子报告平板法分别检测PAO1和△PA1864细菌培养上清中3-oxo-C12-HSL(las系统)和C4-HSL(rhl系统)信号分子的含量,结果表明,PA1864基因敲除对PA las及rhl系统无明显影响;采用HPLC检测pqs系统PQS信号分子合成情况,发现PA1864基因敲除可引起PA的pqs系统信号分子合成明显上调,与文献[11-14]报道一致。本组试验结果发现,PA1864基因敲除可引起pqs系统上调的同时,伴随T3SS的抑制和绿脓素合成的增加。因此,我们推测PA1864基因很可能是通过pqs系统影响PA毒力相关表型,从而最终影响PA的致病性,但其相关假设仍需进一步验证。
PA是医院感染的重要病原体,在一般情况下不致病,但当患者机体免疫力低下、长期应用糖皮质激素/免疫抑制剂、肿瘤放射治疗、化学治疗、手术创伤以及侵入性诊疗后[2],往往可造成致命性打击。PA在环境中具有极强的适应性,且难以清除,与其具有庞大和复杂的调节调控网络密切相关。PA毒力除受QS系统调节外,还受双组分调节系统(two-component regulatory systems,TCSs)、环二鸟苷酸(cyclic diguanylate,c-di-GMP)等多种因素及途径调节。本研究针对未知基因PA1864在PA急性感染中的毒力及致病性进行初步研究,并发现PA1864基因可能作为一种转录调节因子参与基因表达调节,但PA1864基因介导的具体调节机制以及与其他调节因素和途径的关联尚未深入,仍有待后续研究。
| [1] |
Bédard E, Prévost M, Déziel E. Pseudomonas aeruginosa in premise plumbing of large buildings[J]. Microbiologyopen, 2016, 5(6): 937-956. DOI:10.1002/mbo3.2016.5.issue-6 |
| [2] |
文细毛, 任南, 吴安华, 等. 2016年全国医院感染监测网手术后下呼吸道感染现患率调查[J]. 中国感染控制杂志, 2018, 17(8): 653-659. DOI:10.3969/j.issn.1671-9638.2018.08.001 |
| [3] |
任南, 文细毛, 吴安华. 2014年全国医院感染横断面调查报告[J]. 中国感染控制杂志, 2016, 15(2): 83-87. DOI:10.3969/j.issn.1671-9638.2016.02.003 |
| [4] |
Tognon M, Köhler T, Gdaniec BG, et al. Co-evolution with Staphylococcus aureus leads to lipopolysaccharide alterations in Pseudomonas aeruginosa[J]. ISME J, 2017, 11(10): 2233-2243. DOI:10.1038/ismej.2017.83 |
| [5] |
Jayaseelan S, Ramaswamy D, Dharmaraj S. Pyocyanin:production, applications, challenges and new insights[J]. World J Microbiol Biotechnol, 2014, 30(4): 1159-1168. DOI:10.1007/s11274-013-1552-5 |
| [6] |
Gilchrist FJ, Belcher J, Jones AM, et al. Exhaled breath hydrogen cyanide as a marker of early Pseudomonas aeruginosa infection in children with cystic fibrosis[J]. ERJ Open Res, 2015, 1(2). pii: 00044-2015. https://openres.ersjournals.com/content/erjor/1/2/00044-2015.full.pdf
|
| [7] |
Balasubramanian D, Schneper L, Kumari H, et al. A dynamic and intricate regulatory network determines Pseudomonas aeruginosa virulence[J]. Nucleic Acids Res, 2013, 41(1): 1-20. DOI:10.1093/nar/gks1039 |
| [8] |
Lee J, Zhang L. The hierarchy quorum sensing network in Pseudomonas aeruginosa[J]. Protein Cell, 2015, 6(1): 26-41. DOI:10.1007/s13238-014-0100-x |
| [9] |
Stover CK, Pham XQ, Erwin AL, et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen[J]. Nature, 2000, 406(6799): 959-964. DOI:10.1038/35023079 |
| [10] |
余华, 熊浚智, 何晓梅, 等. 采用Red重组系统敲除铜绿假单胞菌弹性蛋白酶基因[J]. 中国人兽共患病学报, 2013, 29(2): 129-137. DOI:10.3969/cjz.j.issn.1002-2694.2013.02.005 |
| [11] |
Francis VI, Stevenson EC, Porter SL. Two-component systems required for virulence in Pseudomonas aeruginosa[J]. FEMS Microbiol Lett, 2017, 364(11). DOI:10.1093/femsle/fnx104 |
| [12] |
Castillo-Juárez I, Maeda T, Mandujano-Tinoco EA, et al. Role of quorum sensing in bacterial infections[J]. World J Clin Cases, 2015, 3(7): 575-598. DOI:10.12998/wjcc.v3.i7.575 |
| [13] |
Lundgren BR, Thornton W, Dornan MH, et al. Gene PA2449 is essential for glycine metabolism and pyocyanin biosynthesis in Pseudomonas aeruginosa PAO1[J]. J Bacteriol, 2013, 195(9): 2087-2100. DOI:10.1128/JB.02205-12 |
| [14] |
Welsh MA, Eibergen NR, Moore JD, et al. Small molecule disruption of quorum sensing cross-regulation in Pseudomonas aeruginosa causes major and unexpected alterations to virulence phenotypes[J]. J Am Chem Soc, 2015, 137(4): 1510-1519. DOI:10.1021/ja5110798 |
| [15] |
孔伟娜, 梁海华, 沈立新, 等. 铜绿假单胞菌中Ⅲ型分泌系统受Rhl和PQS群体感应系统调节[J]. 微生物学报, 2009, 49(9): 1158-1164. DOI:10.3321/j.issn:0001-6209.2009.09.005 |



