2. 徐州医科大学附属医院感染管理科, 江苏 徐州 221000;
3. 徐州医科大学附属医院脑血管外科, 江苏 徐州 221000
2. Department of Healthcare-associated Infection Management, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China;
3. Department of Cerebrovascular Surgery, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China
艰难梭菌(Clostridium difficile, CD)是一种产芽孢的革兰阳性厌氧杆菌,产毒株可分泌毒素A、毒素B及二元毒素(CDT)而致病。艰难梭菌感染(Clostridium difficile infection,CDI)是由肠道致病性CD过度增殖, 释放毒素引起的以胃肠道表现为主的疾病,其临床表现可从无症状定植到暴发性、复发性和潜在致命性结肠炎[1]。有资料[2]显示,25%~30%的抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)以及几乎所有的假膜性肠炎均是由CD引起的。根据美国最新医疗保健相关感染现患率调查,CD仍是导致医院胃肠道感染的首要病原体[3]。随着抗菌药物的广泛使用,以及高毒力菌株核糖体027型的出现和流行,CD对公共卫生造成的危害日益凸显。
CDI的诊断基于临床病史、腹泻症状,以及实验室检测[4]。目前,有多种方法用于诊断CDI,包括CD产毒培养(toxigenic culture,TC)、细胞培养毒素中和试验(cell culture cytotoxicity neutralization assay,CCNA)、核酸扩增法(nucleic acid amplification-based test,NAAT)、酶免疫分析法(enzyme immunoassay,EIA)及谷氨酸脱氢酶(glutamate dehydrogenase,GDH)等,其中,其中TC和CCNA为CDI诊断的金标准,但其过程复杂,耗时长,需要特定的实验设施和专业技术人员[4],一般将其用于实验室科研及新检测方法的评估等,难以在临床上推广应用。而NAAT敏感性高,特异性强,且方便快捷,但其检测设备昂贵,对于许多普通临床实验室而言,缺乏条件将其作为CD的常规检测。EIA操作简单快捷,可同时检测艰难梭菌GDH抗原及毒素A/B,从而进行CDI体外诊断。最近,一个基于EIA的快速组合检测试剂盒——艰难梭菌谷氨酸脱氢酶抗原及毒素检测试剂盒(C.Diff Quik Chek Complete®,TECHLAB,以下简称CD快速检测试剂盒)已在各国推出,CD快速检测试剂盒将GDH抗原检测和毒素A/B检测两部分结合起来,操作简单、便捷,仅需约30 min就可获得GDH抗原和毒素结果,且被证明可有效提高CDI诊断的准确性和效率[5-6]。近年来,有关评估CD快速检测试剂盒性能的研究较多,但各文献报道的灵敏度(SEN)和特异度(SPE)及诊断参数存在差异,对CD快速检测试剂盒用于CDI诊断的Meta分析未见报道,因此,本研究旨在通过Meta分析探讨CD快速检测试剂盒对CDI的诊断价值,探讨其能否广泛应用于临床CDI诊断,为临床医务人员对CDI的诊断、治疗、防控提供循证依据。
1 资料与方法 1.1 文献的检索电子检索PubMed、Web of Science、中国知网(CNKI)、万方数据库、维普信息资源系统以及中国生物医学文献服务系统(SinoMed)中建库至2018年11月30日发表的有关艰难梭菌谷氨酸脱氢酶抗原及毒素检测试剂盒(酶联免疫层析法)性能评估的文章,英文检索词为:Clostridium difficile;enzyme immunoassay/enzyme immunoassays;Quik Chek Complete。中文检索词为:艰难梭菌/难辨梭状芽胞杆菌、酶免疫法、检测试剂盒。通过Endnote软件进行文献管理与查重,通过人工检索确定符合入选标准的文献。
1.2 文献筛选与资料提取 1.2.1 纳入标准与排除标准按照Cochrane协作网筛选与诊断试验方法中关于诊断性试验研究的纳入和排除标准筛选文献。
1.2.1.1 纳入标准(1) 研究设计:前瞻性研究;(2)研究对象:存在腹泻、怀疑CDI的住院或门诊患者粪便标本;(3)金标准:以TC或CCNA为金标准;(4)能直接获得或间接计算出GDH和毒素检测的真阳性(TP)、假阳性(FP)、假阴性(FN)、真阴性(TN);(5)中文或英文文献。
1.2.1.2 排除标准(1) 以TC和CCNA以外的方法为检测金标准;(2)存在研究设计缺陷;(3)综述、会议文摘、个案、动物实验等基础性研究;(4)主要针对高毒力株检测;(5)统计方法错误且无法修正,无法获取TP、FP、FN、TN者,原始数据不全或者数据重复发表。
1.2.2 文献的筛选由两位研究员独立严格按照纳入与排除标准对检出文献进行筛选,先阅读题目和摘要,摘要信息不全则阅读全文,对有分歧而难以确定是否纳入的文献,通过讨论或由第三研究员决定是否纳入。
1.2.3 资料提取提取数据主要包括研究作者、发表时间、标本含量、CD感染率、GDH及毒素部分的TP、FP、FN、TN、SEN、SPE及其95%可信区间(CI)等,缺乏的资料与作者联系予以补充。
1.3 文献的质量评价由两位研究员独立根据诊断准确性研究的质量评价方法2(QUADAS-2)清单进行质量评估,包括4个部分(病例选择、待评价试验、金标准、病例流程和进展情况)和2个方面(偏倚风险和临床适用性)。根据每部分中相关标志性问题的回答“是”、“否”或“不确定”,对应将偏倚风险等级判定为“低”、“高”或“不确定”[7-8]。
1.4 统计学分析应用Meta DiSc 1.4软件,录入试剂盒GDH抗原及毒素检测诊断CDI的TP、FP、FN、TN、标本含量、CD感染率等数据。采用Reiview Manager 5.3软件进行文献的质量评价。
1.4.1 异质性分析第一,有无阈值效应;第二,其他异质性。采用Cochran-Q检验进行分析,检验水准设P < 0.1,用I2评估异质性大小。
1.4.2 合并效应量计算纳入文献合并的SEN、SPE、阳性似然比(PLR)、阴性似然比(NLR)、诊断优势比(DOR),并绘制森林图。
1.4.3 汇总受试者工作特征曲线(SROC)绘制SROC,并计算曲线下面积(AUC)。
1.4.4 异质性来源分析以每次减少1篇文献的方法进行敏感性分析,计算合并的SEN、SPE、PLR、NLR及DOR,评估单个研究对本Meta分析的影响。对不同发表年份、样本量、CD感染率的文献进行Meta回归分析,计算相关系数和相对诊断优势比(RDOR),并对诊断效能有显著性影响的因素进行亚组分析。
2 结果 2.1 纳入文献基本情况文献检索流程见图 1,共纳入文献8篇[9-16],均为英文,发表时间为2011—2018年,所纳入研究均为前瞻性研究或者包含前瞻性研究,选取前瞻性研究的结果,共纳入2 852例研究对象。纳入研究的基本特征及提取数据见表 1。
 |
| 图 1 CD快速检测试剂盒用于CDI诊断的Meta文献检索流程图 Figure 1 Flow chart of literature retrieval for Meta-analysis on CDI diagnozed with C. Diff Quik Chek Complete® |
| 表 1 CD快速检测试剂盒用于CDI诊断的Meta分析纳入文献的基本情况 Table 1 Basic information of included literatures for Meta-analysis on CDI diagnozed with C. Diff Quik Chek Complete® |

|
应用QUADAS-2工具对每项研究的质量进行评价,见图 2。
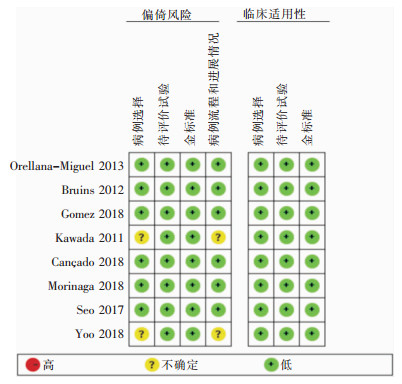 |
| 图 2 应用QUADAS-2对纳入文献进行质量评价 Figure 2 QUADAS-2 used for quality evaluation of the included literatures |
SROC平面散点图不是典型的“肩臂形”外观,同时Spearman相关系数为-0.310,P为0.456,提示不存在阈值效应。对其他来源的异质性进行检验,结果NLR不存在显著异质性(P>0.1),I2为24.3%,采用固定效应模型进行分析计算;SEN、SPE、PLR、DOR等均存在异质性(P < 0.1),I2分别为49.2%、58.8%、68.8%、49.0%,采用随机效应模型进行分析计算。
2.3.2 毒素检测SROC平面散点图不是典型的“肩臂形”外观,同时Spearman相关系数为0.429,P为0.289,提示不存在阈值效应。异质性检验结果显示,SEN、SPE、PLR、NLR、DOR的I2分别为70.9%、78.9%、70.5%、81.4%、67.2%, 均存在异质性(P < 0.1),采用随机效应模型进行分析计算。
2.4 合并效应量 2.4.1 GDH抗原检测的诊断结果合并的SEN、SPE、PLR、NLR、DOR值及其95%CI分别为0.96(0.94, 0.98),0.96(0.95, 0.97),20.07(13.47, 29.92),0.04(0.03, 0.07),409.35(168.01, 997.39)。见图 3。
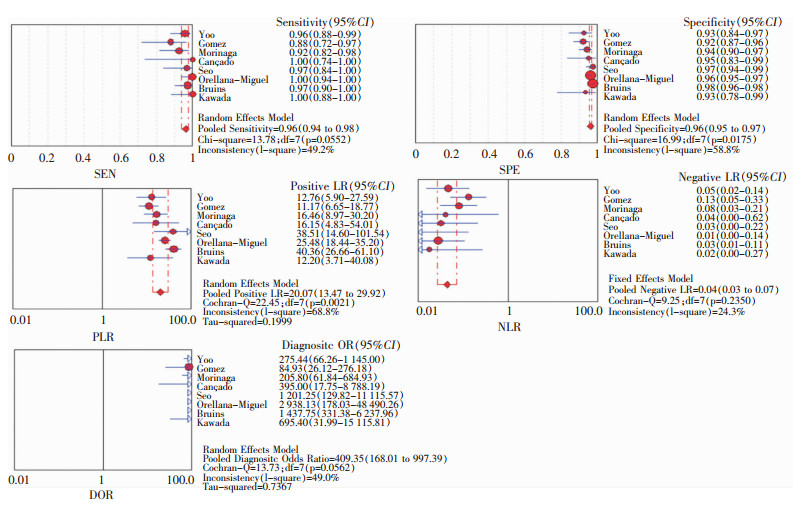 |
| 图 3 GDH抗原检测诊断CDI的SEN、SPE、PLR、NLR、DOR森林图 Figure 3 Forest plots of SEN, SPE, PLR, NLR, and DOR detection for diagnosis of CDI by GDH antigen |
合并的SEN、SPE、PLR、NLR、DOR值及其95%CI分别为0.54(0.48, 0.59),1.00(0.99, 1.00),64.23(18.90, 218.33),0.48(0.37, 0.62),142.74(40.94, 497.61)。见图 4。
 |
| 图 4 毒素检测诊断CDI的SEN、SPE、PLR、NLR、DOR森林图 Figure 4 Forest plots of SEN, SPE, PLR, NLR, and DOR of diagnosis of CDI through toxin detection |
GDH抗原、毒素检测诊断CDI的AUC分别为0.9877、0.9718,Q*指数分别为0.9529、0.9228。见图 5。
 |
| A: GDH抗原检测; B:毒素检测 图 5 GDH抗原、毒素检测诊断CDI的合并SROC图 Figure 5 Chart of combined SROC of diagnosis of CDI through GDH antigen and toxin detection |
以每次减少1篇文献的方法进行敏感性分析,计算其余文献合并的SEN、SPE、PLR、NLR及DOR,见表 2。结果显示,剔除Gomez[10],GDH抗原检测诊断CDI的DOR明显上升;毒素检测诊断CDI的SEN、PLR、DOR均上升,NLR下降,提示此研究对Meta分析的异质性影响很大。排除该文献后,分别对SEN、SPE、PLR、NLR、DOR指标进行异质性分析,结果显示,GDH检测部分SEN、SPE、NLR及DOR均不存在显著异质性(P>0.1),其I2分别为34.8%、41.2%、0、15%,PLR存在异质性(P < 0.1), 其I2为59.7%;毒素检测部分SEN、NLR不存在显著异质性(P>0.1),其I2分别为25.6%和0,SPE、PLR及DOR存在异质性(P < 0.1),其I2分别为80.9%、73.7%、67.4%,GDH部分异质性明显下降,提示分析结果可能会受该研究影响。
| 表 2 CD快速检测试剂盒诊断CDI的Meta分析结果(敏感性分析) Table 2 Meta-analysis results of C. Diff Quik Chek Complete® for diagnosis of CDI (sensitivity analysis) |
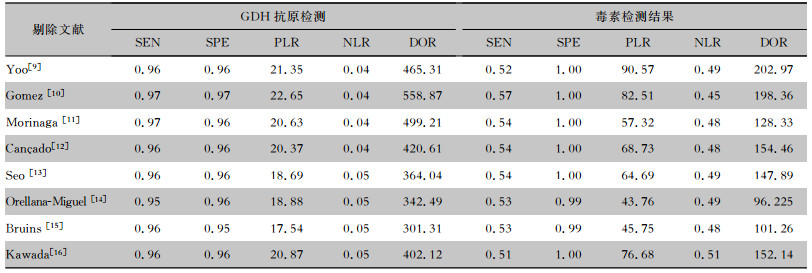
|
对发表年份(2017年及以前,2017年以后)、样本量(≥356例,< 356例)、CD感染率(≥25%,< 25%)各组进行Meta回归分析,结果显示样本数量、发表年限、感染率均不是异质性的来源。见表 3。
| 表 3 Meta回归分析各指标对诊断效能的影响 Table 3 Effect of Meta-regression analysis indicators on diagnostic efficacy |

|
根据美国疾病控制与预防中心的数据,CD(12.10%)已经超过金黄色葡萄球菌(10.7%)成为医源性感染中最常见的病原体[17],2014年美国预计共有606 058例(439 237例初发和166 821例复发)CDI,44 500例患者因CDI导致死亡,CDI的医疗经济成本高达54亿美元[18]。美国和英国医院住院患者CDI发生率分别为115.1/100 000和19.3/100 000住院患者[19]。我国国内大部分实验室及医院缺乏厌氧培养条件,检测手段相对局限,大部分医院尚未开展CD的常规检测,迄今为止,我国尚无系统的CDI流行病学数据。一项荟萃分析显示,我国住院腹泻患者CD感染率为19%[20],上海某医院住院患者中CDI的发病率为17.1/万例住院患者[21],四川某医院ICU内CDI的发生率高达25.2/万住院日[22],可见我国医院的CDI处于一个较高的发病水平,快速而准确地诊断CDI对于我国患者治疗和医院感染控制至关重要。本研究旨在通过Meta分析探讨CD快速检测试剂盒对CDI的诊断价值。
本研究纳入的8篇研究间存在异质性。经SROC曲线平面图和Spearman相关系数检验可知,纳入研究文献间不存在阈值效应,非阈值效应为此研究异质性的主要来源。笔者还进一步做了敏感性分析及Meta回归分析,探寻其异质性的可能来源。敏感性分析提示Gomez等[10]的研究对本Meta分析的异质性影响很大。排除该文献后,GDH抗原检测诊断CDI的异质性下降,提示分析结果可能会受该研究影响。Gomez的研究对象为一所儿童医院1~18岁的患者,而其他7个研究的研究对象均为综合医院的患者,所以年龄可能是异质性的来源,但因其他研究并未对年龄进行分析,所以无法对年龄这一影响因素进行亚组分析。有报道指出,核糖体027型菌株对GDH抗原及毒素EIA更敏感[23],Gomez研究中核糖体027型菌株占9.6%,但其他7个研究均未详细报道菌株核糖体分型结果,本次研究无法进行分析。Meta回归分析结果显示,样本数量、发表年限、感染率均不是异质性的来源,所以未进行亚组分析。
纳入研究的8个研究中,CD快速检验试剂盒GDH抗原检测诊断CDI合并的SEN、SPE均为0.96,可见该试剂盒GDH抗原诊断结果具有较高的SEN和SPE。PLR、NLR结合了SEN、SPE、阳性预测值和阴性预测值的优点,不受被检人群中疾病发生率的影响,因此是一个相对独立的,更具临床意义、诊断性试验效果的评估指标。在诊断性试验中,当PLR>10或NLR < 0.1时,诊断或排除某种疾病的可能性就显著增加。本研究GDH抗原检测合并的PLR为20.07(>10),NLR为0.04(< 0.1),说明CD快速检验试剂盒抗原部分结果诊断或排除CDI的可能性较大;GDH抗原检测DOR值为409.35,说明该诊断试验抗原部分的判别效果较好;AUCSROC为0.9877和Q*指数为0.9529,同样说明该CD快速检测试剂盒GDH抗原检测诊断效力较高。GDH抗原检测诊断CD Meta分析结果显示,合并的SEN、SPE、DOR、PLR、NLR、AUCSROC分别为0.911、0.912、115、10.4、0.098、0.970[24],本研究抗原部分检测结果与其基本一致。本Meta分析CD快速检验试剂盒毒素检测诊断CDI合并的SEN、SPE、PLR、NLR和DOR分别为0.54、1.00、64.23、0.48和142.74,AUCSROC为0.9718和Q*指数为0.9228,毒素检测诊断的特异度较高,错误诊断CDI的概率较小;而灵敏度欠佳,说明该试剂盒对CDI的漏诊率较高。
本Meta分析的局限性:(1)检索的文献不全面,局限在已发表的研究,未进行灰色文献的检索,如未获取会议论文等未公开发表的研究,文献语种局限于中文和英文,未对其他语种相关文献进行筛选。(2)纳入研究数目较少,根据Cochrane系统评价干预手册[25],仅当Meta分析纳入至少10个研究时方可使用漏斗图不对称检验,若纳入研究过少,检验效能将过低,将无法区别机遇和真正的不对称,所以未进行发表偏倚检验。纳入研究数目少导致各影响因素的稳定性差,虽进行了Meta回归分析,并未找到对结果影响较大的原因。
通过Meta分析探讨CD快速检测试剂盒对CDI的诊断价值,发现CD快速检测试剂盒GDH抗原检测部分SEN、SPE、PLR、NLR及DOR均较高,毒素检测部分虽SEN欠佳,但SPE较高,且检测周期短,操作简便,可作为缺乏专业设备条件的地区及医院门、急诊CDI的初筛试剂盒。对于抗原阳性、毒素阴性的粪便标本,建议有条件的实验室进一步进行厌氧产毒培养,以提高产毒艰难梭菌的检出率,为CDI的防控提供循证依据。
| [1] |
Bartlett JG. Clinical practice. Antibiotic-associated diarrhea[J]. N Engl J Med, 2002, 346(5): 334-339. DOI:10.1056/NEJMcp011603 |
| [2] |
Barbut F, Petit JC. Epidemiology of cochrane handbook for systematic reviews of interventions:cochrane book series-associated infections[J]. Clin Microbiol Infect, 2001, 7(8): 405-410. DOI:10.1046/j.1198-743x.2001.00289.x |
| [3] |
Magill SS, O'Leary E, Janelle SJ, et al. Changes in prevalence of health care-associated infections in U.S. Hospitals[J]. N Engl J Med, 2018, 379(18): 1732-1744. DOI:10.1056/NEJMoa1801550 |
| [4] |
Lukas F, Widmer AF, Gisela G, et al. Rapid and reliable diagnostic algorithm for detection of Clostridium difficile[J]. N Engl J Med, 2008, 46(1): 328. |
| [5] |
Sharp SE, Ruden LO, Pohl JC, et al. Evaluation of the C.Diff Quik Chek Complete Assay, a new glutamate dehydrogenase and A/B toxin combination lateral flow assay for use in rapid, simple diagnosis of Clostridium difficile disease[J]. J Clin Microbiol, 2010, 48(6): 2082-2086. DOI:10.1128/JCM.00129-10 |
| [6] |
Quinn CD, Sefers SE, Babiker W, et al. C. Diff Quik Chek complete enzyme immunoassay provides a reliable first-line method for detection of Clostridium difficile in stool specimens[J]. J Clin Microbiol, 2010, 48(2): 603-605. DOI:10.1128/JCM.01614-09 |
| [7] |
邬兰, 张永, 曾宪涛. QUADAS-2在诊断准确性研究的质量评价工具中的应用[J]. 湖北医药学院学报, 2013, 23(3): 201-208. |
| [8] |
Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8): 529-536. DOI:10.7326/0003-4819-155-8-201110180-00009 |
| [9] |
Yoo IY, Song DJ, Huh HJ, et al. Simultaneous detection of clostridioides difficile glutamate dehydrogenase and toxin A/B:Comparison of the C. Diff Quik Chek Complete and Ridascreen assays[J]. Ann Lab Med, 2019, 39(2): 214-217. DOI:10.3343/alm.2019.39.2.214 |
| [10] |
Gomez EJ, Montgomery S, Alby K, et al. Poor yield of Clostridium difficile testing algorithms using glutamate dehydrogenase antigen and C. difficile toxin enzyme immunoassays in a pediatric population with declining prevalence of Clostri-dium difficile strain BI/NAP1/027[J]. Diagn Microbiol Infect Dis, 2018, 91(3): 229-232. DOI:10.1016/j.diagmicrobio.2018.02.016 |
| [11] |
Morinaga Y, Akamatsu N, Matsuda J, et al. Diagnostic utilities of a fully automated molecular test for toxigenic Clostridium difficile[J]. J Infect Chemother, 2018, 24(2): 88-91. DOI:10.1016/j.jiac.2017.09.003 |
| [12] |
Cançado GGL, Silva ROS, Nader AP, et al. Impact of simultaneous glutamate dehydrogenase and toxin A/B rapid immunoassay on Clostridium difficile diagnosis and treatment in hospitalized patients with antibiotic-associated diarrhea in a university hospital of Brazil[J]. J Gastroenterol Hepatol, 2018, 33(2): 393-396. DOI:10.1111/jgh.2018.33.issue-2 |
| [13] |
Seo JY, Jeong JH, Kim KH, et al. Laboratory diagnosis of Clostridium difficile infection:Comparison of Techlab C. Diff Quik Chek Complete, Xpert C. difficile, and multistep algorithmic approach[J]. J Clin Lab Anal, 2017, 31(6): e22135. DOI:10.1002/jcla.2017.31.issue-6 |
| [14] |
Orellana-Miguel MA, Alcolea-Medina A, Barrado-Blanco L, et al. Algorithm proposal based on the C. Diff Quik Chek Complete ICT device for detecting Clostridium difficile infection[J]. Enferm Infecc Microbiol Clin, 2013, 31(2): 97-99. DOI:10.1016/j.eimc.2012.01.003 |
| [15] |
Bruins MJ, Verbeek E, Wallinga JA, et al. Evaluation of three enzyme immunoassays and a loop-mediated isothermal amplification test for the laboratory diagnosis of Clostridium difficile infection[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(11): 3035-3039. DOI:10.1007/s10096-012-1658-y |
| [16] |
Kawada M, Annaka M, Kato H, et al. Evaluation of a simultaneous detection kit for the glutamate dehydrogenase antigen and toxin A/B in feces for diagnosis of Clostridium difficile infection[J]. J Infect Chemother, 2011, 17(6): 807-811. DOI:10.1007/s10156-011-0267-5 |
| [17] |
Magill SS, Edwards JR, Bamberg W, et al. Multistate point-prevalence survey of health care-associated infections[J]. N Engl J Med, 2014, 370(13): 1198-1208. DOI:10.1056/NEJMoa1306801 |
| [18] |
Desai K, Gupta SB, Dubberke ER, et al. Epidemiological and economic burden of Clostridium difficile in the United States:estimates from a modeling approach[J]. BMC Infect Dis, 2016, 16: 303. DOI:10.1186/s12879-016-1610-3 |
| [19] |
King A, Mullish BH, Hrt W, et al. Comparative epidemiology of Clostridium difficile infection:England and the USA[J]. Int J Qual Health Care, 2017, 29(6): 1-7. DOI:10.1093/intqhc/mzx126 |
| [20] |
谢和宾, 曾鸿, 尹柯, 等. 我国住院腹泻患者艰难梭菌感染率的荟萃分析[J]. 中华医院感染学杂志, 2017, 27(5): 961-964. |
| [21] |
Huang H, Fang H, Weintraub A, et al. Distinct ribotypes and rates of antimicrobial drug resistance in Clostridium difficile from Shanghai and Stockholm[J]. Clin Microbiol Infect, 2009, 15(12): 1170-1173. DOI:10.1111/j.1469-0691.2009.02992.x |
| [22] |
Wang X, Cai L, Yu R, et al. ICU-onset Clostridium difficile infection in a university hospital in China:a prospective cohort study[J]. PloS One, 2014, 9(11): e111735. DOI:10.1371/journal.pone.0111735 |
| [23] |
Tenover FC, Novak-Weekley S, Woods CW, et al. Impact of strain type on detection of toxigenic Clostridium difficile:comparison of molecular diagnostic and enzyme immunoassay approaches[J]. J Clin Microbiol, 2010, 48(10): 3719-3724. DOI:10.1128/JCM.00427-10 |
| [24] |
Arimoto J, Horita N, Kato S, et al. Diagnostic test accuracy of glutamate dehydrogenase for Clostridium difficile:Systematic review and meta-analysis[J]. Sci Rep, 2016, 6: 29754. DOI:10.1038/srep29754 |
| [25] |
Sterne JAC, Egger M, Moher D. Addressing reporting biases[M]//Higgins JPT, Green S. Cochrane handbook for syste-matic reviews of intervention, Version 5.1.0, The Cochrane Collaboration, 2011.
|



