2. 遵义医科大学检验医学院, 贵州 遵义 563000
2. School of Laboratory Medicine, Zunyi Medical University, Zunyi 563000, China
由于各种抗菌药物的不断更新换代,免疫抑制剂的不断应用,以及支持治疗手段的不断进步,临床真菌感染的患病率和致死率均较前明显上升[1]。当前,临床常见真菌主要以酵母型真菌和丝状真菌感染所致危害最大,并且逐渐成为医院感染的重要类型之一。临床上对真菌的检测主要有直接涂片法、真菌培养法以及病理学组织检查等传统方法,而针对真菌的早期诊断则多以检测速度和准确性更好的G实验、GM实验以及PCR等方法为主。
基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)是近年发展起来的一种简便、快速、准确、经济的病原微生物鉴定方法[2],其初期主要用于临床细菌的鉴定。近年来,有学者将其应用到临床病原真菌的鉴定领域。目前,临床上主要以法国bioMérieux公司生产的Vitek MS,以及德国Bruker公司生产的Biotyper的应用最为广泛。MALDI-TOF MS技术在细菌鉴定方面已经得到广泛应用,但其在真菌鉴定能力方面的相关报道仍然较少[3-4]。因此,本研究拟针对不同MALDI-TOF MS分析系统对临床常见真菌鉴定的准确性方面进行Meta分析,为临床真菌感染的诊断及治疗提供依据。
1 对象与方法 1.1 纳入标准(1) 研究类型:可提供MALDI-TOF MS技术检测真菌的真阳性(true positive, TP)、假阳性(false positive, FP)、假阴性(false negative, FN)、真阴性(true negative, TN)的文献;(2)研究对象:临床血液、体液培养标本中分离的真菌菌株,或真菌标准菌株;(3)诊断实验方法:待检测技术为MALDI-TOF MS,以常规检测方法或分子生物学方法为金标准;(4)结局指标:合并灵敏度(sensitivity, Sen)、特异度(specificity, Spe)、阳性似然比(positive likelihood ratio, +LR)、阴性似然比(negative likelihood ratio, -LR)、诊断比值比(diagnostic odds ratio, DOR)和汇总受试者工作特征(summary receiver operating characteristic, SROC)曲线下面积(area under curve, AUC)。
1.2 排除标准(1) 重复文献,与MALDI-TOF MS检测真菌准确性不相关文献;(2)无详细数据的会议摘要、综述和专利等。
1.3 检索策略计算机检索PubMed、Embase、Cochrane Library、中国知网(CNKI)、中国生物医学文献数据库(CBM)、维普中文科技期刊数据库(简称维普)、万方数据库,查找MALDI-TOF MS与传统方法或分子生物学方法比较检测真菌准确性的文献,检索时限均为建库至2018年6月30日。采用自由词与主题词相结合的方式进行检索。中文检索词包括:基质辅助激光解析电离飞行时间质谱、基质辅助激光解吸电离飞行时间质谱、真菌、酵母菌属、丝状真菌属、隐球菌属、鉴定。英文检索词包括:MALDI-TOF MS、MALDI-TOF、fungus、yeasts、filamentous fungi、identification。
1.4 文献筛选和资料提取 1.4.1 研究的选择与资料提取由2名研究人员根据纳入、排除标准独立进行文献筛选,并对最终纳入文献的数据进行提取,如有不一致则交由第三方解决。提取的内容包括:第一作者、发表年限、菌株株数、菌株类别、检测仪器、数据库、菌种来源、TP、FP、FN、TN等相关信息。
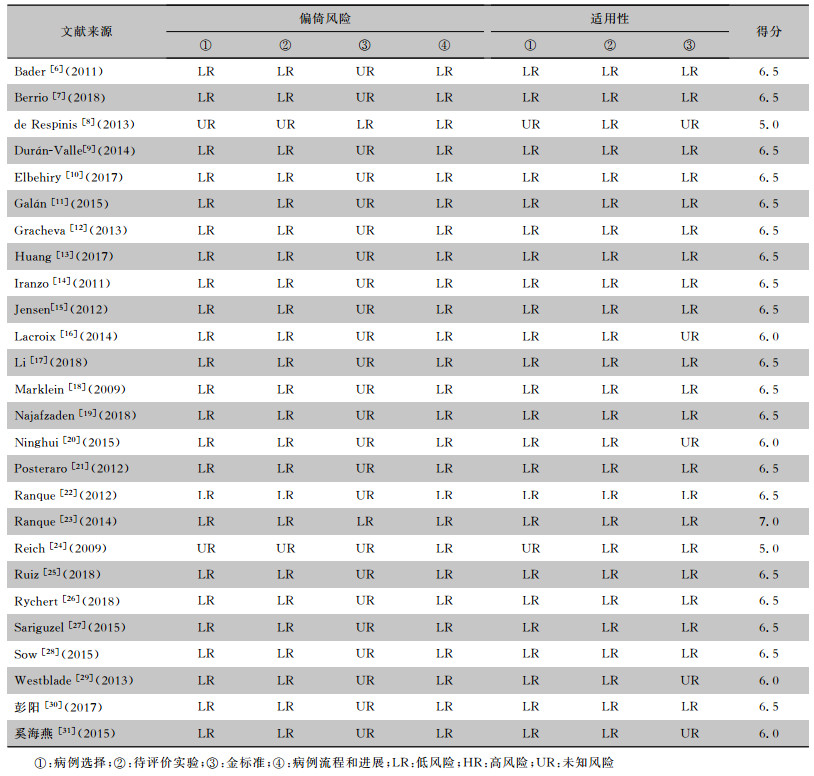
1.4.2 文献质量评价文献质量采用QUADAS-2工具进行评价[5]。QUADAS-2工具包括偏倚评价和临床适用性两部分。偏倚评价包括病例选择、待评价试验、金标准、病例流程和进展情况四个部分,临床适用性则只包括前三个部分。所有领域的评价分为高风险、低风险、不清楚,并以高风险得0分、低风险得1分、不清楚得0.5分计算出每篇文献的得分。质量评价由两名研究人员独立完成,如遇分歧则寻求第三方帮助。
1.5 统计分析首先绘制受试者工作特征(ROC)平面图,判断是否为“肩膀状”分布,并且计算Spearman相关系数,以分析有无阈值效应。若无阈值效应,则计算合并Sen、Spe、+LR、-LR。采用Q检验分析各研究间是否存在异质性,以I2估算分析异质性大小。当各研究结果间存在异质性时,采用随机效应模型进行Meta分析,并采用亚组分析探讨异质性来源;当各研究结果间不存在异质性时,则采用固定效应模型进行Meta分析。采用Meta-Disc 1.4软件计算合并的Sen、Spe、+LR、-LR以及DOR,绘制SROC曲线、AUC。Meta分析的检验水准为α=0.05。
2 结果 2.1 文献检索纳入和筛选流程初步检索到文献1 222篇,其中CNKI 120篇、维普97篇、万方数据库58篇、CBM 281篇、PubMed 321篇、Embase 345篇,最终纳入符合标准的文献26篇[6-31]。文献筛选流程及结果见图 1。
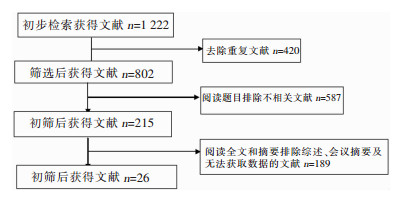 |
| 图 1 MALDI-TOF MS鉴定常见真菌准确性Meta分析纳入文献筛选流程图 Figure 1 Flow chart of literature screening for Meta-analysis on accuracy of MALDI-TOF MS in identifying common fungi |
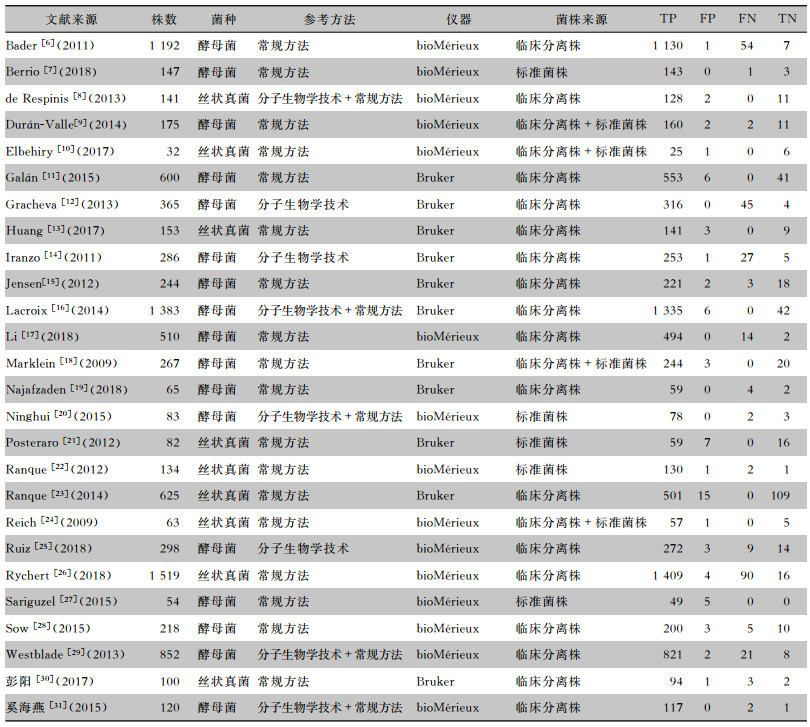
26篇文献的基本特征见表 1。研究共包括9 708株真菌,其中酵母菌属6 859株,丝状真菌属2 849株;18篇文献[6-7, 9-11, 13, 15, 17-19, 21-24, 26-28, 30]采用常规方法作为参考方法,3篇文献[12, 14, 25]采用分子生物学技术作为参考方法,5篇文献[8, 16, 20, 29, 31]采用分子生物学技术和常规方法作为参考方法,所有文献均可获取MALDI-TOF MS鉴定真菌的TP、FP、FN、TN。
| 表 1 MALDI-TOF MS鉴定常见真菌准确性Meta分析纳入文献的基本特征 Table 1 Basic features of included literatures for Meta-analysis on accuracy of MALDI-TOF MS in identifying common fungi |
|
26篇文献评分介于5.0~7.0分,中位数为6.5分,均为较高质量文献。见表 2。
| 表 2 MALDI-TOF MS鉴定常见真菌准确性Meta分析纳入文献的偏倚风险评价 Table 2 Bias risk assessment on included literatures for Meta-analysis on accuracy of MALDI-TOF MS in identifying common fungi |
|
ROC平面图不呈“肩臂状”分布,Spearman相关性分析显示相关系数为-0.013,P=0.949,提示不存在阈值效应。见图 2。异质性检验结果提示存在明显异质性,采用随机效应模型进行Meta分析,结果显示,MALDI-TOF MS鉴定真菌准确性的Sen合并=0.97[95%CI(0.97~0.97)]、Spe合并=0.85[95%CI(0.81-0.88)]、+LR合并=5.60[95%CI(4.55~6.90)]、-LR合并=0.02[95%CI(0.01~0.04)]、DOR=282.40[95%CI(149.50~533.46)]。见图 3、4。
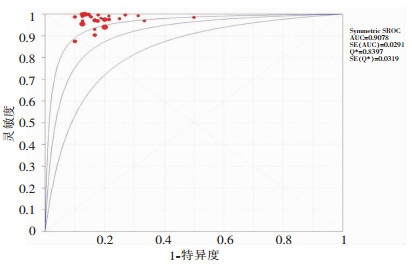 |
| 图 2 MALDI-TOF MS鉴定真菌准确性的SROC曲线 Figure 2 SROC curve of the accuracy of MALDI-TOF MS for fungal identification |
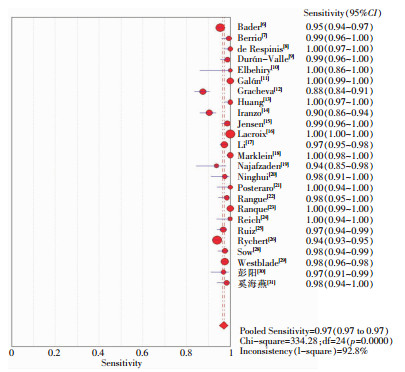 |
| 图 3 MALDI-TOF MS鉴定真菌灵敏度的Meta分析 Figure 3 Meta-analysis on sensitivity of MALDI-TOF MS for fungal identification |
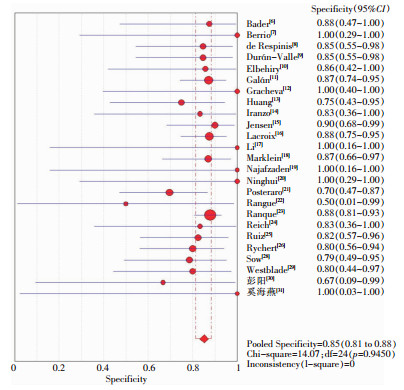 |
| 图 4 MALDI-TOF MS鉴定真菌特异度的Meta分析 Figure 4 Meta-analysis on specificity of MALDI-TOF MS for fungal identification |
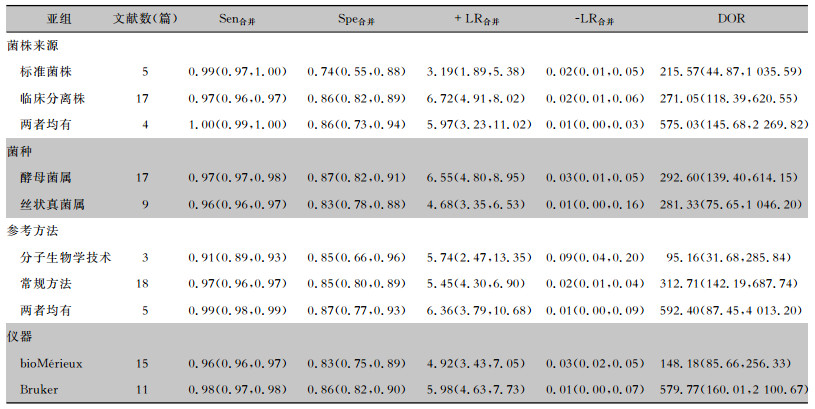
(1) 菌株来源:纳入的26篇文献中,有5篇[7, 20-22, 27]研究菌株来源于标准菌株,Meta分析结果显示,Sen合并=0.99[95%CI(0.97~1.00)],Spe合并=0.74[95%CI(0.55~0.88)];17篇[6, 8, 11-17, 19, 23, 25-26, 28-31]研究菌株来源于临床分离株,Meta分析结果显示,Sen合并=0.97[95%CI(0.96~0.97)],Spe合并=0.86[95%CI(0.82~0.89)];4篇[9-10, 18, 24]研究菌株两种来源均有,Meta分析结果显示,Sen合并=1.00[95%CI(0.99~1.00)],Spe合并=0.86[95%CI(0.73~0.94)];两种单一菌种来源的文献DOR值相当,而同时满足两种菌株来源的文献,其DOR高于单个菌株来源的文献。(2)菌种:有17篇文献[6-7, 9, 11-12, 14-20, 25, 27-29, 31]研究的对象是酵母菌属,Meta分析的结果显示,Sen合并=0.97[95%CI(0.97~0.98)],Spe合并=0.87[95%CI(0.82~0.91)];9篇文献[8, 10, 13, 21-24, 26, 30]研究的对象是丝状真菌属,Meta分析结果显示,Sen合并=0.96[95%CI(0.96~0.97)],Spe合并=0.83[95%CI(0.78~0.88)];两种不同菌种文献的DOR值相当。(3)参考方法:3篇文献[12, 14, 25]仅采用分子生物学方法作为参考,Meta分析结果显示,Sen合并=0.91[95%CI(0.89~0.93)],Spe合并=0.85[95%CI(0.66~0.96)];18篇文献[6-7, 9-11, 13, 15, 17-19, 21-24, 26-28, 30]仅采用常规方法作为参考,Meta分析结果显示,Sen合并=0.97[95%CI(0.96~0.97)],Spe合并=0.85[95%CI(0.80~0.89)];5篇文献[8, 16, 20, 29, 31]采用两种方法作为参考,Meta分析结果显示,Sen合并=0.99[95%CI(0.98~0.99)],Spe合并=0.87[95%CI(0.77~0.93)];仅采用分子生物学方法研究的DOR值低于常规方法和同时采用两种方法研究的DOR值。(4)仪器:15篇文献[6-10, 17, 20, 22, 24-29, 31]采用bioMérieux,Meta分析结果显示,Sen合并=0.96[95%CI(0.96~0.97)],Spe合并=0.83[95%CI(0.75~0.89)];11篇文献[11-16, 18-19, 21, 23, 30]采用Bruker,Meta分析结果显示,Sen合并=0.98[95%CI(0.97~0.98)],Spe合并=0.86[95%CI(0.82~0.90)],Bruker检测真菌准确性DOR值高于bioMérieux。见表 3。
| 表 3 MALDI-TOF MS鉴定真菌准确性的亚组分析 Table 3 Subgroup analysis on accuracy of MALDI-TOF MS for fungal identification |
|
MALDI-TOF MS是近年来广泛应用于临床微生物实验室病原菌鉴定的一项技术,在病原菌分型、耐药检测、毒力因子鉴定等方面发挥着重要作用[32-36]。该技术在细菌鉴定中的应用比较成熟,但在真菌鉴定尤其是丝状真菌鉴定中的应用缺少临床实践和经验积累[37]。本研究纳入文献26篇,9 708株真菌, 基本涵盖了临床常见真菌,其中酵母菌属占70.7%,丝状真菌属占29.3%。ROC曲线将Sen与Spe以图示方法结合在一起,可准确反映某分析方法Sen和Spe的关系,是试验准确性的综合代表。本研究ROC曲线显示,MALDI-TOF MS的AUC为0.9078,Q*统计量为0.8397,说明MALDI-TOF MS鉴定临床常见真菌具有较高的准确性。此外,似然比(likelihood ratio, LR)检验是反映真实性的一种指标,该指标全面反映筛检试验的诊断价值。本研究得出的+LR合并为5.60,-LR合并为0.02,提示阳性结果及阴性结果均有较高的准确性。
鉴于本研究中ROC平面图不呈典型的“肩臂状”分布,提示本文纳入的文献间可能存在异质性。经Spearman相关系数检验,该异质性与阈值效应无关,因此,本研究进一步采用随机效应模型进行Meta分析,结果显示,MALDI-TOF MS在真菌鉴定上具有极高的Sen合并(0.97)及Spe合并(0.85),说明MALDI-TOF MS对真菌感染有较低的漏诊率和误诊率。亚组分析结果显示:(1)MALDI-TOF MS技术对真菌临床菌株组、标准菌株组、临床菌株+标准菌株组鉴定的Sen及Spe相近;其对两种菌株组鉴定的DOR值高于单个菌株来源组,但组间比较差异无统计学意义(P>0.05)。(2)MALDI-TOF MS技术对临床常见酵母菌属及丝状真菌属鉴定的Sen、Spe及DOR值相当。(3)Bruker品牌MALDI-TOF MS仪器对临床常见真菌鉴定的Sen、Spe及DOR值均高于bioMérieux品牌,但组间比较差异无统计学意义(P>0.05)。以上结果提示MALDI-TOF MS技术对临床酵母菌属及丝状真菌属的鉴定,不受菌株来源、仪器品牌等因素影响,均具有很好地鉴定效果。但在MALDI-TOF MS技术与不同的参考方法比较中,分子生物学组的Sen最低[Sen合并=0.91,95%CI(0.89~0.93)],且该组的DOR值较常规方法组和同时采用两种方法组均偏低,组间比较差异具有统计学意义(P<0.01)。可能与前者仅纳入3篇文献,在一定程度上造成了DOR值偏倚所致。本Meta回归结果提示,参考方法的不同可能是导致临床常见真菌鉴定结果存在异质性的重要原因。
尽管MALDI-TOF MS技术在临床真菌鉴定方面得到了长足发展,但其仍存在以下不足:临床常见病原真菌的参考质谱数据库尚不够完善;检测前标本的预处理及蛋白提取尚未能建立标准化程序;在不同的培养基、培养温度及培养时间,真菌蛋白表达差异可能会影响鉴定结果[38]。此外,少数临床真菌因缺乏特异性峰值或峰数目不足,从而导致其产生的谱值过低而不能鉴定[39],以及MALDI-TOF MS技术对真菌耐药性检测方法尚未取得突破性进展等,均是影响MALDI-TOF MS技术在临床广泛应用的主要原因。
此外,本Meta分析尚存在以下局限性:(1)由于临床感染真菌多达400余种,因此存在检索文献不全的情况,而且检索范围多局限在已经发表的英文及中文文献,对于未公开发表的研究可能造成漏检。(2)MALDI-TOF MS技术在真菌耐药性检测的诊断性试验中,由于多数研究未报告是否采用盲法检测,因此存在测量偏倚的可能性。(3)对部分少见、罕见的临床真菌感染病例未能纳入。可能会人为的提高MALDI-TOF MS对临床常见真菌鉴定的准确性。
综上所述,MALDI-TOF MS对临床常见真菌鉴定具有较高的准确性。随着MALDI-TOF MS鉴定数据库的不断完善、软件功能的不断更新、影响因素的不断明确,以及对耐药菌株检测能力的不断增强,MALDI-TOF MS技术将为临床真菌的鉴定提供更为方便、快捷、准确的实验结果。
| [1] |
Bal AM, McGill M. Rapid species identification of Candida directly from blood culture broths by Sepsityper-MALDI-TOF mass spectrometry: impact on antifungal therapy[J]. J R Coll Physicians Edinb, 2018, 48(2): 114-119. DOI:10.4997/JRCPE |
| [2] |
Mellmann A, Cloud J, Maier T, et al. Evaluation of matrix-assisted laser desorption ionization-time-of-flight mass spectrometry in comparison to 16S rRNA gene sequencing for species identification of nonfermenting bacteria[J]. J Clin Microbiol, 2008, 46(6): 1946-1954. DOI:10.1128/JCM.00157-08 |
| [3] |
Rychert J, Burnham CA, Bythrow M, et al. Multicenter evaluation of the Vitek MS matrix-assisted laser desorption ionization-time of flight mass spectrometry system for identification of Gram-positive aerobic bacteria[J]. J Clin Microbiol, 2013, 51(7): 2225-2231. DOI:10.1128/JCM.00682-13 |
| [4] |
Cherkaoui A, Hibbs J, Emonet S, et al. Comparison of two matrix-assisted laser desorption ionization-time of flight mass spectrometry methods with conventional phenotypic identification for routine identification of bacteria to the species level[J]. J Clin Microbiol, 2010, 48(4): 1169-1175. DOI:10.1128/JCM.01881-09 |
| [5] |
邬兰, 张永, 曾宪涛, 等. QUADAS-2在诊断准确性研究的质量评价工具中的应用[J]. 湖北医药学院学报, 2013, 32(3): 201-208. |
| [6] |
Bader O, Weig M, Taverne-Ghadwal L, et al. Improved clinical laboratory identification of human pathogenic yeasts by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Clin Microbiol Infect, 2011, 17(9): 1359-1365. DOI:10.1111/j.1469-0691.2010.03398.x |
| [7] |
Berrio I, Maldonado N, De Bedout C, et al. Comparative study of Candida spp. isolates: Identification and echinocandin susceptibility in isolates obtained from blood cultures in 15 hospitals in Medellin, Colombia[J]. J Glob Antimicrob Resist, 2018, 13: 254-260. DOI:10.1016/j.jgar.2017.11.010 |
| [8] |
de Respinis S, Tonolla M, Pranghofer S, et al. Identification of dermatophytes by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Med Mycol, 2013, 51(5): 514-521. DOI:10.3109/13693786.2012.746476 |
| [9] |
Durán-Valle MT, Sanz-Rodríguez N, Muñoz-Paraíso C, et al. Identification of clinical yeasts by Vitek MS system compared with API ID 32 C[J]. Med Mycol, 2014, 52(4): 342-349. DOI:10.1093/mmy/myt036 |
| [10] |
Elbehiry A, Marzouk E, Hamada M, et al. Application of MALDI-TOF MS fingerprinting as a quick tool for identification and clustering of foodborne pathogens isolated from food products[J]. New Microbiol, 2017, 40(4): 269-278. |
| [11] |
Galán F, García-Agudo L, Guerrero I, et al. Evaluation of mass spectrometry for the identification of clinically interesting yeasts[J]. Enferm Infecc Microbiol Clin, 2015, 33(6): 372-378. DOI:10.1016/j.eimc.2014.10.003 |
| [12] |
Gracheva A, Okhmat V. The comparison of matrix-assisted laser desorption ionization-time of flight mass spectrometry with API 20 AUX test for the identification of Candida spp[J]. Mycoses, 2013, 56(Suppl 3): 83-84. |
| [13] |
Huang Y, Wang J, Zhang M, et al. Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry for rapid identification of fungal rhinosinusitis pathogens[J]. J Med Microbiol, 2017, 66(3): 328-333. |
| [14] |
Iranzo A, García-Effron G, Pemán J, et al. Mass spectrometry MALDI-TOF for identification of the Candida parapsilosis complex[J]. Mycoses, 2011, 54(Suppl 2): 180-181. |
| [15] |
Jensen RH. Arendrup MC. Performance of MALDI-TOF mass spectrometry in comparison with classical diagnostic methods for the identification of yeast species at a mycology reference laboratory[J]. Clin Microbiol Infect, 2012, 18(Suppl 3): 691-692. |
| [16] |
Lacroix C, Gicquel A, Sendid B, et al. Evaluation of two matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF MS) systems for the identification of Candida species[J]. Clin Microbiol Infect, 2014, 20(2): 153-158. DOI:10.1111/1469-0691.12210 |
| [17] |
Li MC, Chang TC, Chen H, et al. Oligonucleotide array and VITEK matrix-assisted laser desorption ionization-time of flight mass spectrometry in species identification of blood yeast isolates[J]. Front Microbiol, 2018, 9: 51. DOI:10.3389/fmicb.2018.00051 |
| [18] |
Marklein G, Josten M, Klanke U, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for fast and reliable identification of clinical yeast isolates[J]. J Clin Microbiol, 2009, 47(9): 2912-2917. DOI:10.1128/JCM.00389-09 |
| [19] |
Najafzadeh MJ, Alizadeh M, Kolecka A, et al. Identification of Candida species isolated from vulvovaginitis in Mashhad, Iran by the use of the MALDI-TOF MS[J]. Medical Mycology, 2018, 56(Suppl 2): S79. |
| [20] |
Ninghui G, Bing W, Wei R, et al. Application of PCR and high-resolution melting for rapid identification of yeasts routinely isolated in a clinical microbiology laboratory[J]. Ann Clin Lab Sci, 2015, 45(6): 680-685. |
| [21] |
Posteraro B, Vella A, Cogliati M, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry-based method for discrimination between molecular types of Cryptococcus neoformans and Cryptococcus gattii[J]. J Clin Microbiol, 2012, 50(7): 2472-2476. DOI:10.1128/JCM.00737-12 |
| [22] |
Ranque S, L'Ollivier C, Cassagne C, et al. Timely dermatophytes species identification by MALDI-TOF mass spectrometry[J]. Mycoses, 2012, 55(Suppl 4): 90. |
| [23] |
Ranque S, Normand AC, Cassagne C, et al. MALDI-TOF mass spectrometry identification of filamentous fungi in the clinical laboratory[J]. Mycoses, 2014, 57(3): 135-140. DOI:10.1111/myc.2014.57.issue-3 |
| [24] |
Reich M, Stark M, Huesgen G, et al. Identification of dermatophyte and mold species by MALDI-TOF mass spectrometry[J]. Intern J Med Microbiol, 2009, 299(Suppl 1): 13. |
| [25] |
Ruiz de Alegría Puig C, Agüero-Balbín J, Fernández-Mazarrasa C, et al. Evaluation of the Vitek-MSTM system in the identification of Candida isolates from bloodstream infections[J]. Rev Iberoam Micol, 2018, 35(3): 130-133. DOI:10.1016/j.riam.2018.02.001 |
| [26] |
Rychert J, Slechta ES, Barker AP, et al. Multicenter evaluation of the Vitek MS v3.0 system for the identification of filamentous fungi[J]. J Clin Microbiol, 2018, 56(2), pii: e01353-17. https://www.ncbi.nlm.nih.gov/pubmed/29142047
|
| [27] |
Sariguzel FM, Berk E, Koc AN, et al. Evaluation of chromagar Candida, VITEK2 YST and VITEK® MS for identification of Candida strains isolated from blood cultures[J]. Infez Med, 2015, 23(4): 318-322. |
| [28] |
Sow D, Fall B, Ndiaye M, et al. Usefulness of MALDI-TOF mass spectrometry for routine identification of Candida species in a resource-poor setting[J]. Mycopathologia, 2015, 180(3-4): 173-179. DOI:10.1007/s11046-015-9905-2 |
| [29] |
Westblade LF, Jennemann R, Branda JA, et al. Multicenter study evaluating the Vitek MS system for identification of medically important yeasts[J]. J Clin Microbiol, 2013, 51(7): 2267-2272. DOI:10.1128/JCM.00680-13 |
| [30] |
彭阳, 许超, 王玉月, 等. 丝状真菌的快速鉴定及药敏试验[J]. 临床检验杂志, 2017, 35(7): 486-490. |
| [31] |
奚海燕, 王颖, 黄梅, 等. 基质辅助激光解析电离飞行时间质谱仪在快速鉴定临床酵母菌中的应用[J]. 医学研究生学报, 2015, 28(4): 416-419. DOI:10.3969/j.issn.1008-8199.2015.04.020 |
| [32] |
罗燕萍. 质谱技术在临床微生物实验室中的应用前景[J]. 检验医学, 2015, 30(2): 97-101. |
| [33] |
Panda A, Kurapati S, Samantaray JC, et al. Rapid identification of clinical Mycobacterial isolates by protein profiling using assisted laser desorption ionization-time of flight mass spectrometry[J]. India Med Microbiol, 2013, 31(2): 117-122. |
| [34] |
Sauer S, Freiwald A, Maier T, et al. Classification and identification of bacteria by mass spectrometry and computational analysis[J]. PLoS One, 2008, 3(7): e2843. DOI:10.1371/journal.pone.0002843 |
| [35] |
De Carolis E, Vella A, Florio AR, et al. Use of matrix-assisted laser desorption ionization-time of flight mass spectrometry for caspofungin susceptibility testing of Candida and Aspergillus specie[J]. Clin Microbiol, 2012, 50(7): 2479-2483. DOI:10.1128/JCM.00224-12 |
| [36] |
Bittar F, Ouchenane Z, Smati F, et al. MALDI-TOF-MS for rapid detection of staphylococcal Panton-Valentine leukocidin. Int[J]. Int J Antimicrob Agents, 2009, 34(5): 467-470. DOI:10.1016/j.ijantimicag.2009.03.017 |
| [37] |
Marinach-Patrice C, Lethuillier A, Marly A, et al. Use of mass spectrometry to identify clinical Fusarium isolates[J]. Clin Microbiol Infect, 2009, 15(7): 634-642. DOI:10.1111/j.1469-0691.2009.02758.x |
| [38] |
Wojewoda C. Pathology consultation on matrix-assisted laser desorption ionization-time of flight mass spectrometry for microbiology[J]. Am J Clin Pathol, 2013, 140(2): 143-148. DOI:10.1309/AJCPU0AYZ5SYQIUK |
| [39] |
Sendid B, Ducoroy P, François N, et al. Evaluation of MALDI-TOF mass spectrometry for the identification of medically important yeasts in the clinical laboratories of Dijon and Lille hospitals[J]. Med Mycol, 2013, 51(1): 25-32. DOI:10.3109/13693786.2012.693631 |



