类鼻疽病(melioidosis)是由假鼻疽伯克霍尔德菌(Burkholderia pseudomallei, BP)引起的人畜共患病,发病区域一般都集中在热带、亚热带之间,其他地区偶有散发病例。BP是一种非发酵革兰阴性条件致病菌,在东南亚、澳大利亚北部以及南美洲和中美洲的部分地区流行,许多国家均报道了由BP引起的传染病例[1]。类鼻疽病临床感染的差别大,可引起败血症、脓毒血症、肝脓肿、肺脓肿、软组织感染、肌肉组织与骨骼感染等并发症[2]。化脓性关节炎是指由细菌感染所导致的关节内化脓性感染,可对关节造成严重破坏,甚至造成关节活动度的完全丧失。多数化脓性关节炎由金色葡萄球菌、肺炎链球菌、其他链球菌等细菌引起,由BP引起的化脓性关节炎罕见报道。我院收治1例由BP引起的化脓性髋关节炎,明确病原学诊断后,经抗菌药物治疗、髋关节切除旷置、二期全髋关节置换后治愈,现报告如下。
1 病历资料 1.1 病史患者男,58岁,因“反复双髋疼痛20 d”首次入院。现病史:患者20天前无明显诱因出现双髋疼痛,左髋较重,无双下肢无力、发热、寒战等不适,就诊于当地市医院,予抗感染、止痛等对症处理,无效后多次行“双髋切开引流术”,术后双髋疼痛明显缓解,左髋术切口下段开裂约2 cm,伴脓性分泌物渗出,对症换药处理后未见明显好转,转诊我院。既往史:否认高血压、糖尿病等病史,否认肝炎、结核病等病史。
1.2 体格检查及实验室检查入院查体:双侧髋关节压痛,活动受限,无短缩畸形。右髋可见一长约10 cm陈旧性手术疤痕,愈合良好。左髋可见一长约15 cm陈旧性手术疤痕,下段长约2 cm切口裂开,可见苍白水肿肉芽,大量脓性分泌物渗出。入院后实验室检查:白细胞计数(WBC)8.66×109/L、中性粒细胞百分比(NEUT%)59.7%、红细胞沉降率(ESR)84 mm/h、C反应蛋白(CRP)67.47 mg/L、结核菌素(PPD)试验(++)。骨盆平片、左右髋关节正位片见图 1,全身骨显像等影像学检查见图 2~3。
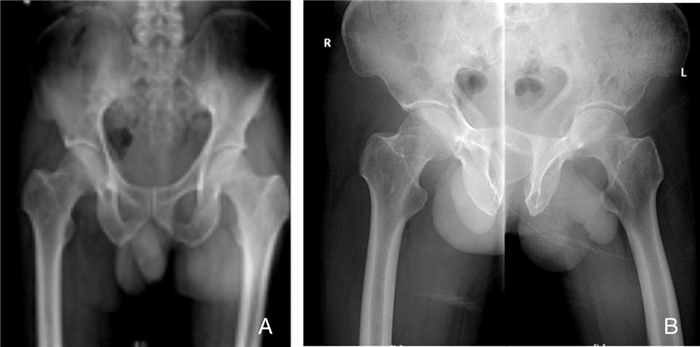 |
| 注:初次入院骨盆及双髋关节正侧位未见明显异常 图 1 初次入院骨盆平片、左右髋关节正位X线检查结果 Figure 1 Positive X-ray examination result of pelvic plain film as well as left and right hip joint at the first admission |
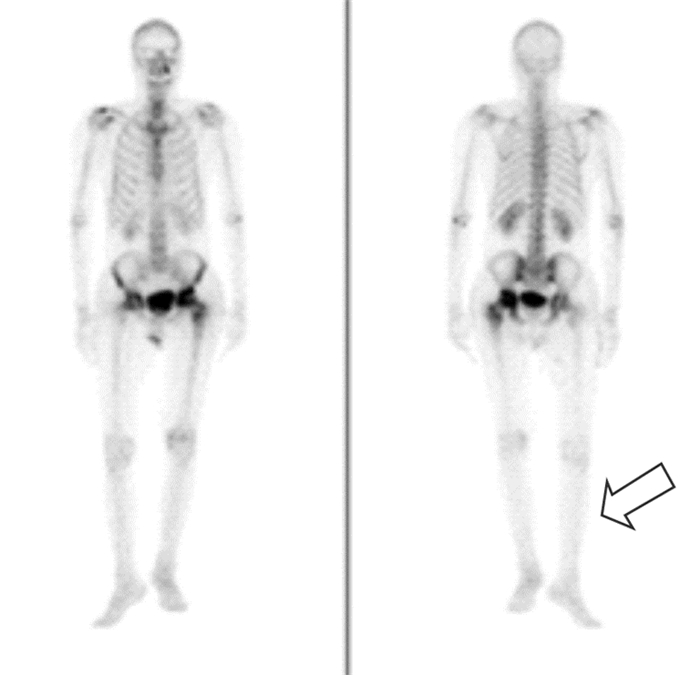 |
| 注:左侧股骨头放射性摄取减低,左侧股骨上段异常放射性分布增高区 图 2 ECT检查结果 Figure 2 Emission computed tomography (ECT) examination result |
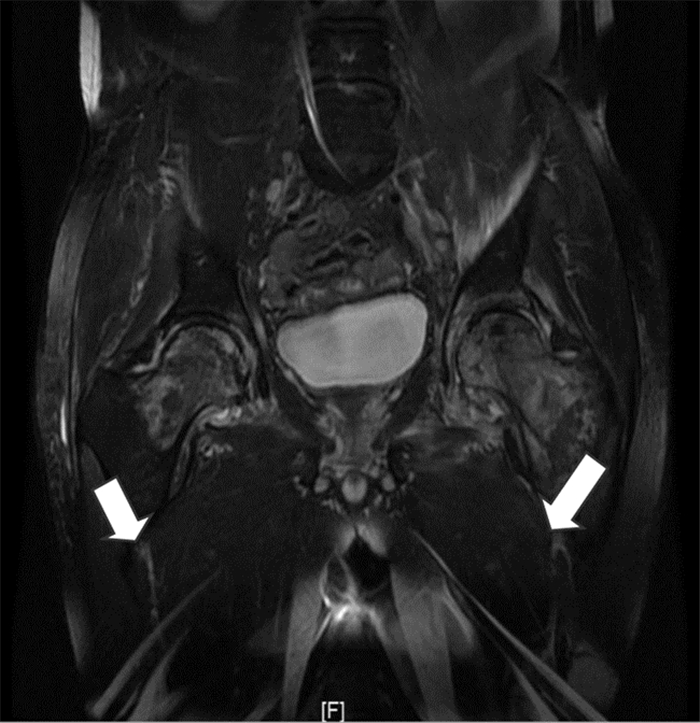 |
| 注:双侧股骨头、股骨颈、髋臼及左侧股骨上段广泛骨质信号异常并周围软组织肿胀,右髋关节积液,考虑炎症性病变可能,未除外股骨头缺血性坏死 图 3 髋关节MRI检查结果 Figure 3 Magnetic resonance imaging (MRI) examination result of hip joint |
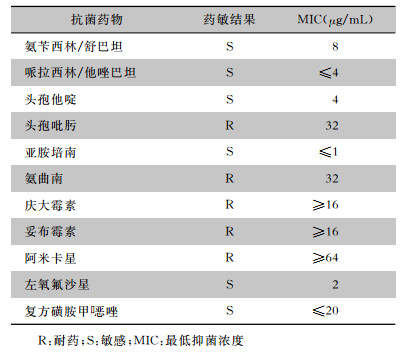
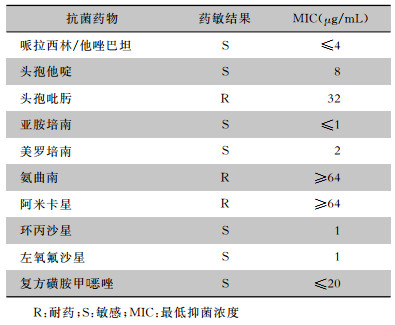
综合病史及检查结果诊断为“双髋化脓性关节炎;双髋关节清创术后”。因PPD试验阳性,考虑结核性感染的可能。入院后暂予以试验性抗结核治疗(利福平+乙胺丁醇+异烟肼三联抗结核),并积极采创面深部分泌物送培养,从深部标本中培养出BP,药敏结果见表 1。确诊为BP感染,根据药敏结果,予以敏感抗菌药物哌拉西拉钠/他唑巴坦钠(2.0/0.25 g,静脉滴注,q6h),莫西沙星(0.4 g,静脉滴注,qd),并予以创面换药、止痛、加强营养补充等对症治疗。2周后复查,血常规示:WBC 8.65×109/L、NEUT% 72.6%、ESR 103 mm/h、CRP 33.6 mg/L,炎症指标虽未降至正常,伤口也未完全愈合,但肉芽组织新鲜,无明显渗出。患者要求出院,嘱其出院后继续口服头孢地尼(0.1g,口服,tid),疗程1个月。
| 表 1 第一次入院检出BP药敏结果 Table 1 Antimicrobial susceptibility testing results of B. pseudomallei detected at the first admission |
|
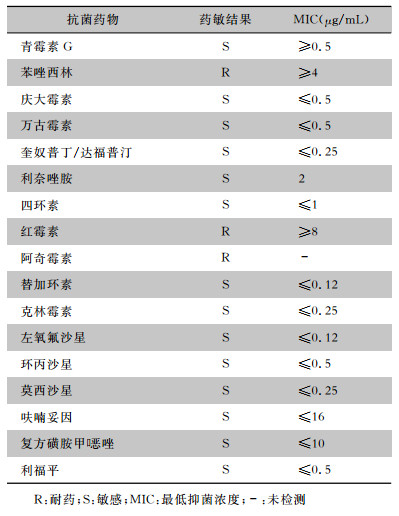
患者3周后再次因“左髋流脓2周”入院,自上次出院后原创口再次破溃,双髋关节仍有持续性疼痛。入院检查:WBC 10.07×109/L、NEUT% 73.4 %、CRP 88.20 mg/L,炎症指标较上次出院时明显增高。影像学检查,见图 4~5。入院后行深部创面及关节腔穿刺细菌培养,结果回报为BP,药敏结果见表 2,培养结果回报后予以美罗培南(1.0 g,静脉滴注,q8h)、头孢他啶(2.0 g,静脉滴注,bid)、莫西沙星(0.4 g,静脉滴注,qd),但治疗效果不佳。
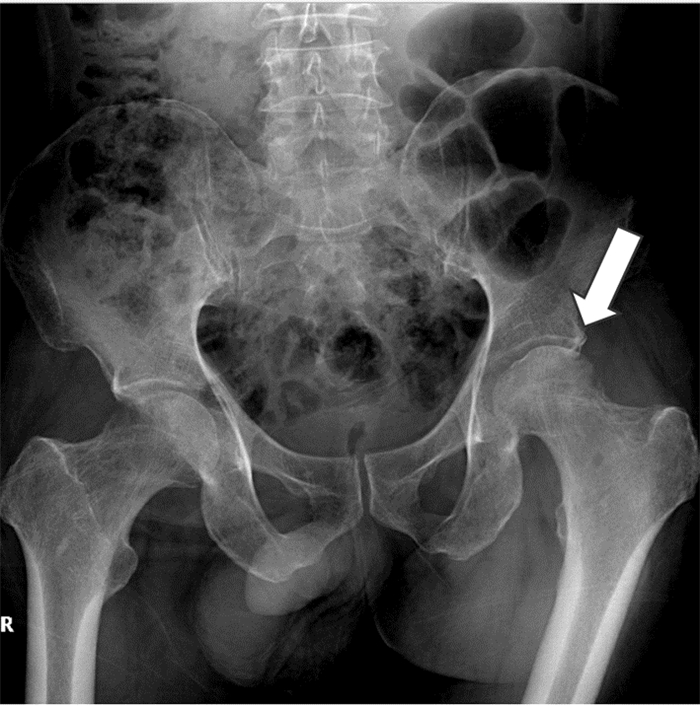 |
| 注:双侧股骨颈骨质密度不均,小片状骨质吸收破坏,边界不清。左侧髋关节骨性关节模糊,间隙变窄,右侧髋关节尚正常 图 4 第二次入院骨平片、髋关节X线检查结果 Figure 4 X-ray examination result of pelvic plain film as well as left and right hip joint at the second admission |
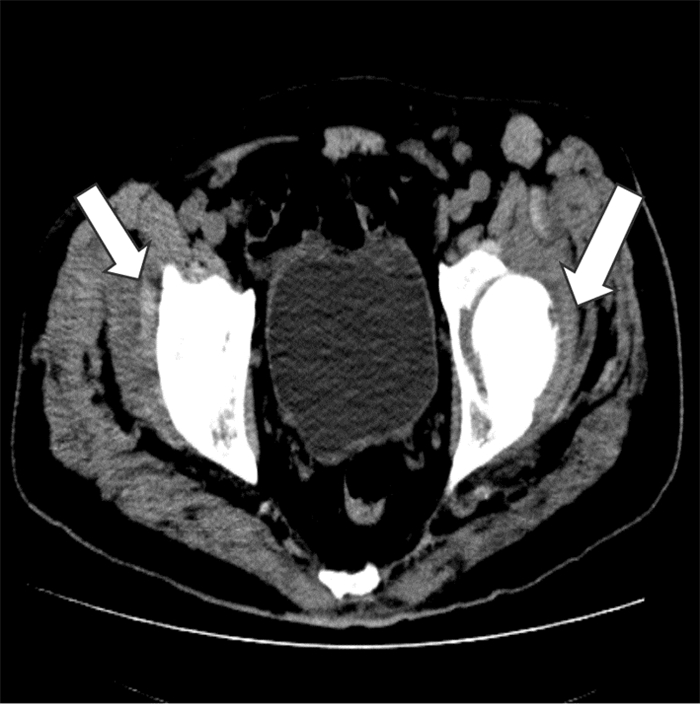 |
| 注:双侧股骨颈小片状骨质吸收破坏,边界不清,双髋关节周围见积液影像,双侧髋关节周围软组织肿胀 图 5 第二次入院MRI检查结果 Figure 5 MRI examination result at the second admission |
| 表 2 第二次入院检出BP药敏结果 Table 2 Antimicrobial susceptibility testing results of B. pseudomallei detected at the second admission |
|
后行左髋化脓性关节炎病灶清除+置管冲洗引流术。术中抽取关节液革兰染色结果示:少量革兰阳性球菌及革兰阴性杆菌,培养结果为BP(药敏结果与表 2药敏结果相同)及沃氏葡萄球菌,药敏结果见表 3,根据药敏结果予以加用万古霉素(1.0 g,静脉滴注,q12h)。
| 表 3 沃氏葡萄球菌对常用抗菌药物的药敏结果 Table 3 Antimicrobial susceptibility testing results of Staphylococcus warneri |
|
住院期间病情反复,考虑保守治疗及单独清创引流效果不佳,炎症进展引起双侧关节破坏严重,遂先后行左、右侧髋病灶清除+股骨头、股骨颈切除术,继续美罗培南、万古霉素(剂量、用法同前)抗感染治疗,并辅以优质营养支持及保持内环境稳定等对症治疗。术后影像学检查见图 6。出院前复查:WBC 6.25×109/L、NEUT% 63.4%、CRP 13.25 mg/L、ESR 55 mm/h。出院后予以左氧氟沙星(0.5 g,口服,qd)治疗,疗程6周。待感染完全控制后且复发风险减低后进一步置换髋关节以恢复关节功能。
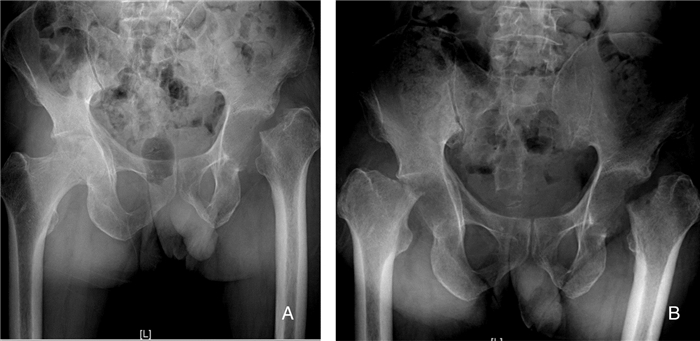 |
| A:左侧股骨头、股骨颈消失,左股骨向外上位移,左髋关节骨质吸收改变,右侧股骨头可见密度不均,小片骨质破坏,边界不清;B:双侧股骨头及部分股骨颈缺如,股骨向外上移位,左股骨上段及双侧髋臼骨质密度减低 图 6 第二次入院手术后X线检查结果 Figure 6 X-ray examination result after operation at the second admission |
半年后,患者返院行人工髋关节置换术。入院检查炎症指标均正常,一般状况良好,于全麻下行右侧人工全髋关节置换术,术后X线复查见图 7。2周后于全麻下行左侧人工全髋置换术,术后X线复查见图 8。假体固定良好,未见明显位移、松动。实验室检查:WBC 4.96×109/L、NEUT% 61.5%、CRP 14.70 mg/L、ESR 14.70 mm/h。患者未再诉不适。
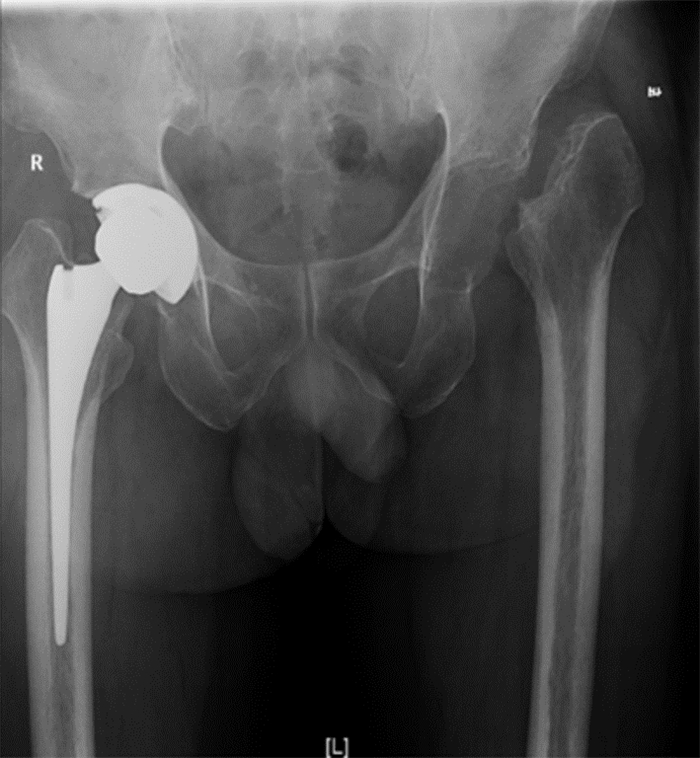 |
| 图 7 第三次入院右侧人工全髋置换术后X线检查结果 Figure 7 X-ray examination result after right total hip arthroplasty at the third admission |
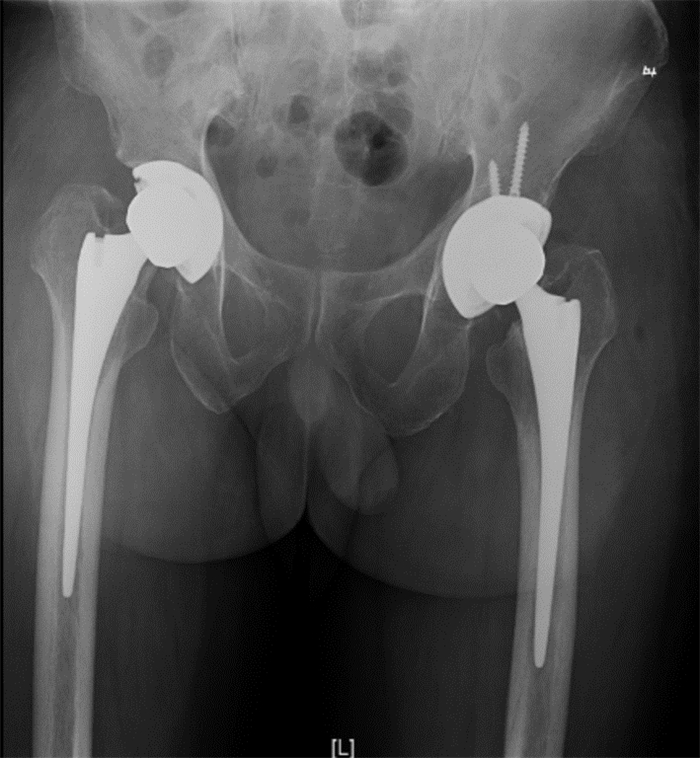 |
| 图 8 第三次入院左侧人工全髋置换术后X线检查结果 Figure 8 X-ray examination result after left total hip arthroplasty at the third admission |
术后半年随访一次,以后每隔一年随访一次,最近一次复查炎症指标WBC 6.92×109/L、NEUT% 69.3%、CRP<5 mg/L、ESR 11 mm/h,影像学检查结果表明未见假体松动、再次感染等。
2 讨论BP化脓性关节炎是由BP引起的骨关节慢性感染。BP以前被称为类鼻疽假单胞菌,是一种土壤腐生菌,为需氧革兰阴性杆菌,常存在于疫区死水、土壤、粪便及腐烂尸体中。主要通过以下途径传播:(1)破损的皮肤直接接触含有致病菌的水或土壤,是本病传播的主要途径;(2)吸入含有致病菌的尘土或气溶胶;(3)食用被污染的食物;(4)被吸血昆虫(蚤、蚊)叮咬(动物实验证明类鼻疽杆菌能在印度客蚤和埃及伊蚊的消化道内繁殖,并保持传染性达50 d之久);(5)有报道[3]认为可通过家庭密切接触、性接触传播。经皮肤接触后的血源性感染被认为是骨和关节感染中的重要传播方式[4]。
有研究[5]显示,糖尿病和肾功能损害是最重要的危险因素,在患病者的合并症报告中,糖尿病和肾功能损害的患病率显著高于相同年龄段的一般人群。BP感染常见的的表现为菌血症、脓肿和肺炎[5],亦可累及皮肤、肝、脾、肌肉等,多数感染患者起病急,脓毒血症是最严重的类型,局部器官脓肿是最常见的类型。病发时,内脏脓肿存在于脾者约75%,存在于肝者约45%,存在于肾者超过10%,偶见于前列腺;也可迁延不愈,病程迁延达数年,在抵抗力下降时急性发作,慢性类鼻疽病最常侵犯肺部和淋巴结,中心坏死,周边有肉芽肿形成[3]。总体来说,其病死率较高,有文献报道其病死率可达50%以上[6]。
BP引起的骨与关节感染总的来说并不常见。BP引起的骨与关节感染,除非持续发热、并发引起呼吸衰竭及严重败血症,总体病死率较低[7]。脓毒性关节炎的突出特征是关节周围的红、肿、热、痛,伴关节活动障碍[8]。除非存在确切的微生物培养证据,否则很难与葡萄球菌属、链球菌属感染区别开来。Teparrakkul等[7]报道了泰国679例BP感染患者中有98例出现肌肉骨骼感染症状,在关节感染中,膝关节(41例)是最易受累关节,其次是踝关节(20例)、髋关节(15例)和肩关节(10例)。Saravu等[9]报道了25例经培养证实的BP感染病例,其中48%(12/25)的患有骨髓炎或脓毒性关节炎,此比率高于泰国及多数国家的研究报道。我国感染病例主要来自海南、广西、广东等热带、亚热带地区,偶有北方地区零星报道。
目前对于BP引起的骨与关节感染,最有效的方式是感染病灶彻底清创,并迅速予以足量抗菌药物治疗。针对骨与关节这类深部组织感染,建议延长抗菌药物使用时间至4~8周,后改口服继续使用12周[10-11]。White等[12]的一项随机试验比较了头孢他啶与氯霉素治疗BP感染,发现使用头孢他啶治疗可降低患者的病死率。此后,头孢他啶已作为治疗BP的首选用药。此外,碳青霉烯类抗生素亦可作为首选用药,暂无试验验证头孢他啶与碳青霉烯类抗生素的优劣;其次是口服复方磺胺甲口恶唑或阿莫西林/克拉维酸[13]。Inglis等[14]建议在针对急性深部感染第一阶段使用头孢他啶、美罗培南或亚胺培南,必要时根据药敏使用复方磺胺甲口恶唑以防止复发。第二阶段使用复方磺胺甲口恶唑和多西环素的联合疗法和单独使用复方磺胺甲口恶唑已成功用于澳大利亚患者BP感染根治,最近已经达成使用阿莫西林/克拉维酸作为二线药物的共识指南。Stephens等[15]的一项回顾性研究指出,粒细胞集落刺激因子(G-CSF)也可用于严重急性类鼻疽感染的早期干预,但使用效果仍有争议。
外科治疗方法现在主张及早行关节清创引流术,必要时旷置冲洗引流。手术方法包括传统切开引流、关节镜下治疗等。Yuan等[16]纳入23例化脓性关节炎的患者,在关节镜下治疗化脓性膝关节炎具有侵袭小和清创彻底等优点,有助于减轻炎症并恢复膝关节功能,并建议在术后两周内延长冲洗时间。当存在严重的关节破坏,并影响关节功能及活动时,一二期的关节置换、暂时切除旷置后的二期置换、关节融合后的二期置换均可以取得良好的效果。Papanna等[17]回顾性纳入13年内18例因化脓性髋关节炎而行一期或二期髋关节置换,7例行二期置换,11例行一期置换,结果显示一期或二期翻修用于治疗活动期或静止期化脓性髋关节炎效果相当。Lustig等[18]回顾性纳入17例行关节融合控制髋关节感染病例,分别通过不同的手术方式去除融合并行二期关节置换,14例取得了良好的效果。
本例患者主诉双侧髋关节疼痛、流脓,反复发作,先后行保守抗菌药物治疗,局部切开清创冲洗引流,双侧股骨头切除并旷置引流,最后行双侧髋关节置换而获得痊愈。患者职业为农民,平时以种植业为生,生活于亚热带海岛,很可能与平时接触疫土或疫水有关。因此,在高发病率地区及疫区,需要考虑此菌感染的可能,并通过细菌培养、PCR检测、二代测序、细菌质谱鉴定等先进技术予以确定病原体,做到早诊断早治疗。
初诊时医生只予以敏感抗菌药物治疗,敏感抗菌药物使用时间为2周左右,未及时进行清创引流等外科处理。笔者认为抗菌药物疗程不足及外科处理的延误很可能是导致感染迁延不愈的主要原因。足够疗程的抗菌药物应用十分重要,但有研究指出,即使使用足够疗程的抗菌药物,仍有约10%的复发率。患者在当地医院多次行双侧髋关节切开清创引流术,符合化脓性关节炎的治疗方式,但左侧关节反复破溃、流脓,可能与清创不彻底有关。笔者认为术中应彻底清创,清除可能存在感染的滑膜,尽可能去除死骨,清除脓窝。当存在大片骨缺损时,可适当植骨。如关节功能已不能保留,目前推荐以一期切除病灶后行含抗菌药物骨水泥间隔器的植入作为替代,可保留部分关节功能,防止肌肉挛缩,费用较低,二期再行人工关节置换,这也是假体关节周围感染中常用的处理方式。
综上所述,该患者因BP感染致慢性化脓性髋关节炎,经过内科保守治疗、外科治疗等方式治愈,最终随访未见复发。
| [1] |
Limmathurotsakul D, Golding N, Dance DA, et al. Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis[J]. Nat Microbiol, 2016, 1: 15008. DOI:10.1038/nmicrobiol.2015.8 |
| [2] |
Limmathurotsakul D, Peacock SJ. Melioidosis:a clinical overview[J]. Br Med Bull, 2011, 99: 125-139. DOI:10.1093/bmb/ldr007 |
| [3] |
黎伟明, 王丽娜, 张未寒, 等. 类鼻疽研究近况[J]. 中国热带医学, 2005, 5(2): 388-389, 393. DOI:10.3969/j.issn.1009-9727.2005.02.101 |
| [4] |
Raja NS, Scarsbrook C. Burkholderia pseudomallei causing bone and joint infections:a clinical update[J]. Infect Dis Ther, 2016, 5(1): 17-29. DOI:10.1007/s40121-015-0098-2 |
| [5] |
Pang L, Harris PNA, Seiler RL, et al. Melioidosis, Singapore, 2003-2014[J]. Emerg Infect Dis, 2018, 24(1): 140-143. |
| [6] |
Wiersinga WJ, Currie BJ, Peacock SJ. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. DOI:10.1056/NEJMra1204699 |
| [7] |
Teparrakkul P, Tsai JJ, Chierakul W, et al. Rheumatological manifestations in patients with melioidosis[J]. Southeast Asian J Trop Med Public Health, 2008, 39(4): 649-655. |
| [8] |
Currie BJ. Melioidosis:evolving concepts in epidemiology, pathogenesis, and treatment[J]. Semin Respir Crit Care Med, 2015, 36(1): 111-125. |
| [9] |
Saravu K, Mukhopadhyay C, Vishwanath S, et al. Melioido-sis in southern India:epidemiological and clinical profile[J]. Southeast Asian J Trop Med Public Health, 2010, 41(2): 401-409. |
| [10] |
Morse LP, Smith J, Mehta J, et al. Osteomyelitis and septic arthritis from infection with Burkholderia pseudomallei:A 20-year prospective melioidosis study from northern Australia[J]. J Orthop, 2013, 10(2): 86-91. DOI:10.1016/j.jor.2013.04.001 |
| [11] |
Cheng AC, Currie BJ. Melioidosis:epidemiology, pathophysiology, and management[J]. Clin Microbiol Rev, 2005, 18(2): 383-416. DOI:10.1128/CMR.18.2.383-416.2005 |
| [12] |
White NJ, Dance DA, Chaowagul W, et al. Halving of mortality of severe melioidosis by ceftazidime[J]. Lancet, 1989, 2(8665): 697-701. |
| [13] |
Dance D. Treatment and prophylaxis of melioidosis[J]. Int J Antimicrob Agents, 2014, 43(4): 310-318. DOI:10.1016/j.ijantimicag.2014.01.005 |
| [14] |
Inglis TJ. The Treatment of melioidosis[J]. Pharmaceuticals (Basel), 2010, 3(5): 1296-1303. DOI:10.3390/ph3051296 |
| [15] |
Stephens DP, Fisher DA, Currie BJ. An audit of the use of granulocyte colony-stimulating factor in septic shock[J]. Intern Med J, 2002, 32(4): 143-148. DOI:10.1046/j.1445-5994.2002.00195.x |
| [16] |
Yuan Y, Zhang HJ, Zhang B, et al. Analysis on the arthroscopy efficacy with different irrigation times for the treatment of suppurative knee arthritis in elder patients[J]. Zhongguo Gu Shang, 2017, 30(4): 300-303. |
| [17] |
Papanna MC, Chebbout R, Buckley S, et al. Infection and failure rates following total hip arthroplasty for septic arthritis:a case-controlled study[J]. Hip Int, 2018, 28(1): 63-67. DOI:10.5301/hipint.5000538 |
| [18] |
Lustig S, Vaz G, Guyen O, et al. Total hip arthroplasty after hip arthrodesis performed for septic arthritis[J]. Rev Chir Orthop Reparatrice Appar Mot, 2007, 93(8): 828-835. DOI:10.1016/S0035-1040(07)78466-0 |



