血液病患者受原发疾病和治疗因素的影响,机体免疫细胞吞噬功能下降,导致免疫功能异常,增加了医院感染(healthcare-associated infection, HAI)发生的风险。恶性血液病(hematological malignancies, HM)是起源于造血系统的恶性肿瘤,主要包括急、慢性白血病,淋巴瘤,多发性骨髓瘤,骨髓增生异常综合征等[1]。HM患者治疗周期较长,免疫功能低下,极易发生HAI[2-4],是HAI的高危人群[5],尤其是并发中性粒细胞缺乏者,HAI发病率达77.38%[6]。HAI延长患者住院时间、增加治疗费用及病死率[7],使病死率高达10%~30%[8]。因此,寻求一种适合的预防方案,提高控制HM患者HAI发病率的水平尤为关键。为此,美国健康研究所(Institute for Healthcare Improvement, IHI)提出集束化干预理念,即集合一系列有循证基础的治疗及护理措施来预防和治疗某些难治的临床疾患。本研究以2017年1月— 2018年9月在某院血液科住院治疗的HM患者作为研究对象,采用常规干预和集束化干预两种方法进行对比性研究,以探讨适用于HM患者医院感染预防的有效方法。
1 对象与方法 1.1 研究对象选择该院血液科住院治疗的HM患者为研究对象,以2017年1月1日—2018年1月31日进行常规干预的患者为对照组,2018年2月1日—9月20日进行集束化干预的患者为试验组。本研究经医学伦理委员会批准和通过(编号:fsyy201704)。
1.2 纳入与排除标准纳入标准:(1)患者按照内科学第七版的标准,通过血液系统相关检测、骨髓穿刺等检查被确诊为HM。(2)患者在血液科进行全程住院治疗。排除标准:(1)入住血液科病房,疑为HM,但未确诊即已结束在该院的诊治。(2)未在血液科完成全程治疗的患者。(3)入院治疗48 h以内的患者。
1.3 医院感染诊断标准以卫生部办公厅2001年1月3日印发的《医院感染诊断标准(试行)》为依据, 结合病历资料进行诊断。
1.4 质量控制实施集束化干预措施前,感染管理科将对血液科医务人员进行HAI防控培训、现场指导,由主管医生和责任护士对陪护和患者进行宣教。血液科实施每日自查,感染管理科通过医院感染监控系统每日对血液科患者电子病历进行主动监测,每周监督检查量化指标,每月反馈主管医生、责任护士个人管理依从性及科室集束化干预措施的执行率。
1.5 研究方法对照组采用回顾性调查,患者采取常规干预措施,包括日常环境的清洁消毒、护理及患者安置等工作。试验组采用前瞻性调查,患者采取集束化干预措施。见表 1。
| 表 1 两组HM患者干预措施的比较 Table 1 Comparison of intervention measures between two groups of patients with HM |

|
应用SPSS 19.0统计软件对数据进行分析。计数资料以例数或百分比表示,采用χ2检验或Fisher精确概率法检验,符合正态分布的计量资料以均数±标准差(x±s)表示,采用t检验,以P≤0.05为差异有统计学意义。
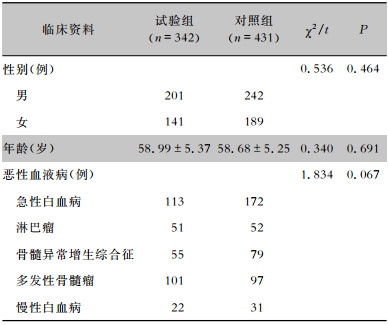
2 结果 2.1 基本情况按照纳入及排除标准,试验组纳入患者342例,对照组纳入患者431例,两组患者性别、年龄、HM疾病构成比较,差异均无统计学意义(均P>0.05),具有可比性。见表 2。
| 表 2 两组HM患者临床资料的比较 Table 2 Comparison of clinical data between two groups of patients with HM |
|
通过血液科的自查和感染管理科的日常监督,整体集束化干预措施的依从性有所提高,2—4月份整体干预措施的执行率明显上升,5—9月份的执行率趋于平稳,隔离管理、陪护管理及探视管理执行力较好,执行率>80%,清洁单元和手卫生执行率上升缓慢。见图 1。
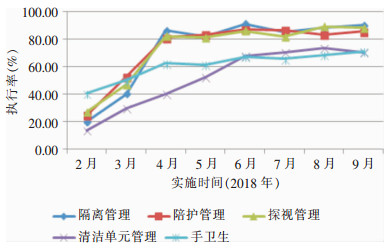 |
| 图 1 集束化干预措施依从性执行率变化曲线图 Figure 1 Curve of change in implementation rate of comp-liance with bundle intervention measures |
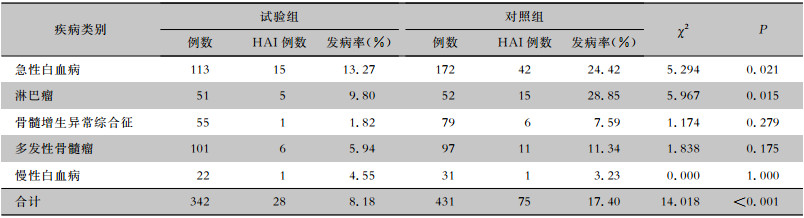
试验组HM患者HAI发病率(8.18%)低于对照组(17.40%),差异有统计学意义(χ2=14.018, P<0.05)。进一步对HM患者进行归类分析,结果显示淋巴瘤患者HAI发病率降低最明显,对照组淋巴瘤患者HAI发病率为28.85%,试验组患者为9.80%,两组比较差异有统计学意义(χ2=5.967, P<0.05);其次为急性白血病,对照组急性白血病患者HAI发病率为24.42%,试验组患者为13.27%,两组比较差异有统计学意义(χ2=5.294, P<0.05)。见表 3。
| 表 3 试验组与对照组HM患者HAI情况 Table 3 HAI in HM patients in trial group and control group |
|
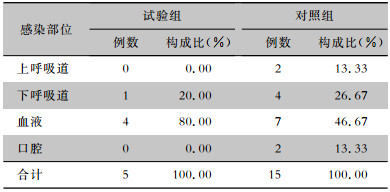
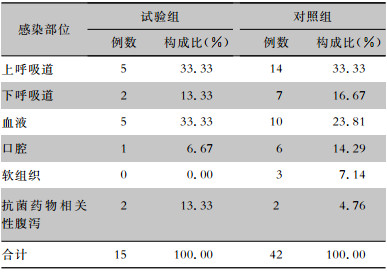
HAI发病率降低较为明显的是淋巴瘤和急性白血病,试验组和对照组此两种疾病患者感染部位构成比较,差异有统计学意义。与对照组比较,试验组淋巴瘤患者在呼吸系统和口腔的感染部位构成比下降较为显著,急性白血病患者在呼吸系统、口腔及皮肤软组织等感染部位构成比有所下降,而二者在血流感染构成比有所上升。见表 4、5。
| 表 4 试验组与对照组淋巴瘤患者HAI部位分布 Table 4 Site distribution of HAI in patients with lymphoma in trial group and control group |
|
| 表 5 试验组与对照组急性白血病患者HAI部位分布 Table 5 Site distribution of HAI in patients with acute leukemia in trial group and control group |
|
随着医疗手段不断提高,许多HM患者的临床预后已大为改善,但HM患者依然是HAI的高危人群,患者合并感染后,感染极易扩散,病情进展迅速,病死率高[9],而临床上多使用头孢菌素、万古霉素、碳青霉烯类等药物控制感染,导致治疗费用增加,经济负担加重。因此,如何预防HAI的发生,最大限度的延长患者的生存期,已经成为血液科临床医生面临亟待解决的问题。
集束化干预作为一种基于循证医学证据、相互关联且临床操作性强的实践措施,将其组合在一起广泛应用于各类临床干预研究中。研究表明,集束化干预可应用于呼吸系统、循环系统的感染防控[10],也可用于减少恶性血液病患者导管相关血流感染[11],心血管重症监护病房导管相关血流感染[12]和降低脓毒血症病死率[13]等方面。除此之外,文献[14]报道,集束化干预在哮喘和心力衰竭等常见慢性疾病的质量改善方面具有重要的作用,主要是因为其专注于最佳标准和标准化的实践。在血液系统领域,研究报道HM患者高龄、中性粒细胞缺乏、大剂量化学治疗(化疗)是诱发HAI的主要危险因素[15],干细胞移植、入院时感染和住院时间延长均是HM患者HAI的危险因素和预测因素[16-18]。目前临床上对血液科HAI的研究集中在感染病原菌、高危因素等方面,尚未见运用集束化干预措施在血液科患者HAI发病率影响方面的研究。该研究针对血液科医生、护士、保洁员、患者及陪护等人员进行培训和任务分解,实现了医、护、患共同参与,将有循证依据的集束化干预措施进行了标准化实践和管理,取得了良好的成效。
目前,HM患者主要以化疗为主,经过多次化疗后,中性粒细胞数量下降或缺乏,机体的各项功能和免疫力也会随之下降。免疫抑制剂和放射治疗、化疗药物对患者呼吸道清除系统有一定的破坏力,导致患者对口腔和呼吸道分泌物的清除能力下降。呼吸道与外界环境直接接触,病原微生物易通过空气飞沫传播,导致患者呼吸道感染和口腔感染发生率增高[19]。研究[20]显示,急性髓系白血病诱导缓解期患者下呼吸道感染率可达70%~85%,甚至约30%患者死于下呼吸道感染。可见,预防下呼吸道感染对HM患者的重要性。
研究结果显示,干预后HM患者的HAI发病率由干预前的17.40%降至8.18%,提示集束化干预措施能有效降低HM患者HAI发病率,提升临床治疗的效果。通过对HM不同患者分析,发现淋巴瘤和急性白血病患者在集束化干预后,HAI发病率分别下降19.05%和11.15%,为进一步探讨淋巴瘤和急性白血病患者是从哪些方面降低HAI发病率,对两者干预前后的感染部位进行统计。淋巴瘤和急性白血病患者化疗期间易发生口腔感染,主要表现为口腔黏膜损伤,溃疡多发生在牙龈、口唇黏膜、颊黏膜、舌根部。此外,皮肤软组织感染也是该类患者常见的HAI,包括毛囊炎、疖、痈、淋巴管炎、急性蜂窝织炎、烧伤创面感染、手术后切口感染及压疮感染等。本研究结果显示,两者在呼吸系统、口腔和软组织等部位的感染构成比有所下降,而血流感染构成比上升;在急性白血病的HAI构成中发现抗菌药物相关性腹泻占比略有升高。提示这些集束化干预措施对预防外源性感染效果显著,对预防内源性感染无成效。
手卫生、环境清洁与消毒、织物管理等措施主要从切断接触传播途径来预防HAI。陪护探视人员的管理,患者分病室安置等措施在管理感染源保护易感人群方面,从空间上切断传播途径以预防HAI的发生。通过血液科的自查和感染管理科的日常监督,整体集束化干预措施的依从性有所提高,说明保洁员、护理员对HAI的理解和医务人员手卫生意识在逐渐提高。
本研究可能存在一定的局限性:(1)由于受该课题完成时间的限制,所收集到的样本量不充足,如对骨髓异常增生综合征和多发性骨髓瘤进行集束化干预的患者,其干预后HAI发病率较干预前下降,但差异无统计学意义;(2)HM患者疾病的发展阶段(初期、进展期、复发期),可能间接影响HAI发病率的统计。(3)由于HM的治疗方式和疾病的特点,使患者在治疗的过程中花费昂贵的医药费,经济的限制和中国传统的价值观,使许多危重和即将死亡的患者放弃治疗,因无法追踪这些患者,也会影响HAI发病率的统计结果以及其他感染的变化。下一步研究应扩大样本量,采用更加严谨的研究设计方法和有效的预防措施,减少内源性感染的发生,延长随访时间,进一步验证集束化干预预防HM患者HAI的可行性。
综上所述,通过对HM患者采取患者隔离安置、陪护探视人员限制管理、环境清洁消毒管理及手卫生等集束化干预措施,可有效切断外源性感染的发生,进而降低HM患者HAI发病率,该干预措施具有可行性及可操作性,值得临床推广应用。
| [1] |
Battaglini CL. Physical activity and hematological cancer survivorship[J]. Recent Results Cancer Res, 2011, 186: 275-304. |
| [2] |
Huoi C, Vanhems P, Nicolle MC, et al. Incidence of hospital-acquired pneumonia, bacteraemia and urinary tract infections in patients with haematological malignancies, 2004-2010:a surveillance-based study[J]. PLoS One, 2013, 8(3): e58121. DOI:10.1371/journal.pone.0058121 |
| [3] |
Khayr W, Haddad RY, Noor SA. Infections in hematological malignancies[J]. Dis Mon, 2012, 58(4): 239-249. DOI:10.1016/j.disamonth.2012.01.001 |
| [4] |
Thirumala R, Ramaswamy M, Chawla S. Diagnosis and management of infectious complications in critically ill patients with cancer[J]. Crit Care Clin, 2010, 26(1): 59-91. DOI:10.1016/j.ccc.2009.09.007 |
| [5] |
Liu H, Zhao J, Xing Y, et al. Nosocomial infection in adult admissions with hematological malignancies originating from different lineages:a prospective observational study[J]. PLoS One, 2014, 9(11): e113506. DOI:10.1371/journal.pone.0113506 |
| [6] |
张玲, 叶彦军, 姚亚洲. 恶性血液病患者粒细胞缺乏症并发感染的研究[J]. 临床医学研究与实践, 2018, 3(1): 12-13. |
| [7] |
De Angelis G, Murthy A, Beyersmann J, et al. Estimating the impact of healthcare-associated infections on length of stay and costs[J]. Clin Microbiol Infect, 2010, 16(12): 1729-1735. DOI:10.1111/j.1469-0691.2010.03332.x |
| [8] |
邓倩, 唐亦舒, 成倩, 等. 恶性血液病患者革兰阳性菌血流感染的影响因素及预后分析[J]. 中华医院感染学杂志, 2018, 28(24): 3771-3775, 3803. |
| [9] |
Inai K, Iwasaki H, Noriki S, et al. Frequent detection of multidrug-resistant pneumonia-causing bacteria in the pneumonia lung tissues of patients with hematological malignancies[J]. Int J Hematol, 2007, 86(3): 225-232. DOI:10.1007/BF03006925 |
| [10] |
张岚, 宋婷婷, 戴世英, 等. 集束化干预在护理中的应用研究进展[J]. 护士进修杂志, 2012, 27(22): 2038-2040. DOI:10.3969/j.issn.1002-6975.2012.22.009 |
| [11] |
敬雪明, 王川林, 刘娇, 等. 集束化干预对恶性血液病患者导管相关性血流感染的效果分析[J]. 川北医学院学报, 2017, 32(2): 288-291. DOI:10.3969/j.issn.1005-3697.2017.02.012 |
| [12] |
Hsin HT, Hsu MS, Shieh JS. The long-term effect of bundle care for catheter-related blood stream infection:5-year follow-up[J]. Postgrad Med J, 2017, 93(1097): 133-137. DOI:10.1136/postgradmedj-2016-134261 |
| [13] |
Gilbert JA. Sepsis care bundles:a work in progress[J]. Lancet Respir Med, 2018, 6(11): 821-823. DOI:10.1016/S2213-2600(18)30362-X |
| [14] |
Gómez-Angelats E, Sánchez C. Care bundles after discharging patients with chronic obstructive pulmonary disease exacerbation from the emergency department[J]. Med Sci (Basel), 2018, 6(3): pii:E63. |
| [15] |
罗洪强, 傅佳萍, 蒋景华. 恶性血液病患者医院感染危险因素及预防控制研究[J]. 中华医院感染学杂志, 2014, 24(5): 1171-1173. |
| [16] |
Tumbarello M, Spanu T, Caira M, et al. Factors associated with mortality in bacteremic patients with hematologic malignancies[J]. Diagn Microbiol Infect Dis, 2009, 64(3): 320-326. DOI:10.1016/j.diagmicrobio.2009.02.008 |
| [17] |
Wisplinghoff H, Seifert H, Wenzel RP, et al. Current trends in the epidemiology of nosocomial bloodstream infections in patients with hematological malignancies and solid neoplasms in hospitals in the United States[J]. Clin Infect Dis, 2003, 36(9): 1103-1110. DOI:10.1086/374339 |
| [18] |
Mühlemann K, Wenger C, Zenhäusern R, et al. Risk factors for invasive aspergillosis in neutropenic patients with hematologic malignancies[J]. Leukemia, 2005, 19(4): 545-550. DOI:10.1038/sj.leu.2403674 |
| [19] |
黄菁慧, 李传资, 郭萍, 等. 恶性血液病患者医院感染肺部CT影像学特征及对预后的评估[J]. 中华医院感染学杂志, 2017, 27(19): 4427-4430. |
| [20] |
袁萍, 张睿, 陈斗佳, 等. 急性髓系白血病诱导缓解期患者下呼吸道感染的危险因素分析[J]. 中华医院感染学杂志, 2017, 27(20): 4637-4640. |



