社区获得性肺炎(community-acquired pneumonia, CAP)是常见的呼吸道疾病之一,人群普遍易感,重症患者表现为以呼吸衰竭为主的多脏器功能损伤,危及生命。研究[1-4]表明,CAP的病死率与患者病情严重程度相关,重症监护病房(ICU)中重症CAP患者病死率达23%~47%。由于CAP病原菌构成复杂,新发、未知、耐药病原体层出不穷,使抗感染治疗的难度日益加大,造成巨大的医患压力。及时、正确的抗感染治疗是成功救治重症CAP的关键。在经验治疗效果不佳,致病病原体不明,常规微生物检测方法无阳性提示的情况下,如何快速、准确找到致病病原体,给予敏感的抗菌药物进行精准治疗,改善不良预后,是临床医生的迫切愿望。目前,常用的肺炎病原学检测方法,如形态学检查(涂片、透射电镜)、分离培养、免疫学方法各有优势,但对于重症感染病例,传统方法在检测时间、阳性率和特异性方面存在局限性。
二代测序技术(next-generation sequencing,NGS)又称下一代测序技术、高通量测序技术,以能一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志。宏基因组二代测序(metagenomic next-generation sequencing,mNGS)不基于培养,直接从临床标本中提取全部微生物的DNA。mNGS技术被广泛应用于探究疑难感染病的病原体。本文回顾本科呼吸ICU成功救治的3例重症CAP病例,分析基于mNGS技术在患者病原学诊断中的价值,同时结合文献和自身工作经验,总结该技术合理使用的基本步骤和临床意义。
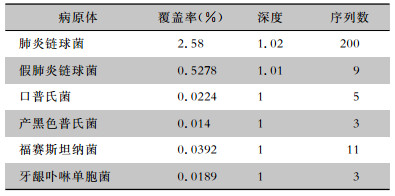
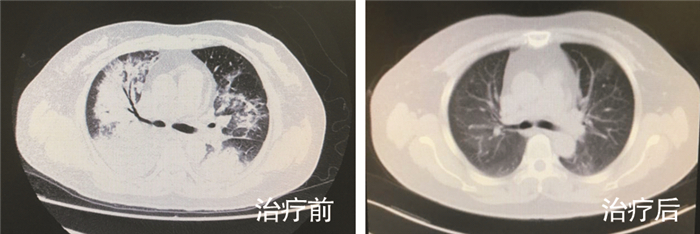
1 病历资料 1.1 病例1患者男性,40岁,既往体健。因“咳嗽、发热8 d,呼吸困难2 d,加重伴意识障碍1 d”经外院转入。体温最高39.5℃,咳少量黄脓痰,伴头痛、头晕、胸闷、四肢酸痛。外院CT提示右下肺实变,考虑CAP,予以阿莫西林0.5 g bid口服抗感染治疗,患者症状加重,复查CT示,双肺病变进展(图 1治疗前),后逐渐出现呼吸困难、意识模糊、休克。予以气管插管接有创呼吸机辅助通气、抗休克治疗,同时改抗感染药物为奥司他韦75 mg q12h口服, 联合美罗培南0.5 g q8h静滴。因病情危重,次日转入我院呼吸ICU。入院体格检查:T 39.5℃,P 114次/分,R 25次/分(有创呼吸机辅助通气,PCV模式,氧浓度70%),BP 80/60 mmHg(去甲肾上腺素0.6 μg/Kg·min静脉泵入升压),SPO2 93%。镇静状态,双肺呼吸音粗,右肺闻及湿啰音。血气分析提示,Ⅰ型呼吸衰竭。血常规:白细胞10.4×109/L,中性粒细胞9.8×109/L,淋巴细胞0.6×109/L,血小板72×109/L;降钙素原:32.5 ng/mL。心肌酶学轻度升高,呼吸道九联检(ELISA法检测支原体、衣原体、军团菌、腺病毒、呼吸道合胞病毒、甲型流感病毒、型流感病毒抗体IgM)、病毒全套(抗体IgM检测:巨细胞病毒采用化学发光法检测,EB病病毒、柯萨奇病毒、腺病毒、呼吸道合胞病毒、单纯疱疹病毒采用ELISA法检测)、鼻拭子甲乙型流感病毒抗原检测均阴性,结缔组织疾病相关检查阴性。入院诊断:(1)重症CAP、Ⅰ型呼吸衰竭;(2)脓毒症、脓毒症休克。予以美罗培南1 g q8h静滴,联合替加环素50 mg q12h静滴,经验性广覆盖抗感染治疗。行床旁支气管镜留取右下叶支气管分泌物送细菌+真菌涂片及培养,留取BALF送检mNGS。下呼吸道分泌物涂片提示革兰阳性菌,2 d后mNGS结果提示为肺炎链球菌(见图 2、表 1),后续细菌、真菌培养无阳性结果。考虑患者发病已10 d,前期广覆盖抗感染效果不佳,致病的链球菌可能为多重耐药菌,遂调整抗菌药物为利奈唑胺0.6 g q12h静滴,联合左氧氟沙星0.5 g qd静滴。治疗1周后血常规、降钙素原逐渐恢复正常,氧合指数好转,拔管撤机,好转出院。出院后口服左氧氟沙星0.5 g qd,1周后复查,肺部病变明显吸收(图 1治疗后)。
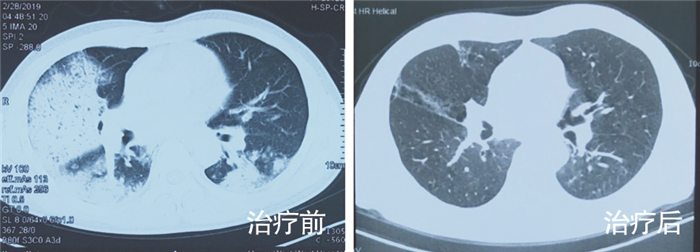 |
| 图 1 病例1治疗前后肺CT对比图 Figure 1 Lung CT imaging finding of case 1 before and after therapy |
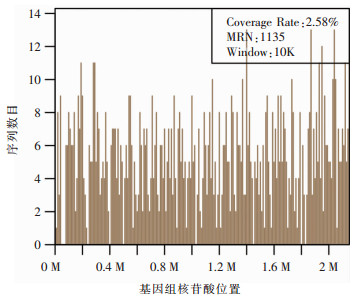 |
| 图 2 病例1二代测序示沿肺炎链球菌基因组分布的核苷酸序列 Figure 2 mNGS result of nucleotide sequences distributed along the genome of Streptococcus pneumoniae of case 1 |
| 表 1 病例1二代测序结果 Table 1 mNGS results of case 1 |
|
患者男性,49岁,既往体健。因“发热10 d,咳嗽、咳痰5 d,加重并呼吸困难2 d”由外院转入本院呼吸ICU。体温最高40.0℃,伴畏寒、寒战、全身肌肉酸痛,咳少量黄痰。外院胸片提示双下肺感染,考虑CAP,予以奥司他韦联合莫西沙星抗感染治疗,患者症状无缓解,持续高热,且出现进行性呼吸困难,血气分析提示Ⅰ型呼吸衰竭。因氧合持续下降,无创辅助通气无效,同时出现休克,遂改为气管插管接有创呼吸机辅助通气。入院体格检查:T 39.2℃,P 106次/分,R 35次/分,BP 93/58 mmHg,SPO2 91% (有创呼吸机辅助通气,PCV模式,氧浓度80%),双侧球结膜显著充血。双肺闻及散在啰音。血气分析提示Ⅰ型呼吸衰竭。入院诊断:重症CAP、急性呼吸窘迫综合征、多器官功能障碍综合征。予以亚胺培南/西司他丁0.5 g q6h静滴,联合奥司他韦150 mg q12h口服, 更昔洛韦0.3 g q12h静滴,经验性抗细菌和病毒治疗。当日即予以床旁支气管镜下留取右下叶支气管分泌物送细菌+真菌涂片及培养,留取支气管肺泡灌洗液(BALF)送检mNGS。同时完善其他检查,结果先后回报示:白细胞4.5×109/L,中性粒细胞4.0×109/L,淋巴细胞0.5×109/L,血小板74×109/L。降钙素原:0.4 ng/mL。心肌酶学:乳酸脱氢酶433 U/L,肌酸激酶372 U/L,肌红蛋白216.6 μg/L,均明显增高,呼吸道九联检、病毒全套、鼻拭子甲乙型流感抗原检测均阴性,结缔组织疾病相关检查阴性。复查肺部CT提示双下肺大面积实变(见图 3治疗前)。2 d后结果回报为腺病毒7型感染(见图 4),人类腺病毒7型覆盖率为98.21%,深度为14.51,序列数为467。因该病毒尚缺乏特异性治疗药物,遂停用前述抗病毒药物,保留亚胺培南/西司他丁抗继发细菌感染,予以大剂量丙种球蛋白静滴和强有力的支持治疗,后体温、心肌酶学指标逐渐正常,缺氧逐渐改善,复查影像学双下肺实变部分吸收。1周后予以拔管撤机,病情稳定出院。出院后随访2个月,双肺病变基本吸收(见图 3治疗后)。
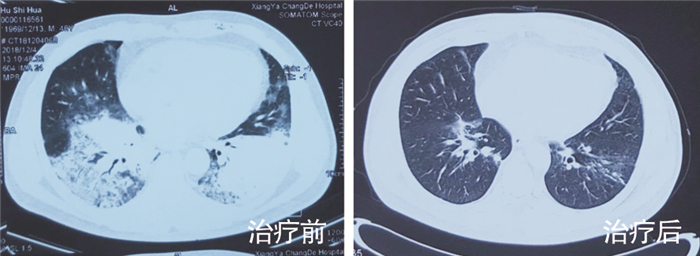 |
| 图 3 病例2治疗前后肺CT对比图 Figure 3 Lung CT imaging finding of case 2 before and after therapy |
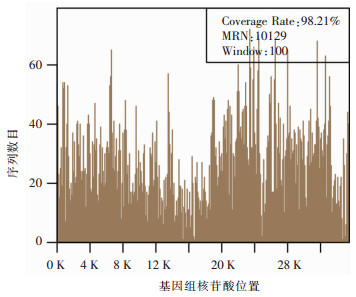 |
| 图 4 二代测序示沿人类腺病毒7型基因组分布的核苷酸序列 Figure 4 mNGS result of nucleotide sequences distributed along the genome of adenovirus type 7 |
患者女性,51岁,因“发热、咳嗽13 d,进行性呼吸困难10 d”转入本院呼吸ICU。体温最高达40.2℃,咳少量黄白痰,无畏寒、寒战。入院前外院查肺部CT,提示右下叶实变并少量胸腔积液,诊断CAP,先后予以头孢美唑、依替米星、亚胺培南/西司他丁、万古霉素抗感染治疗,症状逐渐加重。既往诊断甲状腺功能减退症,近期有家禽接触史。入院体格检查:T 38.8℃,P 107次/分,R 23次/分,BP 118/77 mmHg,SPO2 93% (鼻导管给氧,氧浓度45%),血气分析提示Ⅰ型呼吸衰竭,呼吸性碱中毒。入院诊断:(1)重症CAP、Ⅰ型呼吸衰竭、呼吸性碱中毒;(2)甲状腺功能减退症;(3)中度贫血(原因待查)。入院后完善抽血检查,同时予以床旁支气管镜下留取右下叶分泌物送检细菌真菌涂片及培养,留取BALF送检mNGS,同时予以经鼻高流量氧疗改善氧合。经验性给予莫西沙星0.4 g qd静滴抗细菌和非典型病原体,奥司他韦75 mg q12h口服抗病毒治疗。结果回报血常规:白细胞6.16×109/L,中性粒细胞5.34×109/L,淋巴细胞0.67×109/L,血红蛋白73 g/L。降钙素原1.83 ng/mL。呼吸道九联检:肺炎衣原体抗体IgM阳性,余阴性;病毒全套检测、鼻拭子甲乙流感抗原检测、结缔组织疾病相关检查均阴性。复查肺部CT提示,双肺大面积实变,范围较前明显进展(见图 5治疗前),双侧少量胸腔积液。mNGS结果回报为鹦鹉热衣原体感染(见图 6),鹦鹉热衣原体覆盖率为4.15%,深度为1.02,序列数为216。停用抗病毒药物,予以多西环素0.1 g q12h,联合莫西沙星静滴抗鹦鹉热衣原体治疗,2 d后体温恢复正常,Ⅰ型呼吸衰竭逐渐纠正。治疗10 d后复查肺部CT较前病变明显吸收,予以出院并嘱米诺环素0.1 g q12h口服1周。1个月后随访,肺部CT基本正常(图 5治疗后)。
 |
| 图 5 病例3治疗前后肺CT对比图 Figure 5 Lung CT imaging finding of case 3 before and after therapy |
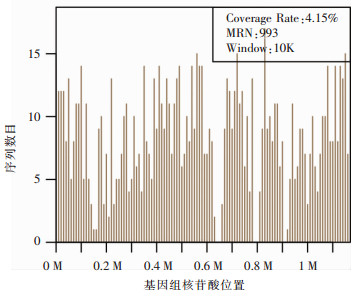 |
| 图 6 二代测序示沿鹦鹉热衣原体基因组分布的核苷酸序列 Figure 6 mNGS result of nucleotide sequences distributed along the genome of Chlamydia psittaci |
mNGS利用基因组学的研究策略,研究样品所包含的全部微生物的遗传组成及其群落功能,具有病原体阳性检出率高、快速等特点,此外还有如下优势:无偏倚;病原体广覆盖,灵敏度高;可深入提供病原体鉴定、分型、耐药基因和毒力因子分析;以序列为基础,可检测新发病原体,并进行溯源分类[5]。mNGS和常用的聚合酶链反应(PCR)、酶联免疫吸附测定法(ELISA)等方法最大的区别就是前者是“非靶向”,即对送检标本中所存在的病原微生物“一网打尽”,化“未知为已知”。而传统方法首先需要临床医生的经验,有针对性的选择一对一的病原检测项目,即“佐证经验诊断”,相对局限。研究发现mNGS对免疫抑制宿主感染的病原体诊断具有重要的参考价值,在病毒和细菌诊断方面与传统方法相比,阳性率高出3倍以上,且具有更高的阴性预测值[6],故mNGS技术被广泛应用于探究疑难感染病的病原体。2014年《新英格兰杂志》Wilson等[7]报道利用mNGS方法检测出脑脊液中钩端螺旋体,从而挽救一例不明原因脑积水8个月、先后使用38项感染病原检测且使用5种抗菌药物无效的联合免疫缺陷患儿的生命。其后对该病例的述评中,mNGS技术被提升到了“改变世界”的高度。程军等[8]研究表明,与传统培养方法相比,mNGS检测感染性心内膜炎瓣膜赘生物的灵敏度更高,时间短, 对培养阴性的疑似感染性心内膜炎的诊断和治疗有较大的应用价值。本科前期收治的不明原因重症肺炎病例, 应用BALF行mNGS检测, 快速诊断重症恙虫病立克次体感染后改用多西环素,成功救治患者[9]。NGS适用于常规检测结果为阴性的不明原因感染患者,对提高疾病诊断,特别是危重患者的诊断有很大的帮助[10],对类似本文中初始治疗失败的急危重症患者尤其适用。以上3例CAP病例均为免疫正常人群,起病急,迅速出现呼吸衰竭、循环衰竭,演变为重症肺炎,危及生命。但从流行病学、临床表现、实验室检查、影像学等方面并没有明显特征性,经验性抗感染治疗存在难度且效果不佳。病例1因早期使用广谱抗菌药物,常规下呼吸道分泌物培养即使为常见的链球菌也难以有阳性结果;病例2腺病毒感染未列入常规的血清学检查;病例3血清衣原体抗体IgM虽呈阳性,但此抗体在人体中存在时间1~3个月不等,故不能判断是否为现症感染,且不能明确其具体类型。通过同时送检BALF行mNGS检测,明确致病微生物,调整治疗方案,针对性使用抗感染药物,患者症状很快缓解,影像学显示病变吸收,达到临床治愈,效果优于经验性的“广覆盖”治疗。对BALF进行mNGS检测在上述患者的诊断中起到关键性的作用,敏感性高,确诊时间快,尤其在经典常规方法所不能检测的病原菌方面有独特优势,避免了长期过广、过多的使用抗菌药物[5],实现从“精准诊断”到“精准治疗”,从而缩短病程,提高救治成功率。mNGS技术为呼吸道微生物检测带来了重大变革, 能同时测定多种病原体的保守基因序列, 使对呼吸道微生物群落的研究达到前所未有的广度和深度[11]。研究[12]显示,通过mNGS早期明确诊断后,临床依据结果调整患者治疗方案,患者28、90 d生存率均有提高,90 d生存率从57.7%提高至83.3%。
2018版《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南》[13]对于mNGS的送检要求做了很好的诠释:审慎送检、规范流程、合理解读。笔者根据自身工作经验,结合国内外专家共识、专题讲座和专业文献等,将其流程概括如下,旨在帮助临床更好地开展mNGS检测工作。第一步:选择合适的病例和送检时机。2019年2月《宏基因组分析和诊断技术在急危重症感染应用的专家共识》[14]明确指出,mNGS在急危重症感染患者使用中的主要适应证包括:(1)病情危重需要尽快明确病原体;(2)特殊患者,如免疫抑制宿主,合并基础疾病,反复住院的重症感染者,需尽快明确病原体;(3)传统微生物检测技术反复阴性且治疗效果不佳;(4)疑似新发病原体,临床上提示可能有一定的传染性;(5)疑似特殊病原体感染;(6)长期发热和/或伴有其他临床症状、病因不明的感染。可将其概括为六字原则:“疑难、危重、特殊”。指南强调,以上情况尽快送检。第二步:选取合适的标本送检。对于单纯肺炎患者,选择经支气管镜操作采集的BALF标本,优于痰和血标本,或有条件时选择感染部位的穿刺组织标本,可减少上呼吸道和口腔定植菌的污染。对于合并脓毒症、血流感染的患者,可同时送检血清标本,提高阳性率。如考虑合并其他部位或器官感染,建议同时送检感染部位的标本,如合并颅内感染送检脑脊液、胸腔感染送检胸腔积液等。同时严格按照送检要求取材、处理和及时送检,选择有资质的机构进行检测。以上操作将极大程度提高检测的阳性率和准确性。第三步:结合临床合理解读报告。mNGS的特点是将标本中的微生物“一网打尽”,但非“一锤定音”。呼吸道非无菌腔道,定植菌多[15],检测报告解读相对复杂。如果是严格致病病原体,如结核分枝杆菌、诺卡菌、流感病毒、曲霉菌等,可考虑为致病菌。若是条件致病菌,如铜绿假单胞菌、鲍曼不动杆菌等,要结合序列数判定是否为致病菌。常见的口腔杂菌、呼吸道定植菌一般不考虑为致病菌,除非序列数特别高,尤其患者有吸入因素、肺部病变考虑出现肺脓肿时,要考虑为致病菌。病例1链球菌序列数明显高于其他几种细菌,以此鉴别致病菌和定植菌。若是罕见、特殊病原体,需要具体分析。病例2中的人类腺病毒7型和病例3中的鹦鹉热衣原体,二者均有较高的序列,同时结合流行病学和临床特点,考虑为致病菌。总之,临床医生需要紧密结合患者的临床特征和其他诊断资料,选择最可能、最符合临床实际的结果。
目前,mNGS也存在局限性,mNGS检测要求技术水平较高,存在去人源化难度大,对RNA病毒检出率低,真菌和结核菌提取DNA相对困难等问题;缺乏统一、完善的检测流程和质量控制标准[16];结果无法区分定植菌和致病菌,暂时还无法同时得到抗菌药物药敏结果,检测费用较高等。临床医生拿到mNGS检测结果时,应以患者为中心,结合病例临床特点和其他检验结果综合分析[16],动态观察疗效,真正做到“精准”诊疗,让患者获益,最大程度地改善患者预后。在遇到疑难、危重、复杂的肺部感染时,可尽早将mNGS与其他检测平行送检,让mNGS技术和其他病原体检测手段一起形成“快速诊断体系”,作为感染病原体诊断的重要组成和补充。
| [1] |
Mortensen EM, Restrepo M, Anzueto A, et al. Effects of guideline-concordant antimicrobial therapy on mortality among patients with community-acquired pneumonia[J]. Am J Med, 2004, 117(10): 726-731. DOI:10.1016/j.amjmed.2004.06.028 |
| [2] |
Restrepo MI, Mortensen EM, Velez JA, et al. A comparative study of community-acquired pneumonia patients admitted to the ward and the ICU[J]. Chest, 2008, 133(3): 610-617. |
| [3] |
Restrepo MI, Mortensen EM, Rello J, et al. Late admission to the ICU in patients with community-acquired pneumonia is associated with higher mortality[J]. Chest, 2010, 137(3): 552-557. |
| [4] |
Hraiech S, Alingrin J, Dizier S, et al. Time to intubation is associated with outcome in patients with community-acquired pneumonia[J]. PLoS One, 2013, 8(9): e74937. DOI:10.1371/journal.pone.0074937 |
| [5] |
Miao Q, Ma YY, Wang QQ, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67(Suppl 2): S231-S240. |
| [6] |
Parize P, Muth E, Richaud C, et al. Untargeted next-generation sequencing-based first-line diagnosis of infection in immunocompromised adults:a multicentre, blinded, prospective study[J]. Clin Microbiol Infect, 2017, 23(8): 574.e1-574.e6. DOI:10.1016/j.cmi.2017.02.006 |
| [7] |
Wilson MR, Naccache SN, Samayoa E, et al. Actionable diagnosis of neuroleptospirosis by next-generation sequencing[J]. N Engl J Med, 2014, 370(25): 2408-2417. DOI:10.1056/NEJMoa1401268 |
| [8] |
程军, 胡欢, 张思明, 等. 二代测序在检测感染性心内膜炎患者心脏瓣膜组织病原体中的应用[J]. 中国感染控制杂志, 2019, 18(4): 277-282. |
| [9] |
侯婕, 李园园, 胡成平, 等. 二代测序协助诊断恙虫病立克次体肺炎一例[J]. 中华结核和呼吸杂志, 2019, 42(7): 546-548. DOI:10.3760/cma.j.issn.1001-0939.2019.07.020 |
| [10] |
Schlaberg R, Chiu CY, Miller S, et al. Validation of meta-genomic next-generation sequencing tests for universal pathogen detection[J]. Arch Pathol Lab Med, 2017, 141(6): 776-786. DOI:10.5858/arpa.2016-0539-RA |
| [11] |
宋元林, 侯东妮. 社区获得性肺炎病原学检测新进展[J]. 中华全科医学, 2018, 16(9): 1530-1534. |
| [12] |
Xie Y, Du J, Jin W, et al. Next generation sequencing for dia-gnosis of severe pneumonia:China, 2010-2018[J]. J Infect, 2019, 78(2): 158-169. |
| [13] |
中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [14] |
宏基因组分析和诊断技术在急危重症感染应用专家共识组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 151-155. |
| [15] |
Man WH, de Steenhuijsen Piters WA, Bogaert D. The microbiota of the respiratory tract:gatekeeper to respiratory health[J]. Nat Rev Microbiol, 2017, 15(5): 259-270. DOI:10.1038/nrmicro.2017.14 |
| [16] |
瞿介明, 刘海霞. 病原体分子诊断技术在下呼吸道感染诊断中的应用及其价值[J]. 中华结核和呼吸杂志, 2019, 42(7): 486-489. DOI:10.3760/cma.j.issn.1001-0939.2019.07.003 |



