2. 中国医学科学院医学信息研究所 医疗器械与药物战略情报研究室, 北京 100020;
3. 郑州大学第一附属医院远程医学中心, 河南 郑州 450052;
4. 互联网医疗系统与应用国家工程实验室, 河南 郑州 450052;
5. 北京协和医院医学科学研究中心, 北京 100730
2. Medical Device and Drug Strategic Intelligence Research Office, Institute of Medical Information&Library, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100020, China;
3. Telemedicine Center of the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
4. National Engineering Laboratory for Internet Medical Systems and Applications, Zhengzhou 450052, China;
5. Medical Science Research Center of Peking Union Medical College Hospital, Beijing 100730, China
2019年底,新型冠状病毒肺炎(简称“新冠肺炎”)疫情在中国武汉暴发并迅速播散至全国。不断增加的患者人数使得医疗救治压力急剧增加,寻找安全有效的药物显得十分紧迫。由于药物研发周期长,很难在短时间内研发出针对新发突发传染病的特效药,因此主要采取目前已上市的药物在新冠肺炎患者中开展临床试验[1]。如何更高效、更精确地开展临床试验,引起了国家科技部门的重视[2]。现阶段我国已开展了数百项新冠肺炎的临床试验,本研究对已开展的临床试验特征进行分析,希望能够为临床试验设计者及政策制定者提供一定的参考。
1 资料与方法 1.1 资料来源从中国临床试验注册中心官网检索试验条件为“新型冠状病毒”或“新型冠状病毒肺炎”或“新冠病毒肺炎”或“新冠肺炎”或“SARS-CoV-2”或“2019-nCoV”或“COVID-19”的临床试验并下载。同时,从美国ClinicalTrials.gov官网检索试验条件为“2019-nCoV”或“2019 novel coronavirus”或“SARS-CoV-2”或“COVID-19”的临床试验并下载。检索时间截至2020年2月23日24点。
1.2 资料处理将两个网站下载的资料进行合并分析,使用DDA软件进行数据清洗。排除标准:(1)在中国(含港澳台)之外的其他地区开展的临床试验;(2)尚未获得伦理委员会批准;(3)研究对象为非新冠肺炎/非疑似新冠肺炎的患者。
1.3 统计分析应用SPSS18.0对临床试验的注册时间、注册量、参与机构、适应证、患者年龄、研究类型、招募人数、研究阶段、干预措施、经费来源等各特征变量进行统计描述,采用地理信息专业知识服务系统[3]进行参与机构地理分布分析。
2 结果 2.1 一般情况共检索到296项临床试验,其中中国临床试验注册中心248项,美国ClinicalTrials.gov官网48项。排除不符合要求的临床试验56项,其中法国2项,美国1项,尚未获得伦理委员会批准的39项,研究对象为非新冠肺炎/非疑似新冠肺炎的患者14项,共纳入240项临床试验。
2.2 注册量我国第1项新冠肺炎临床试验注册时间为2020年1月23日,是武汉市金银潭医院开展的一项评价洛匹那韦/利托那韦和干扰素-α2b联合治疗新冠肺炎武汉住院患者的疗效和安全性随机、开放、空白对照的研究(注册号ChiCTR2000029308),计划招募160人(试验组和对照组各80人)。自2月份开始,新冠肺炎临床试验注册量平均每天新增10项,其中2月18日单日注册量最大,为17项。见图 1。
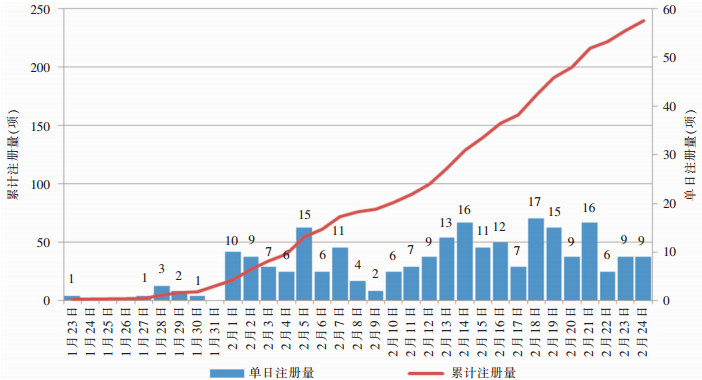 |
| 图 1 我国新冠肺炎临床试验注册量变化趋势图 Figure 1 Changing trend of COVID-19 clinical trial registration in China |
共纳入240项临床试验,其中单中心研究178项(74.17%)。参与机构数最多(23个)的是北京儿童医院,主导的一项儿童新冠肺炎临床特征和长期预后的研究(注册号NCT04270383),计划招募500例受试者。240项临床试验共涉及157个国内机构,包括医疗机构(122个)、高等学校(14个)、研究所(10个)、公司(8个)、协会(2个)、行政机构(1个)。157个机构分布在27个省/自治区/直辖市/特别行政区,其中前5名依次为北京、湖北、广东、浙江、上海。见表 1。
| 表 1 我国新冠肺炎临床试验参与机构及地理分布居前12位的基本情况 Table 1 Participating institutions of COVID-19 clinical trials and basic information of the top 12 geographical distribution in China |

|
240项临床试验适应证均为新冠肺炎患者或疑似新冠肺炎患者,其中19项(7.92%)为重型/危重型,14项为轻型/普通型(5.83%),3项为疑似病例(1.25%),其余204项(85.00%)未明确分型。240项临床试验患者年龄分布为全人群的16项(6.67%),儿童(0~14岁)有4项(1.67%),成年人(15岁~64岁)有22项(9.16%),成年人/老年人(≥65岁)有153项(63.75%),年龄不详有45项(18.75%)。
2.5 研究类型及招募人数临床试验研究类型主要以干预性研究为主(75.42%),其次为观察性研究(24.58%)。干预性研究的干预措施依次为药物(68.51%)、生物制品(19.89%)、其他(10.50%)、器械(1.10%)。干预性研究和观察性研究平均招募人数分别为100人和200人。见表 2。
| 表 2 我国新冠肺炎临床试验研究类型及招募人数统计 Table 2 Study types and statistics of recruitment numbers of COVID-19 clinical trials in China |
|
181项干预性研究所处阶段以0期(70项)和Ⅳ期(49项)为主,其中药物干预的临床试验所处阶段主要为Ⅳ期(44项)和0期(39项),生物制品及其他临床试验所处阶段主要均为0期(15项和16项)。见表 3。
| 表 3 我国新冠肺炎干预性研究所处阶段分布 Table 3 Distribution of COVID-19 intervention study stage in China |
|
干预性研究的干预措施包括64种药物(中药和化学药),28种生物制品,2种器械,16种其他治疗。其中药物中药23种和化学药41种,主要包括抗疟药、抗流感药、抗艾滋病药、抗病毒性肝炎药物、其他抗病毒药、抗菌药物、糖皮质激素、单抗、免疫调节剂等,生物制品主要包括单抗、免疫制剂、干细胞、血液制品、疫苗等,器械包括高流量辅助可视软镜和氢氧气雾化机,其他治疗主要包括肠道菌群移植、康复治疗、免疫治疗、心理干预、中医疗法等。见表 4。
| 表 4 我国新冠肺炎临床试验主要干预措施 Table 4 Main intervention measures for COVID-19 clinical trials in China |

|
240项临床试验资助经费来源依次为自筹60项(25.00%),未知51项(21.25%),各级政府(包括国家中医药管理局、省发改委、省科技厅、省卫健委、市科技局)40项(16.67%),医疗机构29项(12.08%),企业17项(7.08%),国家级科研项目(包括国家自然科学基金、国家重点研发计划、国家科技重大专项)13项(5.42%),高等学校13项(5.42%),科技部12项(5.00%),省级科研项目(包括省重点研发计划、省自然科学基金、中原学者科学家工作室项目)3项(1.25%),协会2项(0.83%)。
3 讨论高质量的临床试验需要科学的设计、严格的质控、大规模的人群、长期的跟踪研究和多中心共同参与,具有技术难度高、资金需求量大、质控困难、管理协调工作量大等特点[4]。国际上对临床试验多采取注册制,2007年5月,世界卫生组织国际临床试验注册平台正式运行,标志着全球临床试验注册制度建成运行。同年,美国食品药品管理局2007年修正法案(FDAAA)阐明了临床试验注册要求并对违规行为实施处罚[5]。目前,我国临床试验也主要采取注册备案制,注册平台包括中国临床试验注册中心、药物临床试验登记和信息公示平台[6]、医学研究登记备案信息系统[7]等。国家出台的临床试验管理规定的文件包括《药物临床试验质量管理规范》《医疗器械临床试验质量管理规范》《药物临床试验伦理审查工作指导原则》等[8],临床试验审批流程主要涉及到药品监督部门、卫生健康主管部门的监管和伦理审查[9]。
本研究共纳入新冠肺炎临床试验240项,自2月1日开始注册量平均每天新增10项,共有157个国内机构参与,说明目前我国开展的新冠肺炎临床试验数量多、增长快,参与机构多样化,我国医学科研机构临床试验的意识较强,但是存在合作机构较少,招募人数不尽合理,干预措施和试验药物不聚焦等问题,需要加强对我国新冠肺炎临床试验的监管。2020年2月28日在国务院联防联控机制新闻发布会上,科技部官员指出新冠肺炎临床试验太多,可能存在浪费,国务院应对新冠肺炎疫情联防联控机制科研攻关组(下文简称“科研攻关组”)针对这些问题于2月24日印发了《关于规范医疗机构开展新型冠状病毒肺炎药物治疗临床研究的通知》(以下简称《通知》)。《通知》对试验药物的选择、药品剂量、责任主体性质、主要负责人的职称等做出了明确的规定,对提高新冠肺炎临床试验的规范性起到一定的作用。4月3日,科研攻关组发布关于抓好《通知》落实工作的函,明确规定临床研究实行医疗机构立项审核制度,由核发其医疗机构执业许可证的卫生健康行政部门进行临床研究备案。
3.1 我国科研机构反应迅速,参与机构地理分布与疫情严重程度相关我国第1项新冠肺炎临床试验注册日期为2020年1月23日,当时国内共确诊571例(湖北确诊444例)[10],而美国第1项新冠肺炎临床试验(注册号:NCT04280705)注册日期为2020年2月21日,当时美国累计确诊病例数仅34例。从注册反应速度上来看,中国稍慢于美国,但可能与两国疫情进展速度不同有关。随着我国疫情快速进展和确诊病例数的增加,国内新冠肺炎临床试验注册量快速增加,科研机构迅速作出反应,2020年2月18日单日注册量最高达17项。参与临床试验的机构主要分布在北京、湖北、广东、浙江、上海,其中湖北、广东、浙江累计确诊病例数均排全国前5位,临床试验参与机构地理分布与疫情严重程度相关。
3.2 临床试验机构合作少,应加强临床试验机构间的合作多机构合作是提高临床试验研究结果可信度的重要途径[11],开展多中心临床试验可以提高临床试验效率。本研究中仅25.83%的临床试验为多中心研究,合作机构数最多的为北京儿童医院主导的儿童新冠肺炎的观察性研究,共有全国各地23所儿童医院参与,计划招募500例患者。由于儿童新冠肺炎感染患者较少,20岁以下新冠肺炎患者约占2.1%[12],按全国2月24日现存5万患者来估算,仅有1 000多例儿童患者。目前国内新冠肺炎临床试验机构之间的合作较少,应加强临床机构之间的合作。欧美等发达国家通过成立临床医学研究网络组织或联盟,采取合作的方式招募患者,通常由研究水平高的医院设计研究方案,面向临床研究网络内医院招募患者[13]。3月20日,世界卫生组织宣布了一项名为“团结”(SOLIDARITY)的大型全球试验[14],以确定新冠肺炎的有效治疗药物,来自不同国家的医院均可自愿加入。当前,我国也已布局建设50家国家临床医学研究中心,依托中心构建协同网络,相信将对提高临床机构之间的合作起到积极地推动作用。
3.3 招募人数不尽合理,应加强对临床试验科学性的指导本研究分析发现目前新冠肺炎临床试验招募人数不合理,存在过多或过少的问题。研究[15]推算以新冠肺炎轻症患者为研究对象时,若想将治愈率从目前90%提高到95%,则每项临床试验需要招募近1 000例患者;将重症转化率从最高20%降低至15%,则需要800~1 000例患者。如果以重症患者为研究对象,将病死率从6%降低到3%,理论上每项临床试验至少需要800例患者,而本研究结果显示181项干预性研究平均招募人数为100人,但少数临床试验计划招募人数竟高达10万人。随着新冠肺炎疫情逐步被控制,部分临床试验将面临无法招募到足够患者的窘境,因此在试验设计时应加强对临床试验科学性的指导。
3.4 研究阶段不尽科学, 应加强对临床试验的科学性的审查通常药物需要通过Ⅰ期~Ⅲ期临床试验才能提交上市申请,Ⅳ期为上市后临床试验。《通知》规定“所使用的药品应为已上市药品”,但并未对生物制品作出限制。本研究发现有70项临床试验注册阶段为0期(预试验和探索性临床试验),有2项生物制品处在Ⅰ期临床试验阶段,分别为间充质干细胞和NK细胞;0期和Ⅰ期临床试验距离上市还有很长的时间,可能无法快速应用于新冠肺炎的临床救治。此外,分析发现抗疟药“羟氯喹”既有Ⅲ期,又有Ⅳ期临床试验,其中4项为Ⅳ期, 均在中国临床试验注册中心注册,1项为Ⅲ期, 在美国ClinicalTrials.gov注册。2007年的《药品注册管理办法》中规定“对已上市药品增加新适应证的药品注册按照新药申请的程序申报”。2020年的《药品注册管理办法》[16]规定获准上市的药品增加适应证(或者功能主治)需要开展药物临床试验的,应当提出新的药物临床试验申请。羟氯喹作为抗疟药,既往的适应证中并没有病毒感染或肺炎,因此在治疗新冠肺炎的临床试验应从Ⅱ期或Ⅲ期开始,验证该药治疗新增适应证的有效性。新的《药品注册管理办法》规定“在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,国家药品监督管理局可以依法决定对突发公共卫生事件应急所需防治药品实行特别审批”,同时也应该加强对临床试验的科学性审查。
3.5 部分受试药物选择缺乏循证依据,应加强对试验项目受试药物的监管新冠肺炎作为一种新发突发传染病,人们对其认识较少,主要借鉴2003年严重急性呼吸综合征(SARS)以及2013年中东呼吸综合征(MERS)的防控经验,治疗方面亦是如此,主要采取支持治疗以及抗病毒治疗[17]。已有证据[18---------19]显示一些药物可能对新冠肺炎有效,如瑞德西韦与单克隆抗体组合用药、阿比多尔+洛匹那韦/利托那韦+重组干扰素α-2b联合用药[20]、磷酸氯喹、人脐带间充质干细胞(hUCMSCs)[21]、法匹拉韦、美普珠单抗[22]等。国家在新冠肺炎诊疗方案中对磷酸氯喹、阿比多尔、利巴韦林、洛匹那韦/利托那韦联合、托珠单抗等药物或生物制品进行了推荐,提出可以采用康复者血浆治疗、血液净化治疗、中医治疗、肠道微生态调节等方法,原则上不使用抗菌药物和糖皮质激素。
本研究显示新冠肺炎临床试验干预措施种类多、不聚焦,不仅包含药物,还有医疗器械、生物制品及其他治疗措施,仅药物就有64种,部分干预措施缺乏循证依据。有学者对中药临床试验存在质疑,因为中药成分复杂。虽然指南和研究证据均不推荐使用糖皮质激素[23],但仍有5项糖皮质激素治疗新冠肺炎的临床试验。
《通知》规定开展临床试验的相关药品应在体外试验中对新冠病毒具有明确的抑制作用,或动物实验结果支持开展新冠肺炎治疗临床研究。但是有学者[23]指出SARS-CoV-2的传染性极强,不能在普通实验室培养,需要在生物安全水平为P3及以上的实验室方可进行,目前国内P3实验室并不多。目前缺乏合适的动物模型及符合资质的试验条件成为抗新冠病毒临床前研究的主要难点,也为临床试验药物的遴选增加难度。关于抓好《通知》落实工作的函中规定,未纳入诊疗方案的“老药”,不宜涉及直接在临床大规模使用。有明显毒副作用或无明确治疗效果的临床研究,科研攻关组应及时要求相关医疗机构终止研究。
3.6 参与机构及经费来源多样化,应加强临床医学科研攻关支持不同国家开展临床试验的主要机构类型不同,国内临床试验主要开展机构为大学,而英国和日本主要来自公司, 美国开展临床试验的主要为大学及研究所[24]。本研究显示新冠肺炎临床试验申请机构中医疗机构最多,其次为高等学校和研究所,申请机构前12名中只有1家为公司,后期该公司注册的5项临床试验均被撤销,可能与《通知》要求“医疗机构是临床研究的责任主体”有关。《通知》的这一规定可能会一定程度地影响公司参与新冠肺炎临床试验的积极性。从经费来源来看,临床试验以研究机构自筹为主(25.00%),各级政府也给与了一定的经费支持(16.67%),国家级/省级科研项目支持不多(5.42%),提示国家应该加强新冠肺炎临床医学科研攻关的支持,同时通过经费管理加强对临床试验项目规范性的管理。
| [1] |
邹全明, 李海波, 曾浩. 新型冠状病毒肺炎治疗药物的研究现状以及对策建议[J]. 第三军医大学学报, 2020, 42(9): 861-866. |
| [2] |
刘昌孝, 王玉丽, 闫凤英. 认识新型冠状病毒肺炎, 关注疫情防控药物研发[J]. 中国抗生素杂志, 2020, 45(2): 93-102. |
| [3] |
地理信息、专业知识服务系统[EB/OL].[2020-03-05].http://kmap.ckcest.cn/otherSearch/searchztsjGISPage.
|
| [4] |
殷环, 陈娟, 严舒, 等. 我国国家临床研究网络组织结构研究[J]. 科技管理研究, 2018, 38(8): 110-114. |
| [5] |
唐亚岚, 靳红卫. 美国食品药品监督管理2007修正案简介及其启示[J]. 中国药业, 2008, 17(12): 9-10. |
| [6] |
国家药品监督管理局.国家食品药品监督管理总局实施药物临床试验登记与信息公示[EB/OL].(2013-09-18)[2020-02-24].http://www.nmpa.gov.cn/WS04/CL2168/329243.html.
|
| [7] |
高东平, 杨渊, 孙晓北, 等. 医学研究登记备案信息系统设计与应用[J]. 医学信息学杂志, 2016, 37(1): 40-42. |
| [8] |
程雅倩, 何文. 我国药物临床试验的开展和监管体系现状[J]. 中国药师, 2019, 22(6): 1132-1138. |
| [9] |
国家药品监督管理局.药物临床试验机构管理规定(一)[EB/OL].(2019-12-17)[2020-02-24].http://www.nmpa.gov.cn/WS04/CL2080/372192.html.
|
| [10] |
中华人民共和国中央人民政府.2020年1月23日新型冠状病毒感染的肺炎疫情情况.[EB/OL].(2020-01-23)[2020-02-24].http://www.gov.cn/xinwen/2020-01/23/content_5471771.htm.
|
| [11] |
殷环, 张婷, 孙晓北, 等. 我国临床试验机构合作情况研究[J]. 医学信息学杂志, 2018, 39(9): 59-63. |
| [12] |
中国疾病预防控制中心新型冠状病毒肺炎应急响应机制流行病学组. 新型冠状病毒肺炎流行病学特征分析[J]. 中华流行病学杂志, 2020, 41(2): 145-151. |
| [13] |
殷环, 孙晓北, 杨渊, 等. 典型国家临床研究网络运行机制研究[J]. 中华医学科研管理杂志, 2020, 33(1): 75-78. |
| [14] |
Kupferschmidt K, Cohen J. WHO launches global megatrial of the four most promising coronavirus treatments[EB/OL]. (2020-03-22)[2020-03-25].https://www.sciencemag.org/news/2020/03/who-launches-global-megatrial-four-most-promising-coronavirus-treatments.
|
| [15] |
陈峰, 郝元涛, 张志杰, 等. 关于科学、规范、有序地开展新型冠状病毒肺炎相关临床试验的建议[J]. 中华流行病学杂志, 2020, 41(3): 301-302. |
| [16] |
国家市场监督管理局.药品注册管理办法.[EB/OL].(2020-01-22)[2020-02-24].http://www.gov.cn/zhengce/zhengceku/2020-04/01/content_5498012.htm.
|
| [17] |
周娟, 李丹, 龙云铸. 新型冠状病毒(2019-nCoV)相关研究进展[J]. 中国感染控制杂志, 2020, 19(3): 288-292. |
| [18] |
Cohen J. Can an anti-HIV combination or other existing drugs outwit the new coronavirus?[EB/OL]. (2020-01-27)[2020-02-24]. https://www.sciencemag.org/news/2020/01/can-anti-hiv-combination-or-other-existing-drugs-outwit-new-coronavirus.
|
| [19] |
Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020, 382(10): 929-936. |
| [20] |
魏茹楠, 郑南红, 蒋贤高, 等. 浙江省新型冠状病毒肺炎患者早期阿比多尔+洛匹那韦/利托那韦+重组干扰素α-2b联合抗病毒治疗的多中心、前瞻性研究[J]. 中华临床感染病杂志, 2020, 13. DOI:10.3760/cma.j.cn115673-20200224-00069 |
| [21] |
Liang B, Chen JH, Li T, et al. Clinical remission of a critically ill COVID-19 patient treated by human umbilical cord mesenchymal stem cells[J/OL]. ChinaXiv. (2020-02-27)[2020-03-25]. http://chinaxiv.org/abs/202002.00084.DOI: 10.12074/202002.00084.
|
| [22] |
Bian HJ, Zheng ZH, Wei D, et al. Meplazumab treats COVID-19 pneumonia: an open-labelled, concurrent controlled add-on clinical trial[J/OL]. medRxiv. (2020-03-24)[2020-03-25]. https://www.medrxiv.org/content/10.1101/2020.03.21.20040691v1.DOI:10.1101/2020.03.21.20040691.
|
| [23] |
Fan HH, Wang LQ, Liu WL, et al. Repurposing of clinically approved drugs for treatment of coronavirus disease 2019 in a 2019-novel coronavirus-related coronavirus model[J]. Chin Med J (Engl), 2020, 133(9): 1051-1056. |
| [24] |
中国医学科学院. 中国医学科技发展报告2018[M]. 北京: 科学出版社, 2019: 77-93.
|



