2. 深圳前海旺盛医疗科技有限公司, 广东 深圳 518028;
3. 北京大学深圳医院口腔医学中心, 广东 深圳 518036
2. Vigorous Medtec Shenzhen Co. Ltd., Shenzhen 518028, China;
3. Stomatology Medical Center, Peking University Shenzhen Hospital, Shen-zhen 518036, China
呼吸道传染病患者咳嗽、打喷嚏等动作可以释放出大量含有致病微生物的唾液颗粒,较大粒径的唾液颗粒成为飞沫,随呼出气流污染周边环境物体表面,较小粒径的唾液颗粒在室内空气中迅速蒸发至平衡状态,成为更小粒径的飞沫核,形成呼吸道传染病空气传播的来源[1]。研究[2]显示,初始粒径45 μm以下唾液颗粒在室内环境下都有成为呼吸道传染病空气传播的飞沫核,被易感人群吸入并引起感染发生的可能。
唾液颗粒飞沫核是否引起继发感染还取决于所携带的致病微生物的种类、数量、生物活性、室内微小气候及易感人群个体状况等因素。由于生物安全方面的原因,唾液颗粒飞沫核携带致病微生物经空气传播并导致感染的过程无法在实地研究中重现,如能将使用小型人工气候舱对噬菌体悬浮液滴生物活性进行研究[3-5]的方法应用到实地研究领域,将显著改善经空气传播传染病的防控及应用技术[6]。本研究在成功使用具有唾液相似非挥发性组分模拟唾液,采用可控方式制造出与咳嗽呼出唾液颗粒具有类似粒径分布的液滴谱系的基础上[7],在模拟唾液中加入生物安全等级Ⅰ级的大肠埃希菌噬菌体T1, 在病房机械通风条件下模拟唾液雾化,人工模拟咳嗽产生的飞沫,采集空气中标本检测大肠埃希菌噬菌体T1,研究咳嗽产生的飞沫核在病房内经空气传播后携带病毒的存活量,以建立评估呼吸道传染病在病房内经空气传播引起感染风险的现场试验研究方法。
1 材料与方法 1.1 试验设施设备现场试验在医院病房内进行,病房大小为6.6 m×5.9 m×2.35 m (长×宽×高),采用机械通风方式,室内气流组织形式为典型顶送顶回形式(见图 1),两个四向散流送风口及两个回风口均对称设置在病房吊顶上,送风口及回风口大小均为0.6 m×0.6 m, 试验中病房总送风量设定为1 060 m3/h,约相当于换气11.6次/h,或每换气1次需要311 s,室内温度控制在21.5℃,湿度为60.0%。
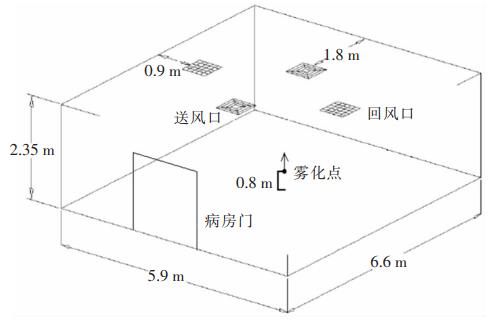 |
| 图 1 现场试验中医院病房大小及送回风口位置示意图 Figure 1 Field experiment schematic diagram of ward size and location of return air inlets and exhaust outlets in hospital ward |
模拟唾液由30 g胰蛋白胨大豆肉汤粉末(Oxoid CM0129)、58 g胰蛋白胨(Oxoid LP0042)粉末加1 L蒸馏水配制而成,具有与人体唾液相近含量的非挥发性物质[8]。模拟唾液雾化装置由压缩空气瓶、装有模拟唾液的压力罐(Spraying Systems, 22140-2-304SS)、管线、气路流量计(GILMONT Accucal®)、液路流量计(Cole-Parmer®)、计时电子触发开关(Spraying Systems, 11438-21A)和雾化喷嘴(Spray System Inc., B1/4JN+SU1A)等组成,与相关研究[7]使用的雾化装置相同。现场试验中雾化点选择在病房的几何中心点,雾化喷嘴安置在距离病房地面高度0.8 m,喷嘴方向垂直朝上,模拟患者躺在病床上并向上咳嗽。
现场试验中雾化喷嘴由计时电子触发开关控制,每次喷雾1 s以模拟1次咳嗽,试验中将压缩空气流量控制在0.4 L/min,模拟唾液流量控制在0.3 mL/s,使每次喷雾排出的气体量与一次咳嗽排出的气体量[9-10]相近。为能采集到足够数量的不同粒径段雾化液滴用于统计分析,每次雾化的模拟唾液量约为咳嗽产生飞沫液体量[11]的8倍,相当于同时咳嗽8次。
每次喷雾后使用粒子计数器(GRIMM model 1.108)记录检测点不同粒径段空气粒子数量变化数据。粒子计数器经过厂商检定,检测粒径范围为0.3~20 μm,并被分成16个粒径段分别记录统计。每次喷雾后收集检测点粒子数量变化数据360 s,与病房空气1次换气所需时间相当。由于病房机械通风系统的回风管路安装了高效过滤器,因此,假定喷雾产生的粒子不能通过机械通风系统循环进入病房空气中,而试验中病房与外环境的空气交换只能通过机械通风系统。
喷雾形成的液滴所携带的大肠埃希菌噬菌体通过使用400孔单级安德森采样器(SKC Quick Take-30)在检测点采集空气标本获得。试验中单极安德森采样器由电控开关控制,采集粒径范围0.65~23 μm的雾化液滴。安德森采样器经过厂家检定和实验室校准,采样空气流量稳定在28.3 L/min。每次喷雾后在每个检测点连续采集6次空气标本,每次采样持续1 min。采样过程中安德森采样器内安放1只在实验室预先配制的培养皿,采样后培养皿立即送实验室进行培养。
检测在病房一角四分之一区域完成,控制及喷雾装备设置在检测区域对角区域,以减少对试验的干扰,采样人员佩戴呼吸器以避免吸入雾化颗粒。试验中病房内除试验装备外未设置病床和医疗设备等其他物品,使雾化液滴在病房空气中的扩散仅受机械通风气流的影响.试验过程共设置4个检测点,离喷嘴的水平距离均为2 m,各检测点在坐标中相对位置如图 2所示,其中P1和P2点位于送风口下方,离病房地面高度分别为1.7、1.1 m,P3和P4点位于回风口下方,离病房地面高度分别为1.7、1.1 m。检测点离病房地面高度的选择是模拟访客站立或坐下时的呼吸带高度。
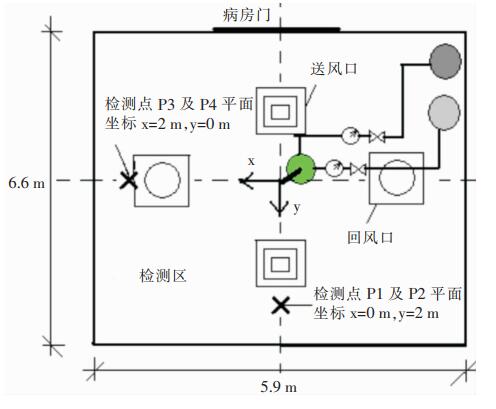 |
| 图 2 现场试验医院病房检测点位置平面示意图 Figure 2 Schematic diagram of detection points in field experiment in hospital ward |
大肠埃希菌噬菌体模拟唾液的制备:将配制好的1 L模拟唾液肉汤121℃高压蒸汽灭菌15 min,冷却至室温后加入少量大肠埃希菌冻干粉(ATCC 11303),置37℃恒温水浴摇床中培养8 h,取1/4含菌肉汤用于安德森采样器培养皿制作,在其余含菌肉汤中加入大肠埃希菌噬菌体(ATCC 11303-B1,为冷冻成品)后置37℃恒温水浴摇床中再培养8 h,待大肠埃希菌噬菌体充分复制后加入试管中离心,离心后取上清液使用0.22 μm的滤膜过滤,滤液中大肠埃希菌噬菌体含量经浓度滴定检测达到108 PFU/mL时,置4℃保存备用。每次现场喷雾试验前后都对模拟唾液肉汤中的大肠埃希菌噬菌体含量进行浓度滴定检测,以计算雾化液滴中初始大肠埃希菌噬菌体携带量。
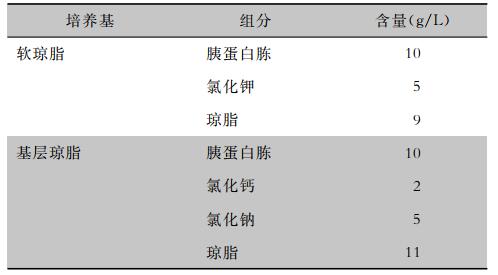
空气采样平皿的制备:安德森采样器培养皿内包含软琼脂和基层琼脂双层琼脂,双层琼脂的组分及含量见表 1。配制中先将基层琼脂加入1 L蒸馏水中,121℃高压蒸汽灭菌15 min,取灭菌平皿,每皿倒入基层琼脂10 mL,置室温中待基层琼脂凝固。将软琼脂加入1 L蒸馏水,121℃高压蒸汽灭菌15 min,冷却至45℃,将软琼脂装入10 mL的灭菌试管,每支试管内加入0.5 mL制作大肠埃希菌噬菌体模拟唾液中留取的含菌肉汤,再倒入含基层琼脂培养皿内,摇动培养皿以使软琼脂均匀覆盖基层琼脂表面,待软琼脂凝固将培养皿用于现场空气采样。每次采样后的培养皿于37℃培养8 h,采样过程中雾化液滴携带大肠埃希菌噬菌体沉降在培养皿软琼脂上并侵入大肠埃希菌宿主细胞进行复制,培养过程中宿主细胞死亡后细胞壁破裂释放大量新噬菌体,继续侵蚀周边大肠埃希菌细胞并最终在培养皿软琼脂表面形成空斑,因此雾化液滴经空气扩散后所携带的大肠埃希菌噬菌体数量可以通过计算空气采样培养皿软琼脂表面的空斑数量获得。由于自然空气没有大肠埃希菌噬菌体,空气中大肠埃希菌噬菌体本底数量可以忽略不计。
| 表 1 空气采样器培养皿内培养基组分及含量 Table 1 Components and content in culture medium of Petri dish of air samplers |
|
在典型室内空气相对湿度范围内,呼吸道分泌物由于含有糖蛋白和无机盐离子,其雾化液滴经蒸发作用后仍保留一定比例的水份,此时液滴表面水汽蒸发和凝结作用达到平衡形成液滴核。雾化液滴表面蒸发速率可以通过经典液滴表面边界层水汽压平衡扩散梯度公式计算[12],雾化液滴粒径变化时间函数d(t)表达如下:
| $ d(t) = \sqrt {d_0^2 - \frac{{8DM}}{{R\rho T}}({P_\infty } - {P_{\rm{s}}})t} $ | (1) |
式中d0是雾化液滴初始直径, D是水汽分子扩散率,M是水的分子量,R是通用气体常数,ρ是空气密度,T是空气温度,P∞是空气中的水汽压,Ps是饱和水汽压。由于雾化液滴非挥发性物质组分较为复杂,公式(1)中的热力学参数难以确定,使用质量平衡原理假定完全脱水的液滴与其初始状态的非挥发性物质的质量相同,蒸发平衡状态的液滴核粒径(deq)与其初始粒径(d0)关系的简化计算方法如下[11]:
| $ {d_{{\rm{eq}}}} = ( \frac { C _ { {\rm{n}} } } { \rho _ { {\rm{n}} } } ) ^ { 1 / 3 } d _ { 0 } $ | (2) |
式中Cn是呼吸道分泌物中非挥发性物质的质量浓度,Cn=88 g/L[8], 如果使用水的密度ρn=1 000 g/L代表雾化液滴蒸发平衡时的密度[11],咳嗽呼出飞沫蒸发平衡后的直径约为初始直径的0.44倍,此项假设建立在纯水颗粒蒸发的基础之上,未考虑飞沫中非挥发性物质对粒径变化的影响[1],对于雾化液滴蒸发平衡后液滴核的粒径计算,进而计算液滴核所携带大肠埃希菌噬菌体存活函数有一定影响。
1.4 数据统计分析使用Sigmaplot V11(SPSS Inc)统计分析数据。
2 结果 2.1 蒸发作用下雾化液滴的粒径变化本研究假设雾化液滴蒸发平衡后液滴核的粒径是初始粒径的0.4倍,则液滴核的体积是雾化液滴初始体积的6%,按此假设咳嗽飞沫不同粒径段颗粒的平均粒径及其蒸发平衡后的粒径见表 2。
| 表 2 咳嗽飞沫不同粒径段数量[12]及其蒸发前后平均粒径 Table 2 The numbers of cough droplets of different size and the average size before and after evaporation |
|
可吸入粒径范围的液滴核达到蒸发平衡所需要的时间很短,如按照公式(1)计算45 μm初始粒径的水滴完成蒸发的时间小于1 s。蒸发平衡后空气中的液滴核在重力沉降、与其他空气悬浮粒子凝结或机械通风系统作用下去除。计算检测到的液滴核数量时还要剔除空气中本底粒子数,每次现场试验前使用粒子计数器记录10 min内病房空气中本底粒子数量变化,检测结果显示病房空气中本底粒子的平均粒径是0.84 μm,本底粒子浓度是58 725个/L。见图 3。在图 2检测点粒子计数器记录的空气粒子数减去空气本底粒子数后即为该检测点的液滴核数量。
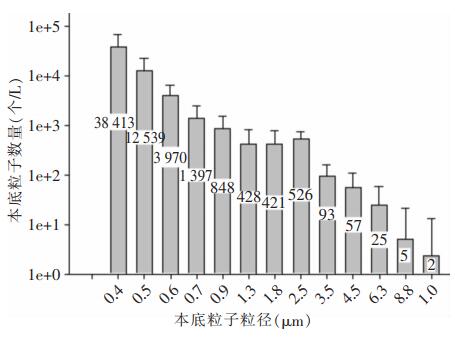 |
| 图 3 试验病房空气中不同粒径段本底粒子数 Figure 3 Background particle number of different particle sizes in the air of experimental ward |
选取检测点粒子计数器记录的安德森采样器测量粒径范围内的不同粒径段的粒子数,分别减去对应粒径段的空气本底粒子数,获得不同粒径段液滴核的数量,再将液滴核粒径反推蒸发前雾化液滴初始粒径,在任意检测点(Xj)液滴核蒸发前每升空气中雾化液滴的总体积密度函数(Vt, mL)计算如下:
| $ {V_{{\rm{t, }}{{\rm{x}}_{\rm{j}}}}} = \sum\limits_{{\rm{i}} = 1}^{\rm{n}} {{c_{{\rm{i, }}{x_{\rm{j}}}}}} {v_{{\rm{i, }}{x_{\rm{j}}}}} $ | (3) |
式中ci是空气中特定粒径段液滴核的粒子浓度,vi是特定粒径段液滴核蒸发前的雾化液滴体积,i代表任意粒径段,n是粒径段总数,j代表任意检测点。
2.4 空气标本中噬菌体存活量为验证喷雾机械力对液滴中噬菌体存活的影响,由计时电子触发开关控制雾化喷嘴向无菌烧瓶内喷雾1 s,采集烧瓶内凝结液进行噬菌体浓度滴定检测,结果显示喷雾前后噬菌体浓度在相同数量级,表明喷雾机械力对液滴中噬菌体存活影响可以忽略不计,造成液滴核内噬菌体数量减少的主要因素是干燥和环境参数。
现场试验中4个检测点空气标本中噬菌体存活数量随采样时间衰减变化特征符合回归曲线,将回归曲线延伸至t=0处推算液滴核初始携带的噬菌体数量N0, xj,检测点噬菌体存活百分比可以通过空气标本中活噬菌体数量(Nt, xj)除以N0, xj计算。结果显示四个检测点在采样的第一分钟内损失了40%~80%的噬菌体,各检测点噬菌体数量的衰减变化规律符合对数衰减特征,与机械通风条件下空气粒子数量的衰减特征一致。见图 4。
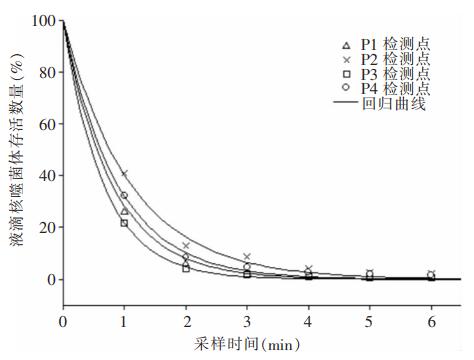 |
| 图 4 空气标本中存活噬菌体的数量衰减变化 Figure 4 Changes in attenuation of the number of viable phages in air specimens |
公式(3)计算获得的任意检测点(Xj)液滴核蒸发前每升空气中雾化液滴的总体积密度函数Vt, xj与模拟唾液中噬菌体浓度(C0, 个/mL)的乘积就是任意检测点液滴核初始携带的噬菌体数量(Mt, xj), 即:
| $ {M_{{\rm{t, }}{{\rm{x}}_{\rm{j}}}}} = {V_{{\rm{t, }}{{\rm{x}}_{\rm{j}}}}}{C_0} $ | (4) |
比较通过延伸液滴核噬菌体数量对数衰减曲线至t=0处获得的初始噬菌体数量和公式(4)的计算结果发现,在P1检测点液滴核中约83%的噬菌体在t=0处死亡,说明蒸发过程中液滴内理化指标的快速变化对噬菌体存活造成重大影响。P1检测点空气样品中噬菌体数量随采样时间衰减及其对应的公式(4)计算结果见图 5,其中液滴核噬菌体存活数量以正常对数表示,两组数据与两条线性回归曲线吻合,其最小平方相关系数分别为0.90和0.91。
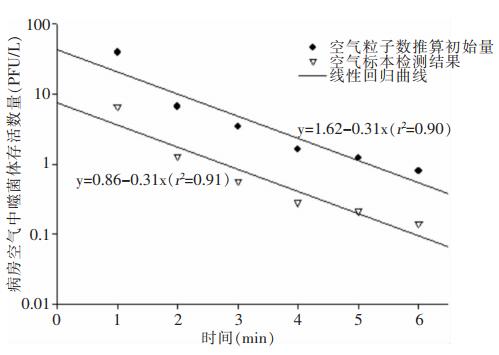 |
| 图 5 P1检测点空气粒子数推算噬菌体初始量及空气标本检测结果 Figure 5 The number of initial phage calculated by the number of air particles at P1 detection point |
图 5中两条线性回归曲线的的斜率相同,说明检测点液滴核内存活噬菌体数量的衰减率与由公式(4)计算获得的液滴核初始携带的噬菌体数量的衰减率一致。在病房内任意检测点Xj空气中的噬菌体存活函数可以用暴露时间间隔(t)内检测到的噬菌体数量(Nt, xj)除以初始噬菌体数量(Mt, xj)表示,即:
| $ f(t) = \frac{{{N_{{\rm{t, }}{{\rm{x}}_{\rm{j}}}}}}}{{{M_{{\rm{t, }}{{\rm{x}}_{\rm{j}}}}}}} \times 100\% $ | (5) |
由于图 5中噬菌体数量与液滴核数量呈现等比例减少现象,显示在采样时间段内利用这两组数据计算获得的噬菌体存活函数f(t)变化轻微,说明相对于液滴蒸发过程而言,蒸发平衡后液滴核内溶质可以较好保护噬菌体在病房空气中扩散较长一段时间,并维持在较低的死亡率。其他三点各点计算结果检测数据相近,见图 6,显示病房空气中噬菌体存活函数与检测地点无关,四个检测点的噬菌体存活函数计算结果与一条线性回归曲线吻合,其最小平方相关系数为0.9,说明检测时段内病房空间任意检测点的噬菌体存活函数保持稳定,其平均值约为17%。
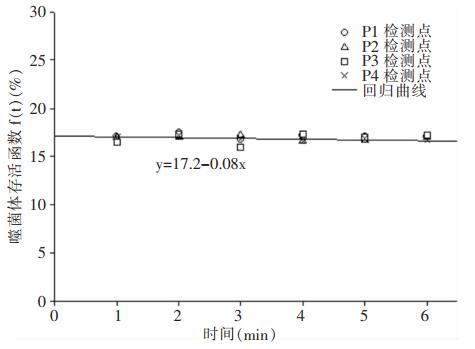 |
| 图 6 四个检测点噬菌体存活函数 Figure 6 Survival function of phage at four detection points |
研究呼吸道传染病的空气传播能力,需要研究咳嗽飞沫数量,飞沫携带病原体的能力,飞沫的空气扩散方式,以及飞沫内病原体在空气扩散过程中的存活能力。本研究在与唾液具有相似非挥发性组分的模拟唾液中加入大肠埃希菌噬菌体T1,采用可控方式制造出与咳嗽呼出颗粒物具有类似粒径分布的液滴谱系,检测不同粒径液滴核数量并估算其初始液滴的几何尺寸,在已知模拟唾液中大肠埃希菌噬菌体浓度下推算液滴核初始携带的大肠埃希菌噬菌体数量, 而液滴核内大肠埃希菌噬菌体的实际存活量通过采集空气生物标本获得,比较两组数据即获得液滴核携带的大肠埃希菌噬菌体在病房机械通风条件下的存活函数,为评估呼吸道传染病在病房内经空气传播引起感染的风险,建立现场试验研究方法。
本研究中使用的模拟唾液,雾化后在空气中蒸发作用下雾化液滴的粒径会变小。蒸发作用强弱取决于液滴在环境空气中处于蒸发平衡状态时表面水汽压的大小,而蒸发速率取决于空气温度和相对湿度。在极低相对湿度下完全蒸发的液滴可以达到结晶直径,结晶直径的大小取决于液滴中溶解物质的数量[1]。由于模拟唾液与人体唾液的非挥发性物质含量相近,不但为大肠埃希菌噬菌体加入到模拟唾液中后的存活提供了必要的营养物质,有利于保护大肠埃希菌噬菌体在雾化过程中免受机械力的损伤,也使雾化后的液滴与咳嗽产生的飞沫具有相似的空气蒸发特征,其几何学和空气动力学特征也相似[7]。
在与本研究相同试验设施设备及雾化点位置条件下,按甘油与蒸馏水1:3的比例配制雾化液体,对雾化液滴核在病房空气中的凝结效应的研究[2]结果表明,液滴核由于相互凝结作用而导致数量减少的速率约为1.2×10-3个/s,而与本底粒子相互凝结而导致数量减少的速率约为2.26×10-4个/s。凝结效应与重力沉降或机械通风稀释等因素相比,对于液滴核的去除率相对轻微,相对于本研究中液滴核的数量,液滴核由于凝结效应造成的数量减少可以忽略不计。使用数值计算和示踪试验技术对雾化甘油液滴及其液滴核在垂直方向运动的研究[2]结果表明,初始粒径45 μm以下的雾化甘油液滴在空气中的悬浮时间超过360 s并表现出空气传播特征,由于本研究中雾化液滴与甘油液滴试验中液滴的质量浓度相同,在本研究的计算中同样计入45 μm以下的雾化液滴和液滴核。
雾化液滴及其液滴核的横向扩散由两个阶段构成,第一阶段扩散由喷雾形成的喷射气流主导,第二阶段扩散由喷射气流之外的室内空气运动主导。在图 2坐标系下,初始粒径1.5 μm液滴形成的液滴核在第一阶段沿X轴方向平均扩散1.6 m需要30 s,在相同方向上初始粒径45 μm液滴形成的液滴核在第一阶段扩散1 m需要50 s。在Y轴方向第一阶段初始粒径1.5 μm液滴形成的液滴核扩散1 m需要80 s,而初始粒径45 μm液滴形成的液滴核扩散0.6 m需要120 s[2]。由此可见液滴核由雾化喷嘴运动到检测点所需时间远大于相应的蒸发作用时间,说明本研究中检测点粒子计数器记录的空气粒子数减去空气本底粒子数后只剩下液滴核的数量。
现场试验中使用安德森采样器在检测点采集空气生物标本,在安德森采样器内培养皿的上层软琼脂内加入大肠埃希菌用来检测病房空气中雾化液滴核中大肠埃希菌噬菌体的存活量。典型大肠埃希菌繁殖过程曲线包含初始1.5 h左右的停滞期、指数增长期、减速期和衰减期[13]。本研究中使用的含菌肉汤在温水浴培养8 h后大肠埃希菌浓度达到5×108 CFU/mL,在空气采样培养皿的上层软琼脂内加入0.5 mL含菌肉汤,相当于加入了2.5×108 CFU大肠埃希菌,而单个大肠埃希菌的面积约为6×10-12 m2,培养皿的上层软琼脂内全部大肠埃希菌约可覆盖1.5×10-3 m2的区域,鉴于培养皿面积小于6.9×10-3 m2及现场空气采样一般在培养皿准备完成后3~4 h后进行,现场空气采样过程中培养皿的上层软琼脂的表面完全能被大肠埃希菌覆盖。另一方面,现场采样中空气采样器培养皿上层软琼脂上采集到的液滴核携带的噬菌体数量较少,在噬菌体数量少于200 PFU的情况下,每个噬菌体都可以感染一个大肠埃希菌并形成空斑[14]。空气采样器培养皿经6~8 h培养后出现空斑,空斑直径约为1~3 mm,但若持续培养则培养皿上层软琼脂内的大肠埃希菌会持续繁殖生长并覆盖空斑区域,此将导致低估液滴核内噬菌体的存活量,因此应用此项技术需要控制采样分析节奏。
现场试验中记录液滴核数量的空气粒子计数器的粒径检测范围与采集空气生物标本的安德森采样器采集的空气粒子粒径范围略有不同,其中20~23 μm粒径范围的液滴核未被空气粒子计数器记录,可能导致噬菌体存活函数被高估,不过考虑到此部分粒径液滴核的总体积小于所有被记录液滴核的总体积的1%,由此产生的计算误差可以忽略不计。另一方面,由于安德森采样器的粒子采集下限原因,粒径小于0.65 μm的液滴核数据也未计算在内,从单个大肠埃希菌噬菌体的大小推断其在粒径小于0.3 μm液滴核中难以存活,而粒径范围在0.3~0.65 μm的液滴核的总体积也小于所有被记录液滴核的总体积的1%,由此产生的计算误差也可以忽略不计。在计算中的关键参数是假定液滴核的粒径是其初始粒径的0.4倍,这一假定较为粗糙,不管是模拟唾液的雾化液滴还是咳嗽的唾液飞沫,其实际蒸发效应都值得进一步研究,对于应用本研究技术计算飞沫中病原体的存活函数至关重要。
人体咳嗽呼出的气体量受到个体特征、个体的病理生理学特征以及咳嗽效率等多种因素影响[15-16],极端情况下每次咳嗽呼出的气体量可以达到0.96~2.6 L[17],形成飞沫的唾液量约为0.04 mL[11]。为使模拟唾液雾化后不同粒径段液滴的数量比例及粒径分布与Duguid[18]研究的咳嗽所产生飞沫的数量比例及粒径分布相近,本研究中模拟唾液的雾化量和喷雾出气量等参数使用了相关研究[7]的结果。现场试验中雾化点和检测点的位置也选择避免复杂气流的干扰,这样简化的目的是为了更好了解雾化液滴数量与空气生物标本之间的关系,有利于定量分析空气标本中大肠埃希菌噬菌体存活量。
影响雾化液滴及其液滴核所携带大肠埃希菌噬菌体存活的主要因素包括喷雾过程的机械力,干燥过程噬菌体形态学、生理学及液滴溶质浓度变化[19],以及温湿度等环境参数[20]。现场试验结果获得的噬菌体存活函数相对稳定,与另一研究[4]中在相近温湿度下大肠埃希菌噬菌体T3在空气中的存活函数值相近,说明只需记录雾化液滴核的数量就可以推算室内空间的生物暴露水平,而不必进行繁琐的空气生物标本采集。由于大量呼吸道传染病的病原体是病毒,具有与大肠埃希菌噬菌体相似的大小,不会影响咳嗽飞沫的空气动力学特征,本研究方法可用于模拟此类呼吸道传染病通过咳嗽飞沫核携带病毒的空气传播能力,进而评估此类传染病经飞沫核空气传播后的感染风险,但对于不同的呼吸道传染病病原体,需要在生物安全前提下研究其在环境中的存活能力,因为有大量研究[21-22]显示不同病原体的环境存活能力不同。
尽管本研究现场试验环境是典型机械通风条件下的全尺寸病房,但试验过程中病房检测区域实际上是空态。现实场景下病房内的家具、医疗设备、人员、送回风口大小、布置位置和风速等均会改变室内空气流场[23],而呼吸道传染病患者咳嗽的力度、高度、角度、呼出的飞沫量等也是影响飞沫核空气传播的重要因素[24]。本研究现场试验结果验证了咳嗽呼出飞沫核携带病毒在病房内的空气传播能力,显示出多病床条件下对其他患者的空气传播感染风险,而对相邻病床而言,咳嗽呼出的较大粒径飞沫形成的飞沫传播感染风险也需高度警惕。通过不同场景下对咳嗽飞沫及其飞沫核携带病毒传播能力的研究,对于制定多床位病房的床间距标准,确定病房内物理隔离等防护方法,评估呼吸道传染病传播风险都具有参考意义。
| [1] |
Morawska L. Droplet fate in indoor environments, or can we prevent the spread of infection?[J]. Indoor Air, 2006, 16(5): 335-347. DOI:10.1111/j.1600-0668.2006.00432.x |
| [2] |
Chao CYH, Wan MP, Sze To GN. Transport and removal of expiratory droplets in hospital ward environment[J]. Aerosol Sci Tech, 2008, 42(5): 377-394. DOI:10.1080/02786820802104973 |
| [3] |
Larson E. Environmental variables and microbial survival[M]//Hers FP, Winkler KC. Airborne transmission and airborne infection. Utrecht, The Netherlands: Oosthoek Publishing Co, 1973, 81-96.
|
| [4] |
Ehrlich R, Miller S, Idoine LS. Effects of environmental factors on the survival of airborne T-3 coliphage[J]. Appl Microbiol, 1964, 12(6): 479-482. DOI:10.1128/AEM.12.6.479-482.1964 |
| [5] |
Dubovi EJ, Akers TG. Airborne stability of tailless bacterial viruses S-13 and MS-2[J]. Appl Microbiol, 1970, 19(4): 624-628. DOI:10.1128/AEM.19.4.624-628.1970 |
| [6] |
Cole EC, Cook CE. Characterization of infectious aerosols in health care facilities:an aid to effective engineering controls and preventive strategies[J]. Am J Infect Control, 1998, 26(4): 453-464. DOI:10.1016/S0196-6553(98)70046-X |
| [7] |
魏方, 关继祖, 杨旭, 等. 咳嗽呼出气溶胶人工模拟技术的研究[J]. 中华医院感染学杂志, 2015, 25(16): 3658-3660, 3663. |
| [8] |
Effros RM, Hoagland KW, Bosbous M, et al. Dilution of respiratory solutes in exhaled condensates[J]. Am J Respir Crit Care Med, 2002, 165(5): 663-669. DOI:10.1164/ajrccm.165.5.2101018 |
| [9] |
Bucher K. Pathophysiology and pharmacology of cough[J]. Pharmacol Rev, 1958, 10(1): 43-58. |
| [10] |
Bjørn E, Nielsen PV. Dispersal of exhaled air and personal exposure in displacement ventilated rooms[J]. Indoor Air, 2002, 12(3): 147-164. DOI:10.1034/j.1600-0668.2002.08126.x |
| [11] |
Nicas M, Nazaroff WW, Hubbard A. Toward understanding the risk of secondary airborne infection:emission of respirable pathogens[J]. J Occup Environ Hyg, 2005, 2(3): 143-154. DOI:10.1080/15459620590918466 |
| [12] |
Hinds WC. Aerosol technology-properties, behavior, and mea-surement of airborne particles[M]. 2nd ed. New York: John Wiley & Sons Ltd, 1999.
|
| [13] |
Hayden FG, Fritz R, Lobo MC, et al. Local and systemic cytokine responses during experimental human influenza A virus infection. Relation to symptom formation and host defense[J]. J Clin Invest, 1998, 101(3): 643-649. DOI:10.1172/JCI1355 |
| [14] |
Brown TA. Essential molecular biology:a practical approach[M]. 2nd ed. Manchester: Oxford University Press, 2000.
|
| [15] |
Gupta JK, Lin CH, Chen Q. Flow dynamics and characterization of a cough[J]. Indoor Air, 2009, 19(6): 517-525. DOI:10.1111/j.1600-0668.2009.00619.x |
| [16] |
Kwon SB, Park J, Jang J, et al. Study on the initial velocity distribution of exhaled air from coughing and speaking[J]. Chemosphere, 2012, 87(11): 1260-1264. DOI:10.1016/j.chemosphere.2012.01.032 |
| [17] |
McCool FD. Global physiology and pathophysiology of cough:ACCP evidence-based clinical practice guidelines[J]. Chest, 2006, 129(Suppl 1): 48S-53S. |
| [18] |
Duguid JP. The size and the duration of air-carriage of respiratory droplets and droplet-nuclei[J]. J Hyg (Lond), 1946, 44(6): 471-479. |
| [19] |
Cox CS. The aerobiological pathway of microorganisms[M]. Chichester, West Sussex, England: John Wiley & Sons Ltd., 1987.
|
| [20] |
Mohr AJ. Development of models to explain the survival of viruses and bacteria in aerosols[M]//Hurst CT. Modeling the environmental fate of microorganisms. Washington, DC: American Society for Microbiology, 1991.
|
| [21] |
Ijaz MK, Brunner AH, Sattar SA, et al. Survival characteristics of airborne human coronavirus 229E[J]. J Gen Virol, 1985, 66(Pt 12): 2743-2748. |
| [22] |
Miller WS, Artenstein MS. Aerosol stability of three acute respiratory disease viruses[J]. Proc Soc Exp Biol Med, 1967, 125(1): 222-227. DOI:10.3181/00379727-125-32054 |
| [23] |
Zhu S, Kato S, Yang JH. Study on transport characteristics of saliva droplets produced by coughing in a calm indoor environment[J]. Build Environ, 2006, 41(12): 1691-1702. DOI:10.1016/j.buildenv.2005.06.024 |
| [24] |
Noti JD, Lindsley WG, Blachere FM, et al. Detection of infectious influenza virus in cough aerosols generated in a simulated patient examination room[J]. Clin Infect Dis, 2012, 54(11): 1569-1577. DOI:10.1093/cid/cis237 |



