2. 广州医科大学附属第一医院呼吸内科, 广东 广州 510000
2. Department of Respiratory Diseases, First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510000, China
肺炎克雷伯菌属于革兰阴性杆菌,可引起多系统感染[1]。与经典肺炎克雷伯菌(classic Klebisella pneumonia,CKP)相比,高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,hvKp)受到广泛关注,不仅可引起细菌性肝脓肿[2],还可引起脑膜炎、坏死性筋膜炎和眼内膜炎等转移性感染[3-4]。hvKp菌株在琼脂平板上的菌落表现为高黏液性(hypermucoviscous,hm)[5],可引起严重的转移性感染[6]。但也有小鼠试验表明,仅少数(1/5)高黏液表型菌株表现为高毒力[7]。因此,不能仅以高黏液表型区分hvKp与CKP菌株。研究高黏液表型以及基因型预测hvKp的可靠性,现将结果报告如下。
1 资料与方法 1.1 菌株来源2016年11月—2018年4月广东省4所医院收集多种标本(包括血液、引流液、尿等)来源的肺炎克雷伯菌。将收集的菌株应用Vitek全自动微生物分析仪进行鉴定。初次鉴定后再经16S rRNA基因测序鉴定。
1.2 拉丝试验用接种环蘸取生长在LB(购自广东环凯微生物科技有限公司)琼脂平板上的新鲜肺炎克雷伯菌菌落,将接种环向上提起,若菌落形成的黏丝长度>5 mm,则判定为拉丝试验阳性,称为高黏液表型肺炎克雷伯菌(hypermucoviscous Klebsiella pneumoniae,hmKp);反之则为阴性,称为非高黏液表型肺炎克雷伯菌(non-hypermucoviscous Klebsiella pneumoniae,non-hmKp)[5]。
1.3 血清荚膜分型与毒力基因检测采用煮沸法提取菌株DNA模板,PCR扩增特异性引物(血清型K1、K2、K5、K20、K54、K57及毒力基因rmpA、rmpA2、magA、iucA等18个毒力基因)参照文献[8]合成。PCR体系:PCR上下游引物(引物浓度10 pmol/μL)各1.0 μL,Premix 12.5 μL(购自北京六合华大基因科技有限公司),超纯水9.5 μL,DNA模板1.0 μL,总共25.0 μL。PCR扩增阳性产物送北京六合华大基因科技有限公司进行双脱氧末端终止法(也称sanger测序法)测序,GenBank进行Blast比对双测序结果,进而获得相应基因型。
1.4 蜡螟试验从天津惠裕德生物科技有限公司购买符合试验标准的大蜡螟幼虫,每只重约300~400 mg,肤色不正常或活力欠佳的幼虫均剔除在外。为减少物理损伤及自身原因,共设置2组对照组,一组注射等量的PBS,一组蜡螟不做任何处理。收集孵育于LB琼脂平板上18~20 h分纯的临床肺炎克雷伯菌菌株,将单菌落加入PBS溶液(pH=6.5)调制成0.5麦氏单位,进行菌落计数,依照菌落计数结果将菌液浓度稀释至104~107 CFU/mL。随机选择10只大蜡螟为一组,每一株肺炎克雷伯菌共注射3组,每株菌4个稀释浓度共需120只蜡螟,每株待检细菌均进行试验。取微量注射器吸取20.0 μL细菌悬液从蜡螟伪足的第一腹节进针,全部注入后置于干净的培养皿内放入孵箱,培养皿上标记细菌名称及浓度。注射后每隔6 h观察记录每组蜡螟死亡数量,直到72 h,72 h后大蜡螟做灭菌无害化处理。用回归分析方法中的probit概率法计算半数致死率(LD50)(log10 CFU/mL)。
1.5 统计学分析应用SPSS 19.0统计软件进行分析,计数资料比较采用卡方检验,各组LD50比较采用t检验或单因素分析[9],P≤0.05为差异有统计学意义。
2 结果 2.1 拉丝试验结果共收集194株肺炎克雷伯菌,主要来源于血标本(占70.1%),其次为引流液(11.4%)、下呼吸道标本(10.8%)、尿(3.6%)、无菌体液(3.1%)、脑脊液(1.0%)。所有菌株拉丝试验阳性率为40.2%(78/194),其中血标本来源菌株阳性率为33.1%(45/136),其他标本来源菌株阳性率为56.9%(33/58)。
2.2 血清分型结果194株中有82株(42.3%)肺炎克雷伯菌可进行荚膜血清型分型,112株(57.7%)用PCR方法无法获得确切血清型(非K1/K2/K5/K20/K54/K57)。hmKp与non-hmKp菌株的荚膜血清型比较,hmKp菌株中血清型K1、K2、K57检出率高于non-hmKp菌株,差异均有统计学意义(均P<0.001)。hmKp与non-hmKp菌株中血清型K5、K20、K54检出率比较,差异均无统计学意义(均P>0.05),且检出率均较低。见表 1。
| 表 1 hmKp和non-hmKp菌株血清型分布情况 Table 1 Serotype distribution of hmKp and non-hmKp strains |
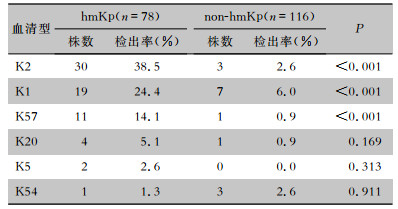
|
检测78株hmKp菌株的毒力基因,其中5个毒力基因检出率超过80%,分别为ureA(93.6%)、fimH(88.5%)、iroB(87.2%)、entB(84.6%)、iucA(82.1%);iroB+fimH基因检出率为80.8%(63株),entB+fimH基因检出率为79.5%(62株),iucA+iroB基因检出率为78.2%(61株),iucA+iroB+fimH基因检出率为74.4%(58株),iucA+iroB+peg-344基因检出率为71.8%(56株)。hmKp菌株中fimH、iroB、entB、iucA、rmpA、rmpA2、peg-344、ycfM、Irp-2、ybts、kfuB、uge、magA检出率高于non-hmKp菌株,差异均有统计学意义(均P<0.05)。见表 2。
| 表 2 hmKp和non-hmKp菌株毒力基因检出情况 Table 2 Detection of virulence genes of hmKp and non-hmKp strains |
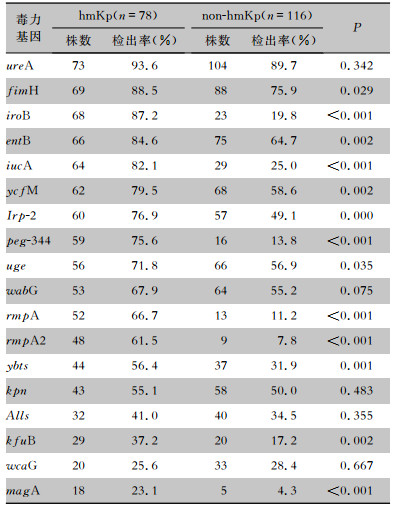
|
hmKp菌株LD50低于non-hmKp菌株,血清型K1菌株LD50高于血清型K2菌株。根据菌株毒力基因阳性和阴性进行分组,对比各组蜡螟LD50,发现仅iucA、iroB、fimH毒力基因阳性菌株LD50低于相应的阴性菌株。见表 3。iucA+iroB+imH基因均阳性菌株LD50低于均阴性菌株[LD50分别为(5.4±0.7)、(5.8±0.6)log10 CFU/mL,P=0.004]。3个基因(iucA、iroB、fimH)均阳性与其中任意两个基因阳性或一个基因阳性LD50比较,差异均无统计学意义(均P>0.05)。将iucA+iroB+fimH全阳性、iucA+iroB+fimH全阴性菌株分为两组,结合高粘液表型(hm阳性/hm阴性),比较毒力基因与高黏液表型预测hvKp的准确性。iucA阴性+iroB阴性+fimH阴性+hm阳性组(n=2)菌株数较少,无法对比,因此共分为三组,分别为iucA+iroB+fimH+hm全阳性组(n=58)、iucA阳性+iroB阳性+fimH阳性+hm阴性组(n=23)、iucA+iroB+fimH+hm全阴性组(n=28),其LD50分别为(5.39±0.71)、(5.44±0.62)、(5.83±0.64)log10 CFU/mL,总体比较,差异有统计学意义(F=4.157,P=0.018),前两组间比较差异无统计学意义(P值为0.786),但前两组分别与第3组比较差异均有统计学意义(P值分别为0.006、0.041)。iucA+iroB+fimH 3个毒力基因阳性的情况下,是否为高黏液表型菌株的LD50比较,差异无统计学意义;对于非高黏液表型菌株,iucA+iroB+fimH 3个毒力基因阳性菌株的LD50低于相应阴性菌株。
| 表 3 不同组肺炎克雷伯菌感染蜡螟的LD50比较 Table 3 Comparison of LD50 of different groups of Klebsiella pneumoniae infected with Galleria mellonella |
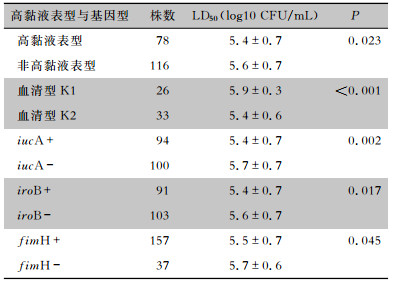
|
2016年11月—2018年4月从广东省4所医院收集的肺炎克雷伯菌中,来源于血标本者有33.1%为拉丝试验阳性,与北京两家单中心研究的血流感染中hvKp(拉丝试验阳性的菌株定义为hvKp)的比率相近(分别为33.0%、31.4%)[10-12],但高于西班牙(6.0%),加拿大(8.2%)等地区[5]。若依据拉丝试验阳性和iucA基因阳性定义hvKp,本研究中hvKp的比率为40.2%,低于我国两所教学医院中老年患者中hvKp的比率(47.5%)[13],不排除与本研究中标本来源较多有关。若依据基因背景(rpmA+iucA)定义hvKp,本研究中血流感染hvKp的比率为24.3%,与我国血流感染中hvKp 24.5%的比率相似[14]。在本研究中,依据拉丝试验和毒力基因型定义hvKp与仅拉丝试验定义的比例相近,因此,对于流行病学研究或者临床病例初筛,应用拉丝试验初筛hvKp是可取的。总的来说,无论依据何种方法定义hvKp,本研究中广东地区hvKp的比例与我国其他地区差异不大。蜡螟试验结果表明,hmKp菌株的平均毒力强于non-hmKp菌株,此结果与Russo等[15]2012年采用小鼠模型进行相关研究的结果一致。但并非所有hmKp菌株的毒力均高于non-hmKp菌株,尚有non-hmKp菌株的毒力较强,表明存在其他因素影响肺炎克雷伯菌的毒力,仅依据高黏液表型定义hvKp是不可取的,但可以作为hvKp菌株的初步筛查。铁载体肠杆菌素(entB)、气杆菌素(iucA)、沙门菌素(iroB)、耶尔森菌素(ybts, irp-2)、kfuB等均介导三价铁的摄取,均是肺炎克雷伯菌感染的重要毒力因子[11]。Hsieh等[16]2008年的小鼠模型研究表明,与iucA阴性菌株相比,iucA阳性菌株可使小鼠模型的毒力增加,本研究中蜡螟模型的毒力研究结果与此一致。除此之外,还发现iroB+、fimH+阳性菌株的毒力强于相应的阴性菌株,并且不受高黏液表型的影响,表明铁载体系统和纤毛对于肺炎克雷伯菌毒力的重要性。
rmpA/rmpA2调节胞外脂多糖的合成,与高黏液表型密切相关,也认为是hvKp的重要生物标记物[10],但本研究高黏液表型中仅66.7%的菌株rmpA阳性,并且rmpA/rmpA2的阳性菌株与阴性菌株的毒力无明显差异,除与本研究中菌株来源较多有关外,也提示可能存在其他机制调节高黏液表型的表达[10]。
综上所述,本研究表明仅依据拉丝试验阳性检测预测hvKp准确性较低,毒力基因iucA+/iroB+/fimH+对预测hvKp有一定的意义。
| [1] |
Jarvis WR, Munn VP, Highsmith AK, et al. The epidemiology of nosocomial infections caused by Klebsiella pneumoniae[J]. Infect Control, 1985, 6(2): 68-74. DOI:10.1017/S0195941700062639 |
| [2] |
Liu YC, Cheng DL, Lin CL. Klebsiella pneumoniae liver abscess associated with septic endophthalmitis[J]. Arch Intern Med, 1986, 146(10): 1913-1916. DOI:10.1001/archinte.1986.00360220057011 |
| [3] |
Chung DR, Lee SS, Lee HR, et al. Emerging invasive liver abscess caused by K1 serotype Klebsiella pneumoniae in Korea[J]. J Infect, 2007, 54(6): 578-583. DOI:10.1016/j.jinf.2006.11.008 |
| [4] |
Shen DX, Wang J, Li DD. Klebsiella pneumoniae liver abscesses[J]. Lancet Infect Dis, 2013, 13(5): 390-391. |
| [5] |
Shon AS, Bajwa RPS, Russo TA. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae: a new and dangerous breed[J]. Virulence, 2013, 4(2): 107-118. DOI:10.4161/viru.22718 |
| [6] |
Prokesch BC, TeKippe M, Kim J, et al. Primary osteomyelitis caused by hypervirulent Klebsiella pneumoniae[J]. Lancet Infect Dis, 2016, 16(9): e190-e195. DOI:10.1016/S1473-3099(16)30021-4 |
| [7] |
Zhang YW, Zeng J, Liu WE, et al. Emergence of a hypervirulent carbapenem-resistant Klebsiella pneumoniae isolate from clinical infections in China[J]. J Infect, 2015, 71(5): 553-560. DOI:10.1016/j.jinf.2015.07.010 |
| [8] |
Struve C, Bojer M, Nielsen EM, et al. Investigation of the putative virulence gene magA in a worldwide collection of 495Klebsiella isolates: magA is restricted to the gene cluster of Klebsiella pneumoniae capsule serotype K1[J]. J Med Microbiol, 2005, 54(Pt 11): 1111-1113. |
| [9] |
Insua JL, Llobet E, Moranta D, et al. Modeling Klebsiella pneumoniae pathogenesis by infection of the wax moth galleria mellonella[J]. Infect Immun, 2013, 81(10): 3552-3565. DOI:10.1128/IAI.00391-13 |
| [10] |
Cheng HY, Chen YS, Wu CY, et al. RmpA regulation of capsular polysaccharide biosynthesis in Klebsiella pneumoniae CG43[J]. J Bacteriol, 2010, 192(12): 3144-3158. DOI:10.1128/JB.00031-10 |
| [11] |
Russo TA, Olson R, MacDonald U, et al. Aerobactin, but not yersiniabactin, salmochelin, or enterobactin, enables the growth/survival of hypervirulent (hypermucoviscous) Klebsiella pneumoniae ex vivo and in vivo[J]. Infect Immun, 2015, 83(8): 3325-3333. DOI:10.1128/IAI.00430-15 |
| [12] |
Li W, Sun GZ, Yu YH, et al. Increasing occurrence of antimicrobial-resistant hypervirulent (hypermucoviscous) Klebsiella pneumoniae isolates in China[J]. Clin Infect Dis, 2014, 58(2): 225-232. DOI:10.1093/cid/cit675 |
| [13] |
Liu C, Guo J. Hypervirulent Klebsiella pneumoniae (hypermucoviscous and aerobactin positive) infection over 6 years in the elderly in China: antimicrobial resistance patterns, molecular epidemiology and risk factor[J]. Ann Clin Microbiol Antimicrob, 2019, 18(1): 4. DOI:10.1186/s12941-018-0302-9 |
| [14] |
Li JY, Ren JA, Wang WP, et al. Risk factors and clinical outcomes of hypervirulent Klebsiella pneumoniae induced bloodstream infections[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(4): 679-689. DOI:10.1007/s10096-017-3160-z |
| [15] |
Russo TA, Shon AS, Beanan JM, et al. Hypervirulent K. pneumoniae secretes more and more active iron-acquisition molecules than "classical" K. pneumoniae thereby enhancing its virulence[J]. PLoS One, 2011, 6(10): e26734. DOI:10.1371/journal.pone.0026734 |
| [16] |
Hsieh PF, Lin TL, Lee CZ, et al. Serum-induced iron-acquisition systems and TonB contribute to virulence in Klebsiella pneumoniae causing primary pyogenic liver abscess[J]. J Infect Dis, 2008, 197(12): 1717-1727. DOI:10.1086/588383 |



