2. 广州医科大学附属市八医院儿科, 广东 广州 510060;
3. 广州医科大学附属市八医院重症医学科, 广东 广州 510060
2. Department of Pediatrics, Guangzhou Eighth People's Hospital, Guangzhou Medical University, Guangzhou 510060, China;
3. Department of Critical Care Medicine, Guangzhou Eighth People's Hospital, Guangzhou Medical University, Guangzhou 510060, China
新型冠状病毒(SARS -CoV-2)疫情已成为全球重大突发公共卫生事件,从2020年底开始全球陆续发现多种SARS -CoV-2变异株,备受关注的Delta变异株最初发现于印度,目前已成为全球传播主要的病毒株[1]。2021年5月21日广州市报道国内首例Delta变异株感染患者[2],目前广州疫情取得阶段性成功,但是7月底南京新发本土疫情蔓延至河南、江苏、湖南、湖北等全国多个地方,确定亦为Delta变异株引起。广东省疾病预防与控制中心(CDC)发布的研究[2]结果显示,Delta变异株病毒载量是2020年SARS -CoV-2株的1 260倍。研究分析我院收治的儿童和青年Delta变异株感染患者的临床资料,以期为疫情防控和救治工作提供帮助。
1 对象与方法 1.1 研究对象选取2021年5月21日—6月18日广州医科大学附属市八医院隔离病区收治的Delta变异株新型冠状病毒肺炎(COVID -19) 确诊患者159例,包括儿童(1~14岁)21例,青年(15~35岁)24岁,中年(36~59岁)62例,老年(≥60岁)52例,所有患者均符合《新型冠状病毒肺炎诊疗方案(试行第八版)》诊断标准[3],儿童和青年所有患者纳入本研究。采用RT-PCR检测鼻/咽拭子SARS -CoV-2核酸,Ct值越低,病毒复制越活跃。鼻拭子SARS -CoV-2核酸转阴定义:连续2次(间隔大于24 h)鼻拭子核酸阴性。出院标准:临床症状减轻,体温正常3 d以上,鼻拭子SARS -CoV-2核酸转阴,胸部CT提示肺部炎症吸收、好转。观察终点:患者出院。本研究所有患者签署知情同意书,并获得广州市第八人民医院伦理委员会批准(202007140)。
1.2 临床资料Delta变异株感染者资料收集均来自医院电子病历系统,包括人口学特征、临床分型、临床表现、流行病学调查、慢性基础病、治疗及预后等,收集鼻/咽拭子SARS -CoV-2核酸结果、2个时段(入院基线和第1周)血常规、C-反应蛋白(CRP)、血清淀粉样蛋白A(SAA)、肝肾功能、凝血功能、心肌酶、降钙素原(PCT)和白介素-6(IL-6)等,全部病例均由广州市CDC确定SARS -CoV-2核酸阳性,广东省CDC确定病毒株基因序列。
1.3 统计学方法应用SPSS 22.0软件包,正态分布的计量资料采用均数±标准差(x±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料,采用M(P25,P75)表达,比较两组间差异性采用非参数检验(Mann-Whitney U秩和检验);率的比较采用卡方检验,P≤0.05为差异有统计学意义。
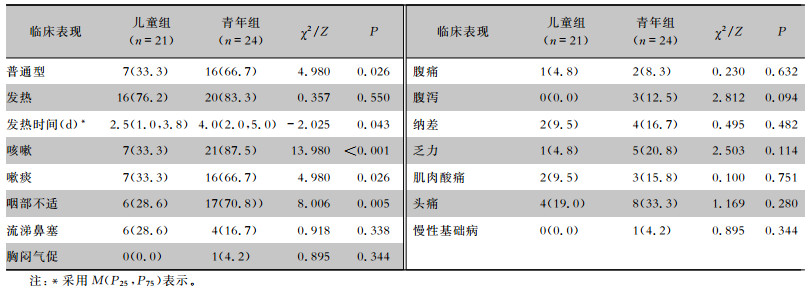
2 结果 2.1 一般情况全部本地SARS -CoV-2 Delta变异株感染者159例,其中儿童组21例(13.2%),男性9例,女性12例;无症状感染者3例,轻型11例,普通型7例;年龄范围1~14岁,年龄中位数7(4,12)岁。青年组共24例(15.1%),男性15例,女性9例;轻型8例,普通型16例;年龄范围15~35岁,年龄中位数24(17,31)岁。两组均无重症患者,与儿童组比较,青年组普通型患者更多见(P<0.05)。见表 1。儿童感染者以家庭聚集性感染为主要特征(17例,81.0%),儿童聚集就餐感染2例(9.5%),社区等2例,主要传播途径是呼吸道飞沫及直接接触传播。
| 表 1 儿童组和青年组Delta变异株感染者临床特征比较[例(%)] Table 1 Comparison in clinical characteristics of Delta variant infection in children and youth groups (No. of cases[%]) |
|
儿童患者主要症状有发热、咳嗽、咳痰、咽喉不适和鼻塞流涕,消化道症状少见;青年患者主要症状有咳嗽、咳痰、发热、头痛和咽喉不适。与青年组比较,儿童组患者咳嗽、咳痰和咽喉不适更少见,发热时间更短(P<0.05),但两组发热情况比较差异无统计学意义(P>0.05)。青年组患者合并慢性基础病(高血压病)1例,儿童组均无慢性基础病。
继发感染:4例患儿查呼吸道病原体IgM抗体,其中副流感病毒IgM和支原体抗体阳性各1例,未做咽拭子流感A+B;两组发热患者血培养均阴性,未发现继发细菌和真菌感染。
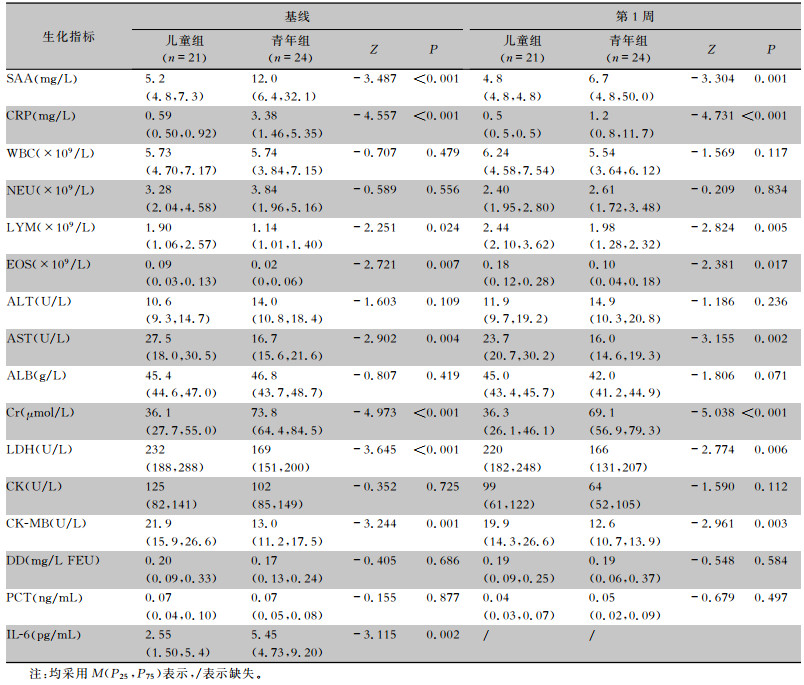
2.3 生化指标比较与青年组生化指标比较,基线儿童组患者SAA、CRP、血肌酐(Cr)和IL-6更低,而淋巴细胞(LYM)、嗜酸性粒细胞(EOS)、门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)和肌酸激酶同工酶(CK-MB)均更高(P<0.05);第1周儿童组患者SAA、CRP和Cr更低,而LYM、EOS、AST、LDH和CK-MB均更高(P<0.05)。两组患者基线和第1周白细胞(WBC)、中性粒细胞(NEU)、丙氨酸氨基转移酶(ALT)、清蛋白(ALB)、肌酸激酶(CK)、D-二聚体(DD)和PCT差异均无统计学意义(均P>0.05)。第1周IL-6数据缺失太多,未作比较。见表 2。
| 表 2 儿童组和青年组Delta变异株感染者生化指标比较 Table 2 Comparison in biochemical indicators of Delta variant between children and youth groups |
|
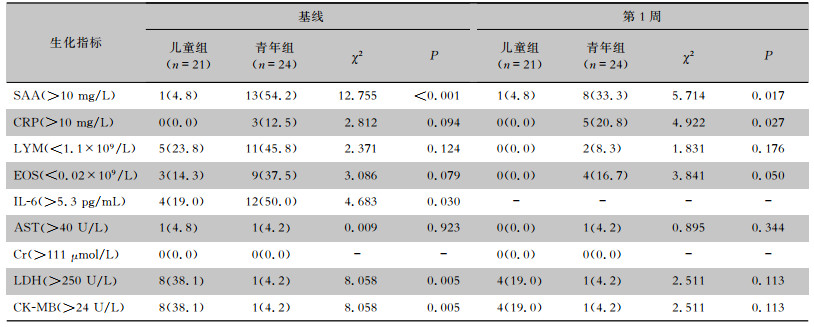
上述两组间比较有差异性的9个指标(SAA、CRP、LYM、EOS、IL-6、AST、Cr、LDH和CK-MB)根据正常参考值转化为计数资料,比较两组间的生化指标异常率(见表 3)。与青年组基线比较,儿童组患者基线SAA和IL-6升高少见,但LDH和CK-MB升高多见(P<0.05)。与青年组患者第1周比较,儿童组患者第1周SAA和CRP升高少见,EOS减少少见(P<0.05)。儿童组患者基线时LYM减少5例(23.8%),EOS减少3例(14.3%),第1周LYM和EOS均恢复正常。儿童组基线和第1周无一例CRP升高。
| 表 3 儿童组和青年组Delta变异株感染者生化指标异常情况比较[例(%)] Table 3 Comparison of abnormal condition of biochemical indicators of Delta variant between children and youth groups (No. of cases[%]) |
|
儿童组患者胸部CT显示肺部小斑片状或磨玻璃样阴影7例(33.3%),病灶局限, 主要位于外肺野及胸膜下,未见实变影、胸腔积液, 单侧病变6例(28.6%),双侧病变1例(4.8%),正常14例(66.7%);青年组患者肺部感染16例(66.7%),病变主要位于外肺野及胸膜下,呈现间质性改变、多发小斑片影或磨玻璃影, 部分患者可伴实变影,无胸腔积液,单侧病变7例(29.2%),双侧病变9例(37.5%),正常8例(33.3%)。
2.6 治疗及预后两组患者均未使用抗病毒药物、抗菌药物及糖皮质激素,治疗上仅对症处理(如退热、止咳化痰、低流量吸氧)和中药治疗。全组患者上呼吸道SARS -CoV-2核酸转阴中位日数为18(15,22)d,儿童组SARS -CoV-2核酸转阴中位日数为17(12,25)d,住院中位日数为19(16,27)d,青年组SARS -CoV-2核酸转阴中位日数为19(15,21)d,住院中位日数为21(19,23)d,所有患者均康复出院,无死亡病例。
3 讨论2020年COVID -19疫情暴发以来,印度、巴西、英国等国家陆续报道多种SARS -CoV-2变异株[4],2021年5月广州首次报道本地SARS -CoV-2 Delta变异株感染者,与去年国内流行的COVID -19比较,此变异株具有更强传染性[2]。本研究的目的是探索此变异株在儿童及青年人群感染者的临床特征。
COVID -19暴发初期,普遍的共识是儿童不易感染,一项综述[5]显示,儿童占野生株COVID -19确诊患者的1%~5%;苏格兰研究[6]显示,Delta变异株感染者较年轻,5~9岁病例比例更高;英格兰纳入8 682例Delta变异株感染患者的研究[7]显示,10岁以内占确诊患者的10.3%,10~19岁占确诊患者24.1%,与Alpha变异株感染比较,住院风险增加。本研究显示,儿童占全组患者13.2%,Delta变异株感染儿童所占比例增高,与上述研究[6-7]结论相似,说明儿童易感Delta变异株。野生株感染儿童病例以家庭聚集为主要特征,通过与携带SARS -CoV-2的家庭成员密切接触而感染[8-10],虽然儿童可以将病毒传播给他人,但传播率尚不清楚。与10岁以上的儿童相比,年龄较小的儿童传播SARS -CoV-2的可能性较小[10]。本研究显示,Delta变异株感染患儿呈家庭聚集性(81.0%)发病,与野生株相似,同时还发现Delta变异株在儿童之间聚餐时传播,但未明确向成人传播的风险性。美国和英国报道Delta变异株在儿童校园内传播,与Alpha变异相比,Delta变异株校内传播SARS -CoV-2的风险显著增加[11-12]。因此,在疫情严竣时期,儿童COVID -19防控重点包括家庭成年人和儿童均减少社交聚会、聚餐、探亲走访,做好个人防护措施(佩戴口罩、勤洗手),接种疫苗,同时学校也是儿童疫情防控主体,除做好儿童个人防护措施,推广适龄儿童疫苗接种,广州学校采取的措施还包括上报穗康码/粤康码、行程码等,取得不错的效果。
临床表现方面,野生株感染研究显示儿童COVID -19主要症状是发热和呼吸道症状,少数有消化道症状,儿童病情比成人轻,预后好,重症患者少,死亡极罕见[9, 13]。最新一项荟萃分析显示,发热(76.2%)和咳嗽(48%)是儿童患者最常见症状,腹泻和恶心/呕吐分别为14%和9%,24%为无症状感染者,大多数病例为轻-中度患者[14]。本研究显示,儿童主要症状有发热(76.2%)、咳嗽(33.3%)、咳痰(33.3%)、鼻塞流涕(28.6%)和咽部不适(28.6%),消化道症状少见,无症状感染者患儿占14.3%(3/21),与青年患者比较,发热时间更短(2.5 d VS 4.0 d),呼吸道症状更少见,总之,儿童患者症状更轻,预后良好,与儿童野生株感染临床特征一致[9, 13-14],说明不同病毒株感染临床表现和预后相近,同时,无症状患者比例较高,需要特别注意及时诊断和预防病毒传播。目前,国外鲜有Delta变异株感染患者临床研究报道,Lam-Hine等[15]报道一所小学暴发的27例Delta变异株相关疫情,疫情起源是1名未接种疫苗的老师,18名学生被感染,另外8例为学生的父母和兄弟姐妹,22例(81%)有症状,最常见的症状有发热(41%)、咳嗽(33%)、头痛(26%)和咽喉痛(26%),不同种族和民族Delta变异株感染者临床及预后是否存在差异,尚需进一步研究论证。
SAA和CRP是常用的评价感染的炎症指标,野生株感染临床研究提示,重症COVID -19患者SAA和CRP高于非重症患者,亦可用于评价其预后[16-17],SAA和CRP升高预示更严重的炎症反应。IL-6是Th2细胞分泌的促炎细胞因子,通过各种细胞因子介导炎症反应,聚集大量吞噬细胞和效应分子迅速清除病原体,研究报道提示重症COVID -19患者IL-6水平高于非重症患者,IL-6可能是新发肺部感染的启动因子,亦可作为疾病严重程度的预测因子,“细胞因子风暴”在疾病的发生和发展中起重要作用[18-20]。本组Delta变异株感染研究显示,与青年组比较,儿童组患者基线炎症指标(SAA、CRP和IL-6)更低,说明儿童炎症反应更轻,与野生株感染患儿一致[21]。淋巴细胞是机体最重要的免疫细胞,嗜酸性细胞在机体免疫清除中亦发挥重要作用,淋巴细胞减少和嗜酸性粒细胞减少提示免疫损伤,二者均可作为重症野生株COVID -19患者的预测因子[22]。本研究显示,与青年组比较,儿童组患者基线和第1周淋巴细胞和嗜酸性粒细胞更高,同时儿童组患者第1周时淋巴细胞和嗜酸性粒细胞全部恢复正常,而青年组第1周时仍有2例淋巴细胞减少和4例嗜酸性粒细胞减少,说明儿童Delta变异株感染者免疫损伤更小,恢复更快, 与儿童野生株感染患儿结果一致[21]。
免疫损伤和细胞因子风暴在COVID -19发生、发展起着关键作用,全身多个器官均可出现损伤,如心、肝、肾、血液循环系统等[3, 9]。儿童野生株COVID -19实验室检查通常可出现心肌酶升高[8, 23],Li等[8]综述提示心肌酶谱异常(CK-MB升高占44%和LDH升高占35%)在儿科患者中更为常见,Henry等[23]综述显示,轻度COVID -19患儿CK-MB升高比率为33%,LDH升高比率为28%,心肌酶升高提示可能存在心脏损伤。本研究显示,与青年组基线CK-MB和LDH升高率(均4.2%)比较,儿童基线CK-MB和LDH升高(均38.1%)更常见,与野生株感染患儿结论一致[8, 23]。虽然CK-MB提供了儿童心脏损伤的潜在证据,但需要检测更敏感和更特异的心脏生物标记物(如肌钙蛋白I和肌钙蛋白T),遗憾的是本研究患者未将肌钙蛋白纳入常规检测项目。Saed等[24]以肌钙蛋白I升高和心脏电变化定义急性心肌损伤的系统综述显示,78%急性心肌损伤的COVID -19患者是儿童/青少年,而且许多患者无任何心血管疾病基础病发生了不同类型的心脏损伤,5人出现川崎样症状。目前尚不明确急性心肌损伤机制是病毒直接攻击心肌细胞,还是病毒触发的全身性炎症引起的,但多个证据表明心脏损伤是由病毒感染引起的全身炎症反应触发的[24]。总之,轻症儿童Delta变异株感染者可能存在急性心肌损伤,监测CK-MB和肌钙蛋白是必要的。另外本研究肝肾功能检查显示,全组患者血肌酐均在正常参考值范围,儿童血肌酐更低可能是生理因素决定的;心脏和肝脏受损时,AST均可升高,本研究儿童AST更高,但儿童和青年AST>40 U/L仅1例,儿童AST更高可能与生理因素或轻度急性心肌损伤有关。
影像学方面,Qi等[25]荟萃分析显示儿童患者胸部CT单侧、双侧病变和磨玻璃样阴影分别为29.4%(95%CI: 24.8%~34.3%)、24.7%(95%CI: 18.2%~31.6%)、32.9%(95%CI: 25.3%~40.9%),正常约为36.0%(95%CI: 27.7%~44.7%)。本研究儿童组患者胸部CT显示肺部小斑片状或磨玻璃样阴影7例(33.3%),单侧病变6例(28.6%),双侧病变1例(4.8%),正常14例(66.7%);青年组患者可见肺部感染16例(66.7%),单侧病变7例(29.2%),双侧病变9例(37.5%),正常8例(33.3%),儿童肺部靶器官损伤更小,范围更小。与野生株感染患儿比较,Delta变异株感染患儿肺部损伤更轻[25]。
目前,针对SARS -CoV-2抗病毒药物,未发现经严格随机、双盲、安慰剂对照研究证实有效的治疗药物[3],本研究所有病例未用任何抗病毒药物及糖皮质激素。COVID -19患儿易合并继发感染,如支原体、甲型、乙型流感病毒等[26],本研究仅4例患儿查呼吸道病原体IgM抗体,1例副流感病毒IgM阳性,1例支原体抗体阳性,未做咽拭子流感A+B,数据有欠缺,但发热患者血培养均阴性,未发现继发细菌、真菌感染,全组患者未使用抗菌药物。野生型COVID -19系统综述显示,轻中度患者上呼吸道SARS -CoV-2转阴中位数时间为17.2 d[27],儿童上呼吸道病毒转阴时间11.43 d[8],本研究全组Delta变异株感染患者上呼吸道病毒转阴时间为18 d,儿童和青年分别为17、19 d,与Li等[8]研究比较,儿童Delta变异株感染病毒转阴时间延长。Wang等[28]报道显示,与野生株感染患者比较,Delta变异株上呼吸道病毒转阴时间延长;Ong等[29]最新一项研究比较3种变异株(Alpha、Beta和Delta)病毒转阴情况,结果显示Delta变异株与呼吸道标本病毒转阴时间延长有关,本研究结论与以上二个研究相符。
儿童COVID -19在临床表现、生化指标和靶器官损伤更轻,恢复更快,其原因尚不明确。血管紧张素转化酶Ⅱ(ACE-Ⅱ)是SARS -CoV-2的主要受体,可限制ACE-Ⅱ介导的肺毛细血管渗漏和炎症,对急性肺损伤具有保护作用,随年龄增长ACE-Ⅱ表达降低,同时儿童期定期疫苗接种、易发呼吸道病毒感染、固有免疫系统更强大均有助于免疫激活,有利于COVID -19患儿病毒清除,儿童肺损伤再生和修复能力强,较少并发症,因此儿童患者的病情较轻[30-31]。然而ACE-Ⅱ对炎症介导的肺损伤有保护作用,但通过介导病毒入侵又可能增强肺损伤,尚需进一步探索保护因素和损伤因素在疾病发生和发展过程中的主导因素。
本研究具有一些局限性,是一个单中心、广州市地区回顾性病例研究,病例数少,患儿未监测肌钙蛋白,继发感染关注不够,未做呼吸道标本病毒培养等。
总之,SARS -CoV-2 Delta变异株儿童以家庭聚集性发病为主要特征。与青年患者比较,儿童SARS -CoV-2 Delta变异株感染者呼吸道症状、炎症反应、免疫细胞受损和肺部靶器官损伤更轻,免疫细胞恢复更快。儿童患者基线CK-MB和LDH升高更常见,需密切关注可能的急性心肌损伤,儿童患者监测心脏生物标志物是必要的,同时需关注继发感染。与野生株感染比较,儿童和青年Delta变异株感染患者上呼吸道SARS -CoV-2转阴时间延长,需延长监测上呼吸道核酸的时间。全组患者总体预后良好,儿童疾病特征的相关机制尚需进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pascarella S, Ciccozzi M, Zella D, et al. SARS -Cov-2 B.1.617 Indian variants: are electrostatic potential changes responsible for a higher transmission rate?[J]. J Med Virol, 2021, 93(12): 6551-6556. DOI:10.1002/jmv.27210 |
| [2] |
Li BS, Deng AP, Li KB, et al. Viral infection and transmission in a large, well-traced outbreak caused by the SARS -CoV-2 Delta variant[J]. medRxiv, 2021. DOI:10.1101/2021.07.07.21260122.Epubaheadofprint |
| [3] |
中华人民共和国国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第八版)[J]. 中华临床感染病杂志, 2020, 13(5): 321-328. DOI:10.3760/cma.j.issn.1674-2397.2020.05.001 |
| [4] |
World Health Organization. Tracking SARS -CoV-2 variants[EB/OL]. [2021-08-23]. https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.
|
| [5] |
Ludvigsson JF. Systematic review of COVID -19 in children shows milder cases and a better prognosis than adults[J]. Acta Paediatr, 2020, 109(6): 1088-1095. DOI:10.1111/apa.15270 |
| [6] |
Sheikh A, McMenamin J, Taylor B, et al. SARS -CoV-2 Delta VOC in Scotland: demographics, risk of hospital admission, and vaccine effectiveness[J]. Lancet, 2021, 397(10293): 2461-2462. DOI:10.1016/S0140-6736(21)01358-1 |
| [7] |
Twohig KA, Nyberg T, Zaidi A, et al. Hospital admission and emergency care attendance risk for SARS -CoV-2 Delta (B.1.617.2) compared with Alpha (B.1.1.7) variants of concern: a cohort study[J]. Lancet Infect Dis, 2021, S1473-3099(21): 00475-8. DOI:10.1016/S1473-3099(21)00475-8.Epubaheadofprint |
| [8] |
Li BB, Zhang S, Zhang RL, et al. Epidemiological and clinical characteristics of COVID -19 in children: a systematic review and Meta-analysis[J]. Front Pediatr, 2020, 8: 591132. DOI:10.3389/fped.2020.591132 |
| [9] |
蒋荣猛, 谢正德, 姜毅, 等. 儿童新型冠状病毒感染诊断、治疗和预防专家共识(第三版)[J]. 中华实用儿科临床杂志, 2021, 36(10): 721-732. DOI:10.3760/cma.j.cn101070-20210226-00235 |
| [10] |
Adeyinka A, Bailey K, Pierre L, et al. COVID 19 infection: pediatric perspectives[J]. J Am Coll Emerg Physicians Open, 2021, 2(1): e12375. |
| [11] |
Torjesen I. COVID -19:Delta variant is now UK's most dominant strain and spreading through schools[J]. BMJ, 2021, 373: n1445. |
| [12] |
Head JR, Andrejko KL, Remais JV. Model-based assessment of SARS -CoV-2 Delta variant transmission dynamics within partially vaccinated K-12 school populations[J]. medRxiv, 2021, 2021.08.20.21262389. DOI: 10.1101/2021.08.20.21262389.Epubaheadofprint.
|
| [13] |
Islam MA, Kundu S, Alam SS, et al. Prevalence and characteristics of fever in adult and paediatric patients with coronavi-rus disease 2019(COVID -19): a systematic review and Meta-analysis of 17515 patients[J]. PLoS One, 2021, 16(4): e0249788. DOI:10.1371/journal.pone.0249788 |
| [14] |
Taheri L, Gheiasi SF, Taher M, et al. Clinical features of COVID -19 in newborns, infants, and children: a systematic review and Meta-analysis[J]. Compr Child Adolesc Nurs, 2021, 1-19. |
| [15] |
Lam-Hine T, McCurdy SA, Santora L, et al. Outbreak associated with SARS -CoV-2 B.1.617.2(Delta) variant in an elementary school-Marin County, California, May-June 2021[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(35): 1214-1219. DOI:10.15585/mmwr.mm7035e2 |
| [16] |
Chen MQ, Wu YB, Jia W, et al. The predictive value of se-rum amyloid A and C-reactive protein levels for the severity of coronavirus disease 2019[J]. Am J Transl Res, 2020, 12(8): 4569-4575. |
| [17] |
Feng XD, Li SS, Sun Q, et al. Immune-inflammatory parameters in COVID -19 cases: a systematic review and Meta-analysis[J]. Front Med (Lausanne), 2020, 7: 301. |
| [18] |
Del Valle DM, Kim-Schulze S, Huang HH, et al. An inflammatory cytokine signature predicts COVID -19 severity and survival[J]. Nat Med, 2020, 26(10): 1636-1643. DOI:10.1038/s41591-020-1051-9 |
| [19] |
黄春明, 詹远京, 胡中伟. 入院时CT正常新型冠状病毒感染者淋巴细胞亚群和细胞因子特点及临床意义[J]. 实用医学杂志, 2020, 36(23): 3179-3183. DOI:10.3969/j.issn.1006-5725.2020.23.003 |
| [20] |
Potere N, Batticciotto A, Vecchié A, et al. The role of IL-6 and IL-6 blockade in COVID -19[J]. Expert Rev Clin Immunol, 2021, 17(6): 601-618. DOI:10.1080/1744666X.2021.1919086 |
| [21] |
Ma XF, Liu SS, Chen LZ, et al. The clinical characteristics of pediatric inpatients with SARS -CoV-2 infection: A Meta-ana-lysis and systematic review[J]. J Med Virol, 2021, 93(1): 234-240. DOI:10.1002/jmv.26208 |
| [22] |
Sun DW, Zhang D, Tian RH, et al. The underlying changes and predicting role of peripheral blood inflammatory cells in severe COVID -19 patients: A sentinel?[J]. Clin Chim Acta, 2020, 508: 122-129. DOI:10.1016/j.cca.2020.05.027 |
| [23] |
Henry BM, Benoit SW, de Oliveira MHS, et al. Laboratory abnormalities in children with mild and severe coronavirus di-sease 2019(COVID -19): a pooled analysis and review[J]. Clin Biochem, 2020, 81: 1-8. DOI:10.1016/j.clinbiochem.2020.05.012 |
| [24] |
Saed Aldien A, Ganesan GS, Wahbeh F, et al. Systemic inflammation may induce cardiac injury in COVID -19 patients including children and adolescents without underlying cardiovascular diseases: a systematic review[J]. Cardiovasc Revasc Med, 2021, S1553-8389(21): 00195-0. DOI:10.1016/j.carrev.2021.04.007.Epubaheadofprint |
| [25] |
Qi K, Zeng WB, Ye M, et al. Clinical, laboratory, and imaging features of pediatric COVID -19:a systematic review and Meta-analysis[J]. Medicine (Baltimore), 2021, 100(15): e25230. DOI:10.1097/MD.0000000000025230 |
| [26] |
Tsheten T, Clements ACA, Gray DJ, et al. Clinical features and outcomes of COVID -19 and dengue co-infection: a systematic review[J]. BMC Infect Dis, 2021, 21(1): 729. DOI:10.1186/s12879-021-06409-9 |
| [27] |
Fontana LM, Villamagna AH, Sikka MK, et al. Understan-ding viral shedding of severe acute respiratory coronavirus virus 2(SARS -CoV-2): review of current literature[J]. Infect Control Hosp Epidemiol, 2021, 42(6): 659-668. DOI:10.1017/ice.2020.1273 |
| [28] |
Wang YP, Chen RC, Hu FY, et al. Transmission, viral kinetics and clinical characteristics of the emergent SARS -CoV-2 Delta VOC in Guangzhou, China[J]. EClinicalMedicine, 2021, 40: 101129. DOI:10.1016/j.eclinm.2021.101129 |
| [29] |
Ong SWX, Chiew CJ, Ang LW, et al. Clinical and virological features of SARS -CoV-2 variants of concern: a retrospective cohort study comparing B.1.1.7(Alpha), B.1.315(Beta), and B.1.617.2(Delta)[J]. Clin Infect Dis, 2021, ciab721. DOI:10.1093/cid/ciab721 |
| [30] |
邓全敏, 梁萍. 儿童新型冠状病毒肺炎流行病学特点及机制分析[J]. 中国当代儿科杂志, 2021, 23(4): 420-424. |
| [31] |
Panahi L, Amiri M, Pouy S. Clinical characteristics of COVID -19 infection in newborns and pediatrics: a systematic review[J]. Arch Acad Emerg Med, 2020, 8(1): e50. |



