2. 安徽医科大学第三附属医院老年医学科, 安徽 合肥 230022;
3. 安徽医科大学附属巢湖医院全科医学科, 安徽 合肥 230022
2. Department of Geriatrics, The Third Affiliated Hospital of Anhui Medical University, Hehui 230022, China;
3. Department of General Medicine, Chaohu Hospital Affiliated to Anhui Medical University, Hehui 230022, China
隐匿性肺炎(occult pneumonia)是指呼吸道症状不典型,或伴有非呼吸道症状(消化系统、神经系统等),通常根据肺部影像学、血常规等客观指标诊断的肺炎[1]。由于临床症状不典型,经常出现漏诊或误诊,导致患者住院时间延长,住院费用增加[2]。老年性痴呆是患者发生隐匿性肺炎的危险因素之一[3],但目前对痴呆严重程度、痴呆病程以及其他导致隐匿性肺炎的危险因素报道较少。因此,寻找一种可行且准确的筛查工具来识别未确诊的隐匿性肺炎或隐匿性肺炎发病的高危人群至关重要。在此方面,风险预测模型具有相当大的潜力,有助于筛选个体以识别具有未确诊疾病的风险增加的情况,有利于早期诊断和治疗[4]。本文将重点分析老年性痴呆患者发生隐匿性肺炎的危险因素,构建相应的感染风险预测模型,并通过Nomogram图可视化预测老年痴呆肺部感染患者发生隐匿性感染的概率,从而尽早做好干预措施,改善患者预后。
1 对象与方法 1.1 研究对象选取2019年1月—2020年12月在安徽医科大学第三附属医院(合肥市第一人民医院)收治的明确诊断为老年性痴呆合并肺部感染患者。纳入标准:(1)年龄≥60岁。(2)痴呆诊断参照《2018中国痴呆与认知障碍诊治指南》[5]执行。(3)患者及其家属知情并签署知情同意书,并通过医院伦理学会论证。排除标准:(1)病情危重,随时可能出现死亡;(2)意识障碍;(3)慢性疾病终末期。
1.2 研究对象分组从确诊老年性痴呆合并肺部感染患者中随机挑选部分患者作为建模组,并根据是否具备隐匿性分为隐匿性肺炎组、非隐匿性肺炎组,其余病例作为验证组。隐匿性肺炎入选标准[3]:标准一: (1)无典型的咳嗽、咳痰、胸痛等典型的呼吸道症状。(2)标准后前位X线胸片未发现而经侧位胸片和/或CT诊断肺炎。标准二:无典型的呼吸道症状,经床旁X线检查未发现肺部感染,患者搬运困难未完善胸部CT检查,痰培养(痰标本质量合格)或血培养有阳性证据及感染指标高,包括降钙素原(PCT)、C反应蛋白(CRP), 经验抗感染治疗有效,诊断为隐匿性肺炎。
1.3 研究方法选用回顾性研究方法,通过查阅相关文献[3, 6],设计临床调查病例报告表(case report form, CRF)回顾性采集研究对象的疾病史、痴呆病程、痴呆严重程度、吸烟史、基础疾病、是否长期卧床、血常规、肝肾功能、电解质、清蛋白、营养状态等可能与隐匿性肺炎相关的资料。录入患者入院时的相关信息(一般人口学资料、疾病史),以及在院就诊的生化检测、相关医疗记录。双人平行录入及核对,保证数据质控合格。
1.4 统计学方法应用SPSS 20.0统计软件进行数据分析。单因素分析中,计量资料:对称分布资料采用均数±标准差进行统计描述,两组间比较采用t检验;偏态分布资料用中位数、四分位数描述,组间比较采用Mann-Whitney U检验。计数资料:采用率进行统计描述,采用卡方检验或Fisher’s确切概率法完成组间比较。对单因素分析有统计学意义的因素采用多因素logistic回归分析,获得独立影响因素。采用R(4.0.3)软件建立Nomogram列线图。采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)及其曲线下面积(AUC,area under curve)和校准曲线(calibration curve)评价模型在建模组和验证组中的诊断效能以及校准度,并采用Hosmer-Lemeshow方法检验logistic回归模型的拟合优度,使用决策曲线分析(decision curve analysis, DCA)评价模型在不同阈值概率中的获益性[7]。
2 结果 2.1 一般临床资料2019年1月—2020年12月该院共收治242例确诊的老年性痴呆合并肺部感染患者。排除因病情危重可能出现死亡8例,意识障碍3例,慢性疾病终末期1例,病历资料不完整14例,最终216例患者的病历资料纳入研究分析。其中148例(隐匿性肺炎75例、非隐匿性肺炎73例)用于建模,68例(隐匿性肺炎37例、非隐匿性肺炎31例)用于验证。
2.2 危险因素单因素分析建模数据中隐匿性肺炎组和非隐匿性肺炎组患者在年龄、重度痴呆、痴呆病程、长期卧床、合并糖尿病、营养不良、清蛋白(Alb)方面比较,差异均有统计学意义(均P<0.05)。两组患者不同性别、是否有吸烟史、是否合并高血压、慢性阻塞性肺疾病、冠心病等方面比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 老年性痴呆患者合并隐匿性肺炎危险因素的单因素分析[例(%)] Table 1 Univariate analysis on risk factors for OP in senile dementia patients (No. of cases[%]) |
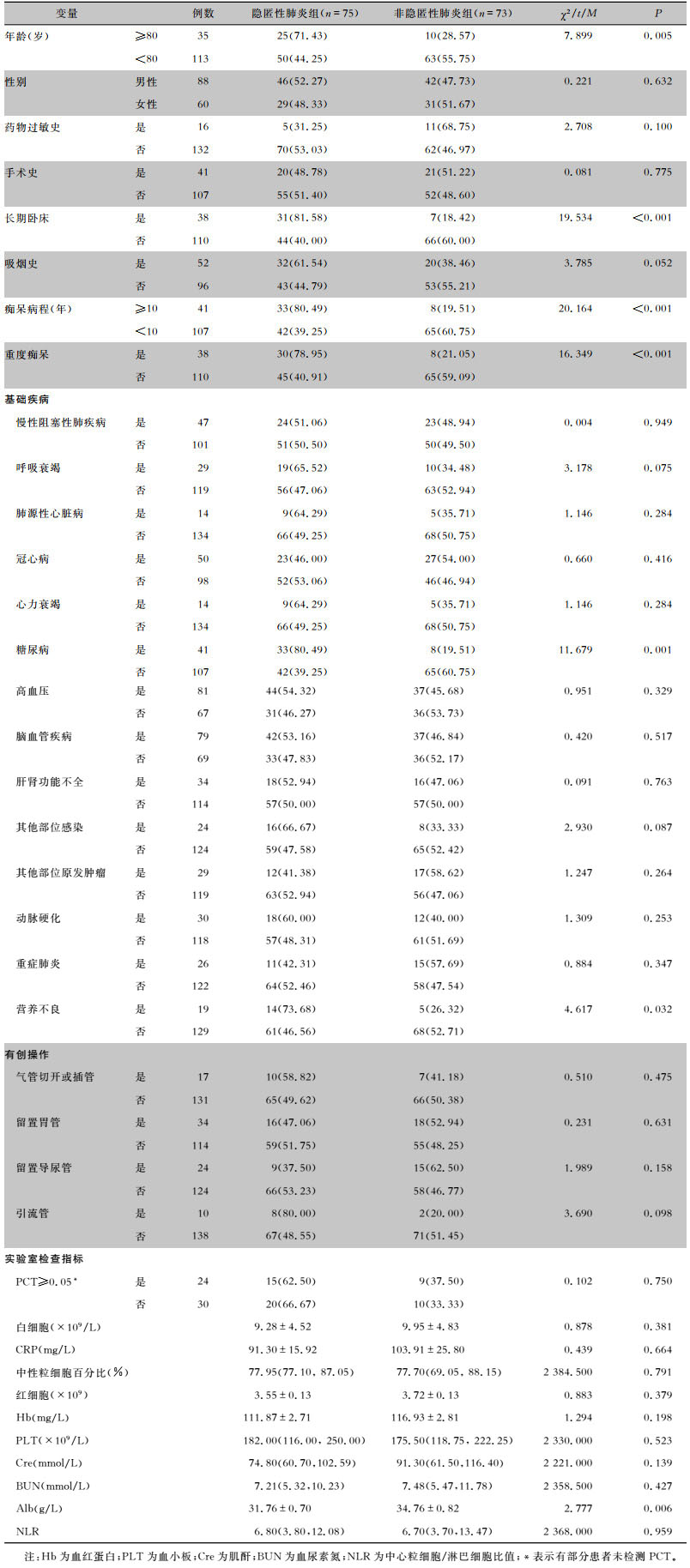
|
对单因素分析有统计学意义(P<0.05)的因素采用多因素logistic回归分析,结果显示糖尿病(OR=2.565, 95%CI: 1.094~6.015)、重度痴呆(OR=3.079, 95%CI: 1.116~8.494)、痴呆病程≥10年(OR=5.782, 95%CI: 2.139~15.627)、年龄≥80岁(OR=2.737, 95%CI: 1.011~7.413)、长期卧床(OR=4.835, 95%CI: 1.716~13.625)为痴呆合并隐匿性肺炎的独立危险因素(均P<0.05),均与痴呆患者发生隐匿性肺炎高度相关。见表 2。
| 表 2 老年性痴呆患者合并隐匿性肺炎的多因素logistic回归分析 Table 2 Multivariate logistic regression analysis on risk factors for OP in senile dementia patients |
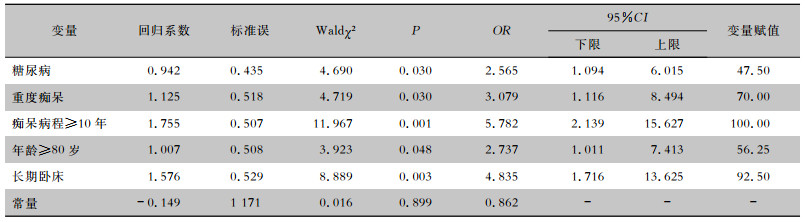
|
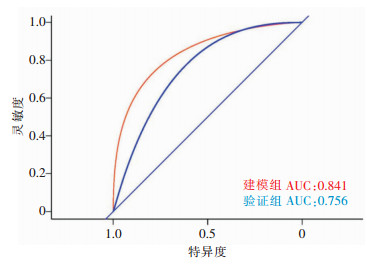
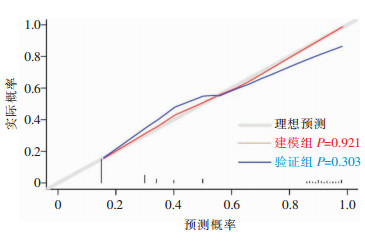
根据多因素logistic回归分析,筛选出老年性痴呆发生隐匿性肺炎的独立危险因素构建模型,并对模型进行分析,构建Nomogram图,见图 1,利用ROC曲线和Hosmer-Lemeshow偏差性检验对logistic回归模型验证,包括内部(建模组)和外部(验证组)验证,两组AUC值分别为0.841、0.756,提示模型诊断能力良好,见图 2。经Hosmer-Lemeshow检验,其模型拟合曲线与建模组和验证组数据集中的理想曲线之间的差异均无统计学意义[P=0.921(建模组),P=0.303(验证组)],提示模型预测感染发生风险与实际感染发生风险的一致性良好,有着良好的拟合优度,见图 3。decision曲线分析显示该模型在较大的阈值内均有较高的获益性,该模型有一定临床意义,见图 4。
 |
| 图 1 老年性痴呆患者合并隐匿性肺炎风险模型的Nomogram图 Figure 1 Nomogram of risk model for OP in senile dementia patients |
 |
| 图 2 老年性痴呆患者合并隐匿性肺炎风险模型的ROC曲线 Figure 2 ROC curve of risk model for OP in senile dementia patients |
 |
| 图 3 老年性痴呆患者合并隐匿性肺炎风险模型的calibration曲线 Figure 3 Calibration curve of risk model for OP in senile dementia patients |
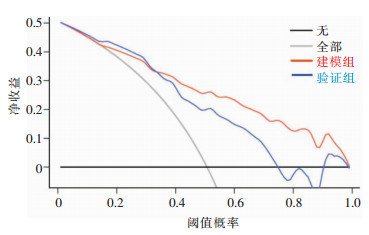 |
| 图 4 老年性痴呆患者合并隐匿性肺炎风险模型的decision曲线 Figure 4 Decision curve of risk model for OP in senile dementia patients |
对于老年性痴呆患者,由于自身免疫力相对偏低,部分患者卧床时间长,咳嗽反射敏感性降低,加之痴呆患者呼吸中枢调节失控,呼吸道分泌物不易排出,肺部病原体清除能力下降,患者主观难以表达自身感受,很容易发展成肺部感染;反复肺部感染可导致缺血缺氧性脑病,肺功能下降,痴呆症状加重,机体反应迟钝,抑制临床症状[8],因此,老年性痴呆患者更容易出现隐匿性肺炎,而且呼吸道症状往往不典型[6, 9-10],消化系统、神经系统症状往往是隐匿性肺炎主要临床表现,可表现为头晕,乏力,食欲下降、消化不良等,影响其预后的主要因素包括肾衰竭、呼吸衰竭、休克等[11]。由于缺乏诊断的明确性,隐匿性肺炎常出现误诊,延误治疗,加之患者高龄、基础疾病多等因素,容易并发其他器官功能疾病,造成住院时间延长,增加病死率[12]。因此,深入探讨老年性痴呆患者并发隐匿性肺炎的危险因素,对于及早发现病情,减少误诊,改善预后有着重要意义。
本研究对老年性痴呆患者并发隐匿性肺炎的临床危险因素展开分析, 单因素分析:年龄≥80岁、重度痴呆、痴呆病程≥10年、长期卧床、合并有糖尿病、营养不良与患者发生隐匿性肺炎有较密切的关系;多因素分析提示年龄≥80岁、重度痴呆、痴呆病程≥10年、糖尿病、长期卧床是老年性痴呆患者发生隐匿性肺炎的独立危险因素。年龄是患者发生隐匿性肺炎的危险因素,主要由于年龄增长,患者身体生理功能衰减,加之原有基础疾病及其他诱因,缺乏发热、咳嗽等典型临床症状,导致隐匿性感染[13]。随着痴呆病程延长,痴呆严重程度增加,患者脑干调节功能进一步下降,自主咳嗽能力下降,肺部清除病原体能力减弱, 隐匿性感染出现概率增加。对于糖尿病患者,可出现神经内分泌激素调节紊乱,由于糖皮质激素分泌亢进,下丘脑-垂体-甲状腺轴功能异常,可出现呼吸减慢、反射减弱、体温降低等表现掩盖感染症状,导致隐匿性肺炎的发生[14-17]。
Nomogram图是将多个预测指标整合后再使用带有刻度的线段绘制在同一平面上的图形,旨在以绘图的方法来阐述不同变量之间的关系[18]。以图形方式表达疾病与风险因素之间的数值关系,其优势在于可以通过评分系统预测个体患者的发病率或存活率,而无需计算复杂的公式,不仅可以一目了然地提供影响特定疾病的重要危险因素,还可以根据特定危险因素值的变化识别发病率、复发率或存活率的变化,因此Nomogram图对于一线医护人员评估患者病情非常有用[19]。基于上述5项危险因素建立风险Nomogram预测图,各因素给予相应的分值,可依照线段将每项危险因素的评分求和得出总分来预测老年性痴呆患者合并隐匿性肺炎的发生率。模型的验证结果也显示出良好的风险预测能力(训练集和验证集的AUC分别为0.841、0.756),校准图(calibration图)表明构建的Nomogram图可以准确预测老年性痴呆患者发生隐匿性肺炎的风险。
总之,在临床上对于老年性痴呆患者合并年龄≥80岁、重度痴呆、痴呆病程(≥10年)、糖尿病、长期卧床等因素,如出现神经系统、消化系统等非呼吸道症状,需考虑患者是否存在隐匿性肺炎的可能,尽快完善肺部影像学、炎性指标检查,确诊隐匿性感染后,尽早给予抗感染等治疗措施,改善患者预后,降低病死率。
| [1] |
Murphy CG, van de Pol AC, Harper MB, et al. Clinical predictors of occult pneumonia in the febrile child[J]. Acad Emerg Med, 2007, 14(3): 243-249. DOI:10.1197/j.aem.2006.08.022 |
| [2] |
Chisti MJ, Salam MA, Sharifuzzaman, et al. Occult pneumonia: an unusual but perilous entity presenting with severe malnutrition and dehydrating diarrhoea[J]. J Health Popul Nutr, 2009, 27(6): 808-812. |
| [3] |
曹桂花, 郭建斌, 薛明涛, 等. 高龄老年患者隐匿性肺炎的临床特点及危险因素分析[J]. 中华老年医学杂志, 2019, 38(6): 640-643. DOI:10.3760/cma.j.issn.0254-9026.2019.06.011 |
| [4] |
Wu Y, Hu HF, Cai JL, et al. A prediction nomogram for the 3-year risk of incident diabetes among Chinese adults[J]. Sci Rep, 2020, 10(1): 21716. DOI:10.1038/s41598-020-78716-1 |
| [5] |
贾建平, 魏翠柏. 2018中国痴呆与认知障碍诊治指南(二): 阿尔茨海默病诊治指南[J]. 中华医学杂志, 2018, 98(13): 971-977. DOI:10.3760/cma.j.issn.0376-2491.2018.13.004 |
| [6] |
杨燕丽, 张秋玲, 杨璐, 等. 老年2型糖尿病患者隐匿性肺部感染病原学及其危险因素[J]. 中华医院感染学杂志, 2021, 31(1): 1-5. |
| [7] |
Jehi L, Ji XG, Milinovich A, et al. Development and validation of a model for individualized prediction of hospitalization risk in 4, 536 patients with COVID -19[J]. PLoS One, 2020, 15(8): e0237419. DOI:10.1371/journal.pone.0237419 |
| [8] |
Wilfong EM, Lentz RJ, Guttentag A, et al. Interstitial pneumonia with autoimmune features: an emerging challenge at the intersection of rheumatology and pulmonology[J]. Arthritis Rheumatol, 2018, 70(12): 1901-1913. DOI:10.1002/art.40679 |
| [9] |
谢飞, 赵明学, 张滢, 等. 血管性痴呆患者并发肺部感染现状及其影响因素研究[J]. 中华医院感染学杂志, 2017, 27(11): 2473-2475, 2483. |
| [10] |
Mardirossian M, Pompilio A, Crocetta V, et al. In vitro and in vivo evaluation of BMAP-derived peptides for the treatment of cystic fibrosis-related pulmonary infections[J]. Amino Acids, 2016, 48(9): 2253-2260. DOI:10.1007/s00726-016-2266-4 |
| [11] |
Lee R, Nayernama A, Jones SC, et al. Ibrutinib-associated Pneumocystis jirovecii pneumonia[J]. Am J Hematol, 2017, 92(11): E646-E648. DOI:10.1002/ajh.24890 |
| [12] |
Zeng J, Lu C, Deng QH. Prenatal exposure to diurnal tempera-ture variation and early childhood pneumonia[J]. J Therm Biol, 2017, 65: 105-112. DOI:10.1016/j.jtherbio.2017.02.012 |
| [13] |
Marrie TJ, File TM Jr. Bacterial pneumonia in older adults[J]. Clin Geriatr Med, 2016, 32(3): 459-477. DOI:10.1016/j.cger.2016.02.012 |
| [14] |
Mirboluk AA, Rohani F, Asadi R, et al. Thyroid function test in diabetic ketoacidosis[J]. Diabetes Metab Syndr, 2017, 11(Suppl 2): S623-S625. |
| [15] |
Liang YZ, Dong J, Zhang J, et al. Identification of neuroendocrine stress response-related circulating MicroRNAs as biomarkers for type 2 diabetes mellitus and insulin resistance[J]. Front Endocrinol (Lausanne), 2018, 9: 132. DOI:10.3389/fendo.2018.00132 |
| [16] |
Chaker L, Korevaar TI, Medici M, et al. Thyroid function characteristics and determinants: the rotterdam study[J]. Thyroid, 2016, 26(9): 1195-1204. DOI:10.1089/thy.2016.0133 |
| [17] |
Mangen MJJ, Huijts SM, Bonten MJM, et al. The impact of community-acquired pneumonia on the health-related quality-of-life in elderly[J]. BMC Infect Dis, 2017, 17(1): 208. DOI:10.1186/s12879-017-2302-3 |
| [18] |
Martini A, Gupta A, Lewis SC, et al. Development and internal validation of a side-specific, multiparametric magnetic resonance imaging-based nomogram for the prediction of extracapsular extension of prostate cancer[J]. BJU Int, 2018, 122(6): 1025-1033. DOI:10.1111/bju.14353 |
| [19] |
Chung SM, Park JC, Moon JS, et al. Novel nomogram for screening the risk of developing diabetes in a Korean population[J]. Diabetes Res Clin Pract, 2018, 142: 286-293. DOI:10.1016/j.diabres.2018.05.036 |



