手术部位感染(surgical site infection,SSI)是结直肠癌术后常见的手术并发症之一[1],SSI的发生,不仅影响患者的术后恢复、生存质量,增加相关医疗费用,更有严重者进展为全身感染而导致死亡,在围手术期对SSI的发生进行评估有助于临床医务人员采取有效的防控措施,减少感染的发生。美国麻醉医师协会分级(American Society of Anesthesiologists physical status classification,ASA分级)可对手术患者的体格、全身情况进行分级,用于评价患者耐受手术和麻醉的风险及风险大小,虽然ASA评分的设计本意是作为麻醉风险评估系统,但根据以往研究显示其不仅可以作为术后死亡的影响因素[2],也是结直肠癌手术患者发生SSI的独立危险因素[3],但针对ASA评分是否可以评估结直肠癌患者术后发生SSI的风险未见报道。而关于手术时间对SSI发病率的影响,目前的临床研究都支持手术时间延长可使术后SSI发病率明显增高[4-5],但均是基于所有纳入病例的总体研究,尚未见根据患者围手术期状态与手术时间对SSI发病率进行分层分析的报道。因此,本研究对某院430例接受手术治疗的结直肠癌患者进行回顾性分析,检验ASA分级在结直肠癌患者术后发生SSI风险评估中的价值;并探讨不同ASA分级下手术时间的长短对SSI发病率的影响。
1 资料与方法 1.1 资料来源回顾性收集2018年1月—2019年12月普通外科病房所有行结直肠癌手术患者的临床资料进行分析,所有病例经术后病理确诊,排除多器官恶性肿瘤转移、妊娠或哺乳期妇女、临床资料不全的病例。
1.2 麻醉评分方法由该院麻醉科医生应用ASA评分标准在术前对患者进行评分,ASA评分根据患者体质状况和手术危险性进行分类,于麻醉前将手术患者分为6级,见表 1。低风险ASA评分组(ASAⅠ、Ⅱ级),患者麻醉和手术耐受力良好;中风险ASA评分组(ASA Ⅲ级),患者麻醉中有一定危险,麻醉前需要充分准备,积极预防可能发生的并发症;高风险ASA评分组(ASA Ⅳ级、Ⅴ级),患者麻醉危险性极大,麻醉耐受力极差,随时有死亡的危险。
| 表 1 ASA分级标准 Table 1 ASA classification standard |

|
结直肠癌手术患者常规开展以下围手术期保护措施:(1)术中保温,手术台预热,手术过程中保温毯维持加热;输注液体应用电子加温仪进行预热保温;减少患者暴露面积,做好术区以外肢体的保暖;控制呼吸道恒定的温度和湿度。确保手术患者术中体温维持在36.3℃左右。(2)围手术期给予高浓度(80%)吸氧。
1.4 SSI诊断标准所有病例由普通外科医生观察患者术后情况后诊断SSI并回访,由医院感染管理专职人员根据《医院感染诊断标准(试行)》[6],结合患者临床资料,对所有SSI病例进行复核。
1.5 统计学方法应用SPSS 26.0软件分析。定量资料采用均数±标准差进行描述,采用方差分析进行比较;分类资料用频数、率进行描述,采用χ2检验、趋势卡方检验或Fisher’s确切概率法进行检验;应用受试者工作特征曲线(ROC曲线)分析反映诊断效能。P≤0.05为差异有统计学意义。
2 结果 2.1 患者基本情况共纳入2018年1月—2019年12月普通外科病房行结直肠癌手术患者430例,其中结肠癌手术患者243例(主要行结肠癌根治术、结肠部分切除术),直肠癌手术患者187例(主要行直肠癌根治术、直肠部分切除术),所有病例经术后病理确诊。男性238例,女性192例;SSI组年龄为(63.58±11.51)岁,非SSI组为(63.79±12.87)岁。患者性别、年龄、恶性肿瘤类型、手术时机比较,差异均无统计学意义(均P>0.05)。开腹手术患者SSI发病率(20.86%)高于腹腔镜手术患者(8.61%),差异有统计学意义(P<0.001)。见表 2。
| 表 2 SSI组与非SSI组结直肠癌手术患者基本情况比较 Table 2 Comparison of basic conditions of colorectal cancer surgery patients in SSI group and non-SSI group |

|
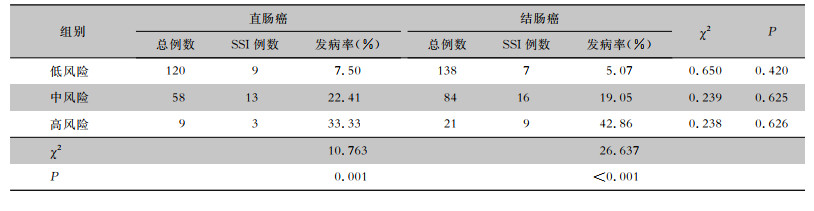
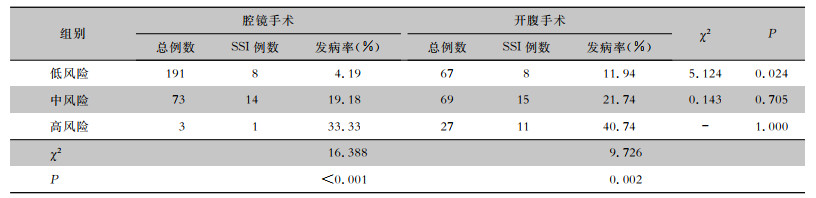
430例结直肠癌手术患者中,SSI患者57例,SSI发病率13.26%。其中低风险组258例,中风险组142例,高风险组30例。趋势性卡方检验显示,随着ASA评分的升高,结肠癌与直肠癌两组患者SSI发病率均逐渐升高(均P<0.05),见表 3。腔镜手术与开腹手术两组患者SSI发病率也随ASA评分升高呈上升趋势(均P<0.05),见表 4。
| 表 3 结直肠癌患者ASA评分与SSI的相关性分析 Table 3 Relationship between ASA score and SSI in patients with colorectal cancer |
|
| 表 4 不同手术方式患者ASA评分与SSI的相关性分析 Table 4 Relationship between ASA score and SSI in patients with different surgical methods |
|
本研究中SSI患者共检出病原菌25株,其中革兰阳性菌7株,中风险组检出5株粪肠球菌,高风险组检出2株屎肠球菌;革兰阴性菌17株,低风险组检出5株(大肠埃希菌3株,铜绿假单胞菌、克雷伯菌属各1株);中风险组10株(大肠埃希菌7株,铜绿假单胞菌2株,阴沟肠杆菌1株);高风险组检出2株(鲍曼不动杆菌、摩氏摩根菌各1株);真菌1株,为低风险组检出。
2.4 不同ASA评分组SSI感染部位构成情况57例SSI的感染部位分别为表浅切口29例(其中低风险组7例,中风险组16例,高风险组6例),深部切口2例(低风险、高风险组各1例),器官腔隙26例(低风险组8例,中风险组13例,高风险组5例)。
2.5 ASA评分对结直肠癌患者SSI的预测效果采用ROC曲线评估ASA评分对SSI的预测效能,结果显示ROC曲线下面积为0.706,95%CI:0.631~0.780,差异有统计学意义(P<0.05),见图 1。
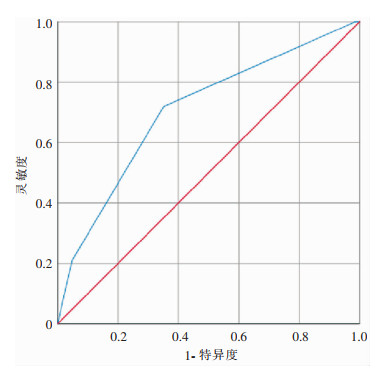 |
| 图 1 ASA评分对结直肠癌患者SSI预测的ROC曲线 Figure 1 ROC curve of ASA score for predicting SSI in colorectal cancer patients |
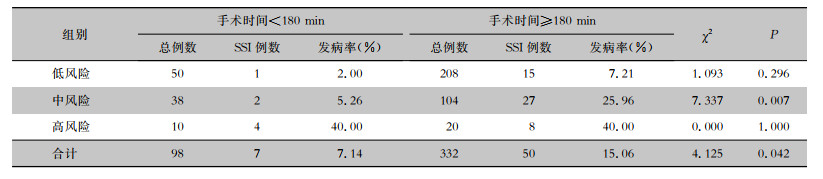
手术时间<180 min的98例结直肠癌手术患者中,SSI 7例,SSI发病率7.14%;手术时间≥180 min的332例结直肠癌手术患者中,SSI 50例,SSI发病率15.06%,两组比较差异有统计学意义(χ2=4.125,P=0.042)。
2.7 各ASA评分组不同手术时间的SSI发病率比较卡方检验显示,对于低、高风险ASA评分组,不同手术时间患者SSI发病率比较,差异无统计学意义(均P>0.05);中风险ASA评分组,手术时间≥180 min组的SSI发病率(25.96%)高于手术时间<180 min组(5.26%),差异有统计学意义(P<0.05),见表 5。
| 表 5 各ASA评分组不同手术时间的SSI发病率比较 Table 5 Comparison of incidence of SSI in different ASA groups with different operation time |
|
手术是治疗结直肠癌的重要手段,人体结肠和直肠肠腔内细菌含量较高,菌群复杂,且术中腹部切口容易被粪便污染,导致结直肠癌术后SSI发病率较高。本研究中结直肠癌患者SSI发病率为13.26%,与徐海东等[7]研究报道的我国结直肠癌患者术后SSI发病率为14%相近,而国外Artinyan等[8]进行了一项12 075例患者的大样本研究,发现结直肠癌术后SSI发病率为22.5%,与国内结果有一定差异,可能与样本量、地域等因素有关。
ASA分级为术前判断外科手术和麻醉风险的最有价值的方法之一,被广泛应用于术后并发症发生率和围手术期病死率的风险评估,如对胃癌患者术后生存时间的影响[9],与穿孔性溃疡术后短期病死率和长期生存率的关系[10],肝癌患者术中输血、术后并发症的风险评估[11],在胃肠道手术中ASA评分与术后病死率的关系[12]等。
本研究结果显示,随着ASA评分级别的升高,结肠癌、直肠癌患者的SSI发病率均逐步升高。ASA分级是根据患者全身疾病状态所确定,ASA评分越高,患者的系统性疾病越重,耐受外科创伤的能力越弱,心、脑等重要器官的功能下降,且骨髓造血功能与免疫功能低下[13],无法代偿肿瘤或手术带来的创伤,因此抗感染能力下降,围手术期并发症及术后恢复时间也会较ASA评分低的患者更多/长[11]。应用ROC曲线反映ASA分级的诊断效能,曲线下面积为0.706,有统计学意义(P<0.05),ROC曲线下面积反映了诊断效能的准确性,指标范围为0.5~1.0,面积越大,预测效能越准确,一般>0.7即可认为预测效果佳[14],即ASA分级能够较准确的评估结直肠癌患者手术后发生SSI的风险。如果患者手术前ASA分级为Ⅲ级及以上时[15],外科医生应和麻醉医生进行沟通,尽可能改善患者全身状态,有效避免手术后感染和死亡的发生。本研究中开腹手术患者SSI发病率(20.86%)高于腹腔镜手术患者(8.61%),与以往文献的研究结果相符[16],表明腹腔镜手术具有降低SSI风险的优势。因此,符合适应证且无禁忌证的结直肠癌患者在技术条件成熟的情况下开展腹腔镜手术对避免SSI的发生更具有优势。
本研究结果表明ASA分级与结直肠癌患者SSI部位构成无相关性,结果还显示ASA评分对SSI检出的病原菌分布也未产生影响。ASA评分是对患者术前全身状态的评估,对发生SSI的风险有一定的指导和辅助作用,但绝非围手术期评价患者的全部指标,在临床实践过程中,外科医生更应该关注患者的基础疾病、手术方式选择、术中监测等方面,经综合判断将ASA评分作为SSI发生的参考指标。
同时,针对手术时间长短对结直肠癌患者手术后SSI的影响进行了研究,结果显示手术时间<180 min的患者SSI发病率(7.14%)低于手术时间≥180 min的患者(15.06%)。肠道手术的持续时间与手术后SSI的发生密切相关,目前已得到临床研究的认可[17],本研究也获得一致结果。但根据患者ASA评分与手术时间对SSI发病率进行分层分析时发现,仅中风险ASA评分组不同手术时间患者SSI发病率比较差异有统计学意义。分析以上结果的出现,可能原因为:(1)低风险ASA评分组患者手术前全身状态、免疫基础较好,手术时间的长短对手术后是否发生SSI的影响较小;(2)对于高风险ASA评分组患者,严重的系统性疾病、重要器官的衰竭、机体抗创伤能力的下降等多重负面因素带来的SSI感染风险已经无法被手术时间提供的保护因素所抵消;(3)进行分组后,每组样本量较小,特别是低风险组感染病例的减少,因此,还需继续监测,增大样本数量,进一步确认手术时间对SSI的影响。
本研究存在的不足:(1)为回顾性分析,尚需前瞻性数据及更规范的试验进一步验证;(2)分组后各组样本数量较小,存在一定的偏倚风险,可能无法反映真实情况。
综上所述,ASA评分能够评估结直肠癌患者手术后发生SSI的风险,外科医生在术前应重视并改善患者的全身状态,并尽可能缩短患者的手术时间,以降低手术后SSI的发生风险。
| [1] |
汪晓东, 孟鑫宇, 刘健博, 等. 数据库研究第八部分: 结直肠癌术后风险与并发症[J]. 中国普外基础与临床杂志, 2021, 28(3): 369-375. |
| [2] |
徐康, 陈南来. 老年患者急诊结直肠手术后疗效及风险因素研究[J]. 西部医学, 2013, 25(10): 1494-1496. DOI:10.3969/j.issn.1672-3511.2013.10.018 |
| [3] |
高铭, 戴刚, 蔡卓玮, 等. 结直肠癌术后并发症的风险预测模型[J]. 中国普外基础与临床杂志, 2021, 28(2): 252-255. |
| [4] |
Bekelis K, Coy S, Simmons N. Operative duration and risk of surgical site infection in neurosurgery[J]. World Neurosurg, 2016, 94: 551-555.e6. DOI:10.1016/j.wneu.2016.07.077 |
| [5] |
成昌霞, 周学颖, 李福玮, 等. 手术时间对手术切口感染影响的研究[J]. 中华医院感染学杂志, 2016, 26(5): 1111-1112, 1123. |
| [6] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [7] |
徐海东, 孙子雯, 肖瑞雪, 等. 我国结直肠癌患者术后切口感染发生情况及其影响因素、病原菌分布[J]. 山东医药, 2017, 57(29): 68-71. DOI:10.3969/j.issn.1002-266X.2017.29.023 |
| [8] |
Artinyan A, Orcutt ST, Anaya DA, et al. Infectious postope-rative complications decrease long-term survival in patients undergoing curative surgery for colorectal cancer: a study of 12, 075 patients[J]. Ann Surg, 2015, 261(3): 497-505. DOI:10.1097/SLA.0000000000000854 |
| [9] |
陈思曾, 穆建成. 术前ASA分级及手术范围对胃癌根治术患者预后的影响[J]. 中国普通外科杂志, 2015, 24(10): 1363-1366. DOI:10.3978/j.issn.1005-6947.2015.10.004 |
| [10] |
Dadfar A, Edna TH. Epidemiology of perforating peptic ulcer: a population-based retrospective study over 40 years[J]. World J Gastroenterol, 2020, 26(35): 5302-5313. DOI:10.3748/wjg.v26.i35.5302 |
| [11] |
董健, 张谞丰, 马峰, 等. ASA评分在肝癌患者外科治疗风险评估中的作用[J]. 中国普通外科杂志, 2014, 23(7): 910-914. |
| [12] |
Sauvanet A, Mariette C, Thomas P, et al. Mortality and morbidity after resection for adenocarcinoma of the gastroesophageal junction: predictive factors[J]. J Am Coll Surg, 2005, 201(2): 253-262. DOI:10.1016/j.jamcollsurg.2005.02.002 |
| [13] |
Hu WH, Chen HH, Lee KC, et al. Assessment of the addition of hypoalbuminemia to ACS-NSQIP surgical risk calculator in colorectal cancer[J]. Medicine (Baltimore), 2016, 95(10): e2999. DOI:10.1097/MD.0000000000002999 |
| [14] |
王力红, 魏楠, 赵霞, 等. 老年患者中央导管相关血流感染风险预测评分模型构建与验证[J]. 中国感染控制杂志, 2019, 18(3): 225-231. |
| [15] |
Ko CS, Choi NR, Kim BS, et al. Totally laparoscopic total gastrectomy using the modified overlap method and conventional open total gastrectomy: a comparative study[J]. World J Gastroenterol, 2021, 27(18): 2193-2204. DOI:10.3748/wjg.v27.i18.2193 |
| [16] |
黄定桂, 陆桂皎, 施雅文, 等. 普通外科腹腔镜手术患者切口感染监测[J]. 中国感染控制杂志, 2015, 14(11): 746-748. DOI:10.3969/j.issn.1671-9638.2015.11.007 |
| [17] |
程会昌, 常金亮, 丁艺超. 肠道手术患者术前免疫功能及手术时间对术后切口感染的影响观察[J]. 中国处方药, 2019, 17(5): 117-118. |



