2. 四川大学华西医院感染管理部, 四川 成都 610041
2. Department of Infection Management, West China Hospital, Chengdu 610041, China
肺炎克雷伯菌是导致临床感染的重要病原菌之一,且常对多种抗菌药物不敏感,碳青霉烯类抗生素被认为是治疗多重耐药革兰阴性菌的最后一道防线,但根据历年CHINET耐药性监测数据显示,肺炎克雷伯菌对碳青霉烯类抗生素耐药率不断攀升,对亚胺培南和美罗培南的耐药率分别从2005年的3.0%、2.9%上升至2017年的20.9%、24.0%,且耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)常表现为泛耐药或全耐药[1],意味着患者一旦发生CRKP感染,将很难找到有效的抗菌药物治疗。因此,CRKP已成为当前临床抗感染的难题。为预防CRKP感染,有必要对其危险因素进行探究。
国内外多项研究[2-4]表明,CRKP感染或定植的常见危险因素包括抗菌药物暴露、入住重症监护病房(ICU)、侵入性操作、长期住院等。一项关于CRKP感染危险因素的Meta分析[5]结果显示,抗菌药物使用,特别是碳青霉烯类是CRKP感染最常见的危险因素;也有研究[6-7]报道,喹诺酮类及第三、四代头孢菌素也是CRKP感染的独立危险因素。现有关于抗菌药物暴露与CRKP相关性的研究多为单中心、小样本研究,尚无关于不同种类抗菌药物暴露与CRKP相关性的Meta分析。另外,不同研究中对照组的选择可能对CRKP感染危险因素的研究结果有一定影响,如以碳青霉烯类敏感肺炎克雷伯菌(carbapenem- susceptible Klebsiella pneumoniae,CSKP) 感染患者或培养阴性患者作为对照组,与CRKP组进行比较。在有关碳青霉烯类耐药的危险因素研究中,Harris等[8]发现,若采用敏感病原菌感染者作为对照组将会高估碳青霉烯类导致碳青霉烯类耐药的风险,而Lepelletier等[9]的结论却恰恰相反。
本文采用Meta分析的方法,归纳不同抗菌药物暴露对CRKP感染或定植的风险,同时,也将探讨此类研究中不同对照组对研究结果的影响。
1 材料与方法 1.1 文献检索计算机检索PubMed、Embase、Web of Science、Cochrane Library、CNKI、CBM、维普、万方,并辅以手工检索。检索从建库至2019年11月22日公开发表的文献,采用自由词与主题词相结合的方法。中文检索词包括"肺炎克雷伯菌、碳青霉烯酶、碳青霉烯不敏感、碳青霉烯耐药、危险因素、相关因素、病因、病例对照",英文检索词包括"Klebsiella pneumoniae、Klebsiella rhinoscleromatis、carbapenem-resistant、carbapenem-resistance、carbapenemase -producing、risk、case -control"。对纳入文献的参考文献进行手工检索,查找可能符合纳入标准的研究。对照组为CSKP的研究进入组1,对照组为未感染或定植的研究进入组2。
1.2 纳入与排除标准 1.2.1 纳入标准(1) 病例对照研究,语种限中文和英文。(2)研究对象为住院患者,病例组为CRKP患者,对照组为CSKP、未感染或定植肺炎克雷伯菌者。(3)CRKP感染危险因素分析中提供关于抗菌药物暴露的多因素logistic分析的比值比(odds ratio,OR)和95%置信区间(confidential interval,CI)。
1.2.2 排除标准(1) 重复发表的文献或数据。(2)综述、评论性文献、系统评价、Meta分析等非原始研究。(3)多因素分析结果中无抗菌药物暴露。(4)数据描述不详、不完整或无法从文献中获得OR值及95%CI的研究。(5)2010年以前发表的文献。
1.3 质量控制与评价由两名研究者根据纳入与排除标准进行独立文献筛选和质量评价,遇分歧时请第三名研究者加入共同讨论解决。采用Cochrane协作网推荐的非随机研究偏倚风险评估方法(Newcastle -Ottawa scale,NOS)对纳入研究的偏移风险进行评估。得分7分及以上为高质量研究。
1.4 原始资料的提取经纳入标准和排除标准筛选并通过质量评价后,从筛选出的每篇文献中提取以下数据信息整理成表:第一作者信息、发表年份、研究地区、研究起止时间、研究类型、样本量、比值比(odd ratio,OR)及95%抗菌药物种类等。
1.5 统计分析应用Revman 5.3软件对所收集原始数据进行统计分析。效应量的合并采用一般倒方差法,异质性检验采用χ2分析,并采用I2评估异质性大小。当纳入研究存在异质性时(I2≥50%,P<0.1)采用随机效应模型进行Meta分析;当纳入研究存在同质性时(I2<50%,P>0.1)采用固定效应模型进行Meta分析。分别采用固定和随机效应模型进行分析,合并效应量采用Z检验,从其结果一致性检测分析结果稳定性。通过绘制漏斗图和采用Egger’s法量化检测发表偏倚。
2 结果 2.1 纳入文献的基本信息及质量评价初步检索出文献2 178篇,剔除重复文献555篇,对1 623篇文献进行标题及摘要浏览,筛选出147篇文献并阅读全文,根据纳入及排除标准,最后筛选出文献40篇,发表时间为2011—2019年,均为病例对照研究,其中高质量研究共10篇。40篇研究中有32篇选取CSKP组作为对照组(纳入组1),8篇选取未感染或定植组作为对照组(纳入组2),两组纳入文献质量评级及基本资料分别见表 1。根据各研究多因素logistic回归分析结果,将感染或定植前以下种类抗菌药物的使用作为研究危险因素:任意抗菌药物、碳青霉烯类、喹诺酮类、头孢菌素、第三代或四代头孢菌素、β-内酰胺/β-内酰胺酶抑制剂、糖肽类。
| 表 1 抗菌药物暴露与CRKP感染相关性Meta分析纳入文献基本资料及质量评级得分 Table 1 Basic information and quality rating scores of included literatures for Meta-analysis on relationship between antimicrobial exposure and CRKP infection |
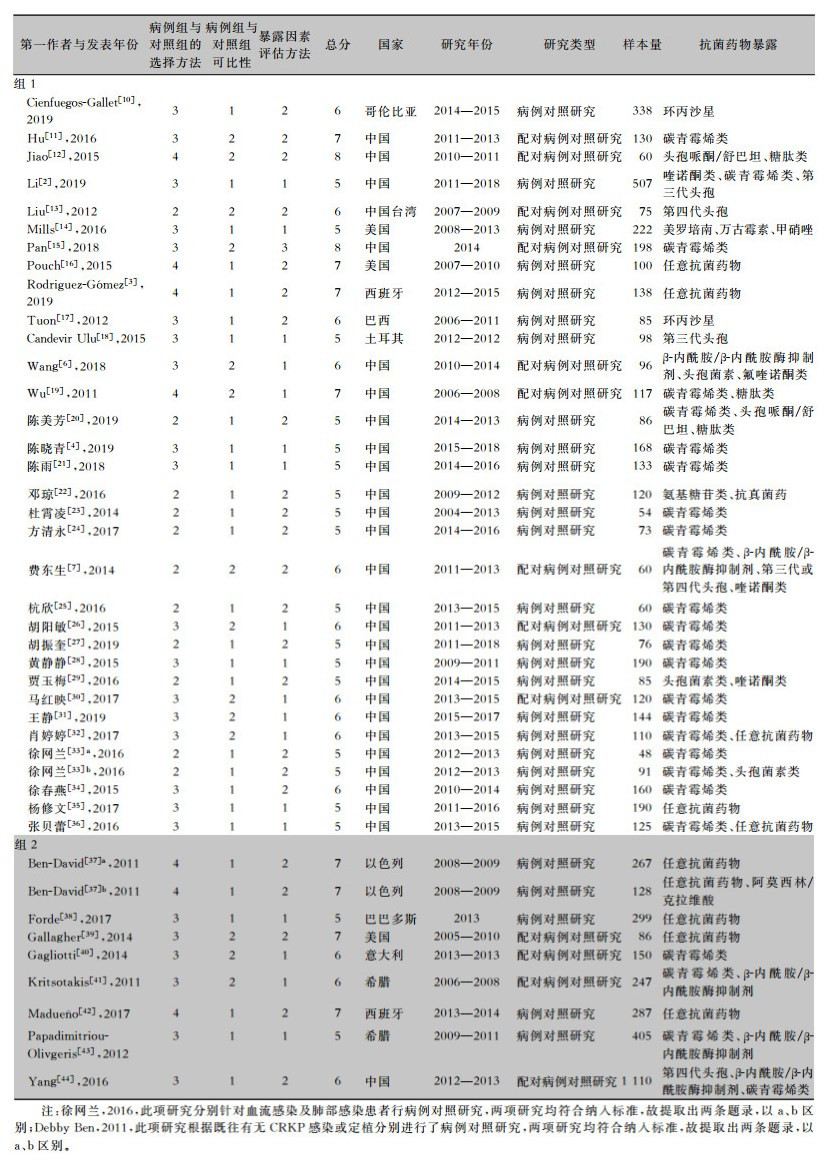
|
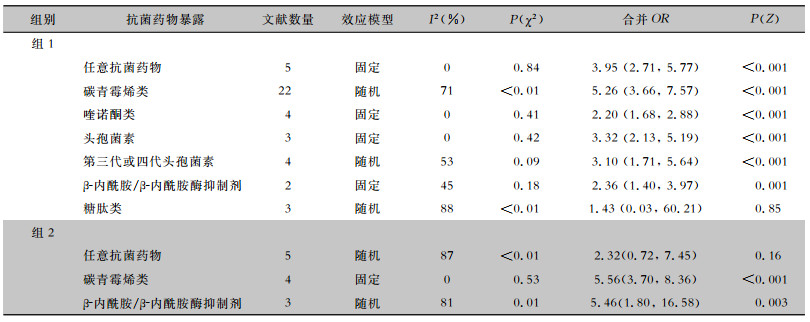
见表 2。组1:对各类抗菌药物暴露进行异质性分析,任意抗菌药物、喹诺酮类、头孢菌素类、β-内酰胺/β-内酰胺酶抑制剂的暴露无明显统计学异质性(I2<50%),故采用固定效应模型进行分析。根据分析结果,上述抗菌药物的暴露均与CRKP感染风险增加有关,且结果具有统计学意义(P<0.01)。而碳青霉烯类、第三代或四代头孢菌素、糖肽类抗菌药物暴露存在统计学异质性,采用随机效应模型分析,结果表明,碳青霉烯类及第三代或第四代头孢菌素暴露与CRKP感染风险增高密切相关,且存在统计学意义,而糖肽类不存在统计学意义。
| 表 2 抗菌药物暴露与CRKP感染相关性的Meta分析结果 Table 2 Meta-analysis on relationship between antimicrobial exposure and CRKP infection |
|
组2:对各类抗菌药物暴露进行异质性分析,碳青霉烯类暴露无明显统计学异质性,采用固定效应模型进行分析,结果表明,碳青霉烯类暴露与CRKP感染风险增加有关,结果具有统计学意义。β-内酰胺/β-内酰胺酶抑制剂存在统计学异质性,采用随机效应模型进行分析,结果表明,β-内酰胺/β-内酰胺酶抑制剂与CRKP感染风险增加有关,且存在统计学意义。任意抗菌药物暴露不存在统计学意义。
比较组1和组2分析结果,发现碳青霉烯类的合并效应量OR值在两组中无明显差别,而组2中β-内酰胺/β-内酰胺酶抑制剂的合并效应量OR值较组1高,见图 1。
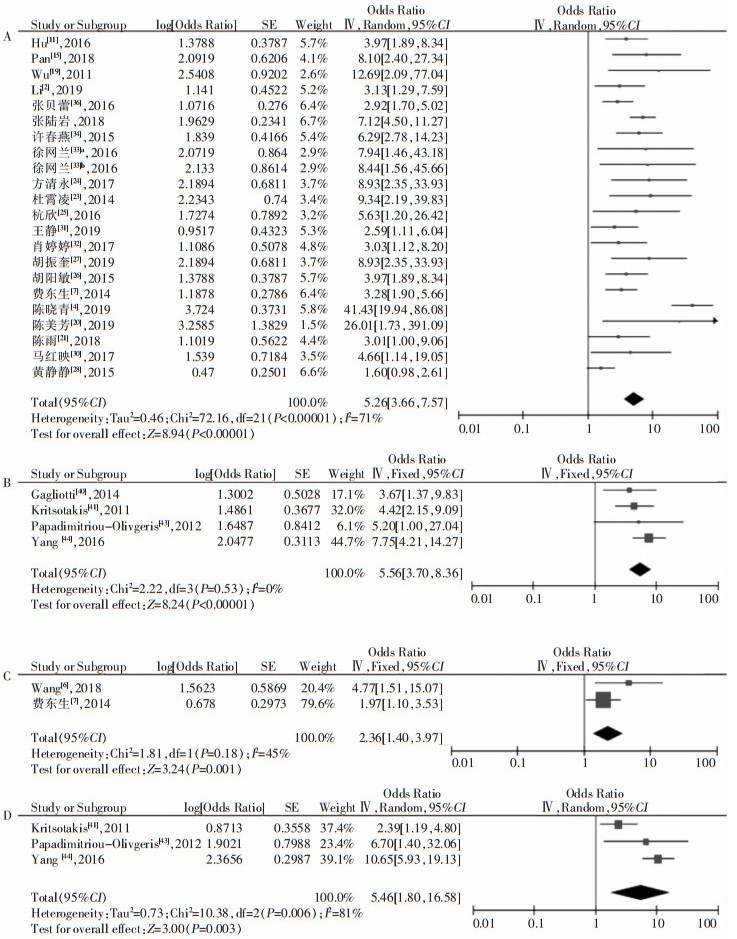 |
| 注:树形图A、B、C、D分别为组1碳青霉烯类,组2碳青霉烯类,组1 β-内酰胺/β-内酰胺酶抑制剂,组2 β-内酰胺/β-内酰胺酶抑制剂的合并效应量。 图 1 抗菌药物暴露与CRKP感染相关性Meta分析结果 Figure 1 Meta-analysis on relationship between antimicrobial exposure and CRKP infection |
分别采用固定效应模型和随机效应模型对组1和组2各类抗菌药物暴露因素进行分析,组2中任意抗菌药物采用固定效应模型分析时OR值为2.02(1.41, 2.90),采用随机效应模型分析时OR值为2.32(0.72, 7.45),包含了无效值1。余两组中各类抗菌药物分析结果均未见明显差异,合并结果基本稳定,见表 3。
| 表 3 抗菌药物暴露与CRKP感染相关性Meta分析的敏感性分析结果 Table 3 Sensitivity analysis result of Meta-analysis on relationship between antimicrobial exposure and CRKP infection |
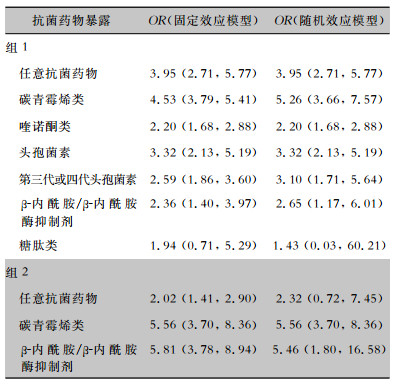
|
对纳入文献最多的组1中的碳青霉烯类抗生素进行发表偏倚分析,Egger’s法检验提示,未发现具有统计学意义的发表偏倚(P=0.083, 95%CI:-4.42-0.29),见图 2。
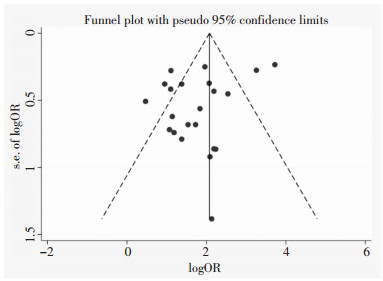 |
| 图 2 抗菌药物暴露与CRKP感染相关性Meta分析的发表偏倚漏斗图 Figure 2 Funnel plot of publication bias in Meta-analysis on relationship between antimicrobial exposure and CRKP infection |
本研究首要目的是探究不同类型抗菌药物与CRKP感染或定植的相关性,研究结果显示,尽管对照组选择不同,两组均提示碳青霉烯类和β-内酰胺/β-内酰胺酶抑制剂暴露增加了CRKP感染或定植的风险,组1还表明喹诺酮类和头孢菌素类暴露可增加获得CRKP的风险,此结论与相关研究[45-46]结论相同。而常被用作治疗严重或耐药革兰阳性菌感染的糖肽类抗生素似乎与CRKP无明显相关性,此结论与相关研究[12, 19]的观点相悖,Zavascki等[47]研究成果也支持糖肽类抗生素诱导革兰阴性菌耐药性产生,原因可能是清除了肠道微环境中的革兰阳性菌,而革兰阴性菌被选择出来。抗菌药物诱导细菌耐药的机制非常复杂,而且不同种类抗菌药物诱导耐药的机制不尽相同[46],因此在研究抗菌药物作为细菌耐药危险因素研究时,有必要对抗菌药物分门别类进行分析。
本研究次要目的是探讨在抗菌药物作为耐药菌危险因素的研究中,对照组的选取对研究结果有无影响。目前,此类研究主要选取两类人群作为对照:目标细菌感染阴性组(未感染组)[37-38]或感染敏感菌株组[10-11],且后者多见。研究发现,两种选择均存在局限性。若选择未感染组与耐药目标菌株进行比较,筛选出的危险因素实际包括两部分,分别为感染和耐药的危险因素,而无法辨别哪些危险因素与耐药相关;若选择敏感菌株与目标耐药菌株进行比较,敏感菌感染者则不能代表整个可发生耐药菌感染的人群,毕竟临床上的耐药菌感染者并不都是先感染敏感菌,然后发展成耐药菌,很多患者初发感染即为耐药菌[48]。本研究中碳青霉烯类抗生素的合并效应量OR值在组1和组2中相似,而组2中β-内酰胺/β-内酰胺酶抑制剂的合并效应量OR值较组1高,尚未发现这两类研究之间存在确切的夸大或缩小研究效应量的趋势,但确实存在差异,说明对照组的选择对研究结果有一定影响,需根据研究目的慎重选择。Kaye等[48]认为针对耐药菌的病因学研究方面,病例-病例-对照研究可以部分克服上述两类研究的局限,相较于传统病例-对照研究信息量更丰富,偏差更小,值得推广。
本研究存在以下局限:纳入研究为回顾性观察性研究,对病因学的论证强度较低;其次,由于不同国家和地区经济水平及医疗条件等不同,可能会导致各类抗菌药物的使用在分布上存在差异,由此也会影响研究结果的准确性;第三,患者的基础疾病复杂,未根据病情做分层讨论。
综上所述,抗菌药物暴露会增加CRKP感染风险,为减少耐药发生,应加强抗菌药物合理、规范使用,优化感染及耐药诊断方法,鼓励新型抗感染治疗方法的研究,加强微生物及其耐药性的监测。在抗菌药物作为微生物耐药危险因素的观察性研究中,对照组的选择会对研究结果产生一定影响,应根据自身研究特点谨慎选择。
| [1] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [2] |
Li Y, Shen H, Zhu C, et al. Carbapenem-resistant Klebsiella pneumoniae infections among ICU admission patients in central China: prevalence and prediction model[J]. Biomed Res Int, 2019, 2019: 9767313. |
| [3] |
Rodriguez-Gómez J, Pérez-Nadales E, Gutiérrez-Gutiérrez B, et al. Prognosis of urinary tract infection caused by KPC-producing Klebsiella pneumoniae: the impact of inappropriate empirical treatment[J]. J Infect, 2019, 79(3): 245-252. DOI:10.1016/j.jinf.2019.06.014 |
| [4] |
陈晓青, 陈贤斌, 温鸿, 等. 耐碳青霉烯类肺炎克雷伯杆菌感染的危险因素分析[J]. 中国预防医学杂志, 2019, 20(5): 388-391. |
| [5] |
曾凌, 邓琼, 刘鹏, 等. 耐碳青霉烯类肺炎克雷伯菌感染危险因素的Meta分析[J]. 中华医院感染学杂志, 2017, 27(18): 4093-4097, 4122. |
| [6] |
Wang Z, Qin RR, Huang L, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection and mortality of Klebsiella pneumoniae infection[J]. Chin Med J (Engl), 2018, 131(1): 56-62. DOI:10.4103/0366-6999.221267 |
| [7] |
费东生, 曹延会, 南川川, 等. 耐碳青霉烯类抗生素肺炎克雷伯菌呼吸机相关性肺炎的危险因素[J]. 中国老年学杂志, 2014, 34(21): 5973-5976. DOI:10.3969/j.issn.1005-9202.2014.21.014 |
| [8] |
Harris AD, Samore MH, Lipsitch M, et al. Control-group selection importance in studies of antimicrobial resistance: examples applied to Pseudomonas aeruginosa, Enterococci, and Escherichia coli[J]. Clin Infect Dis, 2002, 34(12): 1558-1563. DOI:10.1086/340533 |
| [9] |
Lepelletier D, Cady A, Caroff N, et al. Imipenem-resistant Pseudomonas aeruginosa gastrointestinal carriage among hospitalized patients: risk factors and resistance mechanisms[J]. Diagn Microbiol Infect Dis, 2010, 66(1): 1-6. DOI:10.1016/j.diagmicrobio.2009.08.014 |
| [10] |
Cienfuegos-Gallet AV, Ocampo de Los Ríos AM, Sierra Viana P, et al. Risk factors and survival of patients infected with carbapenem-resistant Klebsiella pneumoniae in a KPC endemic setting: a case-control and cohort study[J]. BMC Infect Dis, 2019, 19(1): 830. DOI:10.1186/s12879-019-4461-x |
| [11] |
Hu Y, Ping Y, Li L, et al. A retrospective study of risk factors for carbapenem-resistant Klebsiella pneumoniae acquisition among ICU patients[J]. J Infect Dev Ctries, 2016, 10(3): 208-213. DOI:10.3855/jidc.6697 |
| [12] |
Jiao Y, Qin Y, Liu J, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study[J]. Pathog Glob Health, 2015, 109(2): 68-74. DOI:10.1179/2047773215Y.0000000004 |
| [13] |
Liu SW, Chang HJ, Chia JH, et al. Outcomes and characteri-stics of ertapenem-nonsusceptible Klebsiella pneumoniae bacteremia at a university hospital in Northern Taiwan: a matched case-control study[J]. J Microbiol Immunol Infect, 2012, 45(2): 113-119. DOI:10.1016/j.jmii.2011.09.026 |
| [14] |
Mills JP, Talati NJ, Alby K, et al. The epidemiology of carbapenem-resistant Klebsiella pneumoniae colonization and infection among long-term acute care hospital residents[J]. Infect Control Hosp Epidemiol, 2016, 37(1): 55-60. DOI:10.1017/ice.2015.254 |
| [15] |
Pan H, Lou Y, Zeng L, et al. Infections caused by carbapenemase-producing Klebsiella pneumoniae: microbiological chara-cteristics and risk factors[J]. Microb Drug Resist, 2019, 25(2): 287-296. DOI:10.1089/mdr.2018.0339 |
| [16] |
Pouch SM, Kubin CJ, Satlin MJ, et al. Epidemiology and outcomes of carbapenem-resistant Klebsiella pneumoniae bacte-riuria in kidney transplant recipients[J]. Transpl Infect Dis, 2015, 17(6): 800-809. DOI:10.1111/tid.12450 |
| [17] |
Tuon FF, Rocha JL, Toledo P, et al. Risk factors for KPC-producing Klebsiella pneumoniae bacteremia[J]. Braz J Infect Dis, 2012, 16(5): 416-419. DOI:10.1016/j.bjid.2012.08.006 |
| [18] |
Candevir Ulu A, Kurtaran B, Inal AS, et al. Risk factors of carbapenem-resistant Klebsiella pneumoniae infection: a serious threat in ICUs[J]. Med Sci Monit, 2015, 21: 219-224. DOI:10.12659/MSM.892516 |
| [19] |
Wu D, Cai J, Liu J. Risk factors for the acquisition of nosocomial infection with carbapenem-resistant Klebsiella pneumo-niae[J]. South Med J, 2011, 104(2): 106-110. DOI:10.1097/SMJ.0b013e318206063d |
| [20] |
陈美芳, 陈春玲, 冯加喜. 碳青霉烯类耐药肺炎克雷伯杆菌肺炎危险因素分析[J]. 中国乡村医药, 2019, 26(2): 25-26. |
| [21] |
陈雨, 徐丽, 陈军. 外科重症监护病房感染耐碳青霉烯类肺炎克雷伯菌的危险因素分析[J]. 中国血液流变学杂志, 2018, 28(2): 161-165. DOI:10.3969/j.issn.1009-881X.2018.02.011 |
| [22] |
邓琼, 徐群飞, 周芸, 等. 血液中肺炎克雷伯菌碳青霉烯类耐药危险因素的调查[J]. 中国微生态学杂志, 2016, 28(7): 816-818. |
| [23] |
杜霄凌. 2004-2013年华山医院脑脊液分离革兰阴性菌的耐药性变迁及其感染的病例对照研究[D]. 上海: 复旦大学, 2014.
|
| [24] |
方清永, 李迎丽, 邱景富. ICU耐碳青霉烯类肺炎克雷伯菌医院获得性肺炎危险因素分析[J]. 国际检验医学杂志, 2017, 38(19): 2663-2665. DOI:10.3969/j.issn.1673-4130.2017.19.003 |
| [25] |
杭欣, 张波. 耐碳青霉烯肺炎克雷伯菌易感因素分析[J]. 山西医科大学学报, 2016, 47(5): 450-454. |
| [26] |
胡阳敏. 住院患者抗菌药物使用与肺炎克雷伯菌耐药的相关性以及ICU患者CRKP感染的高危因素分析[D]. 杭州: 浙江大学, 2015.
|
| [27] |
胡振奎, 张建国, 刘朔, 等. 分析ICU患者耐碳青霉烯类肺炎克雷伯菌医院感染危险因素[J]. 中国处方药, 2019, 17(8): 133-134. |
| [28] |
黄静静, 崔巍. ICU肺炎克雷伯杆菌感染患者耐碳青霉烯类及预后的相关因素分析[J]. 浙江医学, 2015, 37(20): 1677-1680. |
| [29] |
贾玉梅, 郑玉君, 袁月, 等. 碳青霉烯类抗生素耐药肺炎克雷伯菌感染的特点及相关因素分析[J]. 临床合理用药杂志, 2016, 9(16): 1-2. |
| [30] |
马红映, 汪丽, 虞亦鸣, 等. 院内获得耐碳青霉烯类抗菌药物肺炎克雷伯菌感染的危险因素分析[J]. 中华医院感染学杂志, 2017, 27(7): 1456-1458. |
| [31] |
王静, 彭宇, 谷娅, 等. 重症监护室患者耐碳青霉烯类肺炎克雷伯菌血流感染的影响因素[J]. 中华医院感染学杂志, 2019, 29(13): 1936-1939. |
| [32] |
肖婷婷, 喻玮, 牛天水, 等. ICU患者碳青霉烯类不敏感肺炎克雷伯菌血流感染危险因素及预后分析[J]. 中国抗生素杂志, 2017, 42(12): 1090-1096. DOI:10.3969/j.issn.1001-8689.2017.12.013 |
| [33] |
徐网兰. ICU内不同部位肺炎克雷伯菌的耐药性及耐碳青霉烯类抗生素菌株感染的危险因素分析[D]. 杭州: 浙江大学, 2016.
|
| [34] |
许春燕, 余素飞, 彭敏飞, 等. 耐碳青霉烯酶肺炎克雷伯菌感染的危险因素分析[J]. 中国乡村医药, 2015, 22(24): 72-74. DOI:10.3969/j.issn.1006-5180.2015.24.040 |
| [35] |
杨修文, 崔俊昌, 赵进, 等. 医院获得性肺炎克雷伯菌血流感染的临床特征及耐药菌株感染的危险因素分析[J]. 解放军医学院学报, 2017, 38(11): 1029-1032, 1054. DOI:10.3969/j.issn.2095-5227.2017.11.008 |
| [36] |
张贝蕾, 林建东, 廖秀玉, 等. ICU下呼吸道肺炎克雷伯杆菌耐碳青霉烯类药物的危险因素研究[J]. 中国急救医学, 2016, 36(4): 324-328. DOI:10.3969/j.issn.1002-1949.2016.04.009 |
| [37] |
Ben-David D, Masarwa S, Navon-Venezia S, et al. Carbape-nem-resistant Klebsiella pneumoniae in post-acute-care facilities in Israel[J]. Infect Control Hosp Epidemiol, 2011, 32(9): 845-853. DOI:10.1086/661279 |
| [38] |
Forde C, Stierman B, Ramon-Pardo P, et al. Carbapenem-resistant Klebsiella pneumoniae in Barbados: driving change in practice at the national level[J]. PLoS One, 2017, 12(5): e0176779. DOI:10.1371/journal.pone.0176779 |
| [39] |
Gallagher JC, Kuriakose S, Haynes K, et al. Case-case-control study of patients with carbapenem-resistant and third-generation-cephalosporin-resistant Klebsiella pneumoniae bloodstream infections[J]. Antimicrob Agents Chemother, 2014, 58(10): 5732-5735. DOI:10.1128/AAC.03564-14 |
| [40] |
Gagliotti C, Giordani S, Ciccarese V, et al. Risk factors for colonization with carbapenemase-producing Klebsiella pneumoniae in hospital: a matched case-control study[J]. Am J Infect Control, 2014, 42(9): 1006-1008. DOI:10.1016/j.ajic.2014.05.028 |
| [41] |
Kritsotakis EI, Tsioutis C, Roumbelaki M, et al. Antibiotic use and the risk of carbapenem-resistant extended-spectrum-β-lactamase-producing Klebsiella pneumoniae infection in hospitalized patients: results of a double case-control study[J]. J Antimicrobial Chemother, 2011, 66(6): 1383-1391. DOI:10.1093/jac/dkr116 |
| [42] |
Madueño A, González García J, Ramos MJ, et al. Risk factors associated with carbapenemase-producing Klebsiella pneumoniae fecal carriage: a case-control study in a Spanish tertiary care hospital[J]. Am J Infect Control, 2017, 45(1): 77-79. DOI:10.1016/j.ajic.2016.06.024 |
| [43] |
Papadimitriou-Olivgeris M, Marangos M, Fligou F, et al. Risk factors for KPC-producing Klebsiella pneumoniae enteric colonization upon ICU admission[J]. J Antimicrob Chemother, 2012, 67(12): 2976-2981. DOI:10.1093/jac/dks316 |
| [44] |
Yang D, Xie Z, Xin X, et al. A model for predicting nosocomial carbapenem-resistant Klebsiella pneumoniae infection[J]. Biomed Rep, 2016, 5(4): 501-505. DOI:10.3892/br.2016.752 |
| [45] |
Curcio DJ. Antibiotic prescription in intensive care units in Latin America[J]. Rev Argent Microbiol, 2011, 43(3): 203-211. |
| [46] |
Cantón R, Horcajada JP, Oliver A, et al. Inappropriate use of antibiotics in hospitals: the complex relationship between antibiotic use and antimicrobial resistance[J]. Enferm Infecc Microbiol Clin, 2013, 31. |
| [47] |
Zavascki AP, Cruz RP, Goldani LZ. Risk factors for imipe-nem-resistant Pseudomonas aeruginosa: a comparative analysis of two case-control studies in hospitalized patients[J]. J Hosp Infect, 2005, 59(2): 96-101. DOI:10.1016/j.jhin.2004.09.007 |
| [48] |
Kaye KS, Harris AD, Samore M, et al. The case-case-control study design: addressing the limitations of risk factor studies for antimicrobial resistance[J]. Infect Control Hosp Epide-miol, 2005, 26(4): 346-351. DOI:10.1086/502550 |



