2. 山东大学护理学院, 山东 济南 250012
2. School of Nursing, Shandong University, Jinan 250012, China
脑出血是一种常见的脑血管疾病,约占全部脑卒中的20%~30%[1],起病急,病情重,急性期病死率约为30%~40%[2-3]。研究[4]表明,住院期间早期的医疗并发症或神经系统并发症是导致脑卒中患者死亡率增加的主要原因,其中肺部感染是较为常见的一种,约占5%[5]。因此,早期识别脑出血手术患者发生肺部感染的高风险人群,对提高患者生存质量和医院医疗质量有重要临床意义。已有大量研究探讨脑出血患者发生肺部感染的相关危险因素,包括气管插管、气管切开、吞咽困难、充血性心力衰竭等[4, 6],很少有研究将危险因素转化为评分模型,以方便临床应用。因此本研究旨在构建脑出血手术患者肺部感染风险预测评分模型,早期识别感染的高风险人群,有效预防肺部感染的发生,提高患者生存质量。
1 资料与方法 1.1 临床资料本研究是一个巢式病例对照研究,借助医院信息系统和医院感染监测系统,前瞻性收集2016—2018年山东省某医院603例脑出血手术患者的人口学特征、临床特征以及医院感染相关特征资料。研究经医院伦理委员会审核批准(KYLL-2018-009)。研究对象纳入标准: ①CT或MRI确诊为脑出血;②年龄≥18岁;③住院时间>48 h;④采用手术治疗;排除标准: ①仅行脑动脉造影而未进一步手术治疗;②处于妊娠期或分娩期;③严重肝、肾功能不全;④两周内服用免疫抑制剂或有免疫缺陷;⑤资料不全。
1.2 相关诊断标准依据我国卫生部2001年颁布的《医院感染诊断标准(试行)》[7],结合患者的临床表现、影像学检查、实验室检查以及病原学检查结果,确诊医院获得性肺部感染。所有感染病例由主治医师、医院感染专家和研究者共同确诊。NIHSS(National Institute of Health Stroke Scale,NIHSS)[8]是Thmos等编制的包含15个项目的神经功能检查量表,主要用于量化神经功能受损严重程度,0~4分为轻度损伤,5~15分为中度损伤,≥16分为重度损伤[9]。
1.3 研究方法 1.3.1 数据分组将603例脑出血患者按7∶3的比例随机分为建模组(422例)和验证组(181例)(随机种子数为20160648)。利用建模组数据构建风险预测评分模型并进行风险分层,利用建模组和验证组数据验证模型的判别效能。应用SPSS 22.0软件进行数据统计分析。
1.3.2 模型构建在建模组中,将单因素分析有意义的变量(P<0.05)纳入多因素logistic回归中,采用Back-Wald法筛选变量,建立logistic回归模型,识别独立危险因素。依据logistic回归模型中的偏回归系数(β值)对危险因素进行赋分。参照以往研究[10]并结合研究具体情况,本研究根据β×4(四舍五入取整数)确定危险因素的分值,其中各个变量中的参照类别为0分,依此构建风险预测评分模型。
1.3.3 模型验证利用构建的风险预测评分模型对建模组和验证组患者进行评分。以患者是否发生肺部感染为状态变量,以各患者的总风险评分值为检验变量,绘制ROC曲线,评价模型的区分度,采用Hosmer-Lemeshow(H-L)检验评价模型的校准度。
2 结果 2.1 患者一般情况前瞻性收集2016—2018年某医院603例脑出血手术患者的临床资料,其中男性275例,女性328例;年龄为(11.25±11.73)岁。发生肺部感染135例,肺部感染发生率为22.39%。建模组患者422例,肺部感染91例,感染率为21.56%;验证组患者181例,肺部感染44例,感染率为24.31%。
2.2 肺部感染危险因素识别 2.2.1 单因素分析将建模组中的422例脑出血手术患者根据是否发生肺部感染分为感染组和非感染组,进行单因素分析,结果显示,患者入院途径、GCS评分、肌力、NIHSS评分、高血压、使用呼吸机、气管切开、气管插管、留置胃管、静脉血栓、意识不清、ASA分级以及手术类型13个变量与脑出血手术患者并发肺部感染有关。见表 1。
| 表 1 脑出血手术患者肺部感染危险因素单因素分析(建模组) Table 1 Univariate analysis on risk factors for PI in cerebral hemorrhage patients undergoing surgery (modeling group) |
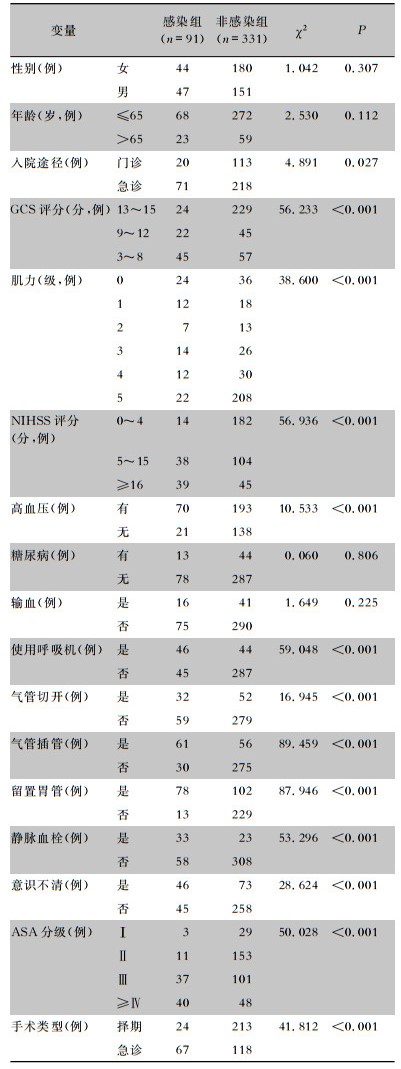
|
将单因素分析中有统计学意义的变量(P<0.05)纳入多因素logistic回归中,采用Back-Wald法筛选变量,最终纳入模型的4个变量为:气管插管(95%CI:2.092~6.977)、留置胃管(95%CI:1.982~8.761)、静脉血栓(95%CI:1.333~5.514)和ASA分级(95%CI:1.144~2.281)。见表 2。
| 表 2 脑出血手术患者肺部感染危险因素多因素分析(建模组) Table 2 Multivariate analysis on risk factors for PI in cerebral hemorrhage patients undergoing surgery (modeling group) |
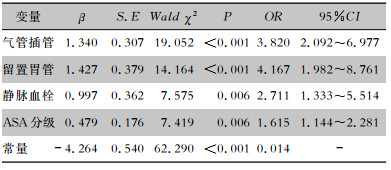
|
依据β×4构建的风险预测评分模型中,气管插管赋值5分、留置胃管为6分、静脉血栓为4分、ASA分级每增加一个级别分值增加2分,各个变量中的参照类别为0分,总分为0~21分。见表 3。利用构建的风险预测评分模型对建模组患者进行评分,计算各分值所对应的感染率,观察感染率分布情况,将患者进行风险分层。结果显示,0~6分为低风险组,感染率为4.47%;7~12分为中风险组,感染率为21.28%;13~21分为高风险组,感染率为58.65%,各风险层感染率差异有统计学意义(P<0.05)。见表 4。
| 表 3 肺部感染风险评分模型 Table 3 Risk scoring model for PI |

|
| 表 4 肺部感染风险分层 Table 4 Risk scoring stratification for PI |
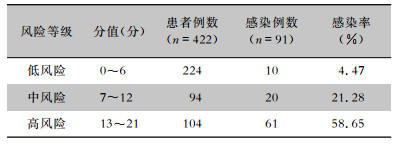
|
在建模组的422例脑出血手术患者中,通过肺部感染金标准确诊感染91例,非感染331例。利用风险评分模型对患者进行评分,以金标准诊断结果为状态变量、以风险评分值为检验变量绘制ROC曲线,结果显示建模组中模型的ROC曲线下面积(AUC)为0.864(95%CI:0.825~0.904,P<0.001),H-L检验结果为P=0.404,因此风险评分模型在建模组中具有较好的区分度和校准度(内部验证)。以相同的方法在验证组中绘制ROC曲线,结果显示AUC为0.861(95%CI:0.800~0.921,P<0.001),H-L检验结果为P=0.452,模型在验证组中依然具有良好的区分度和校准度(外部验证)。见图 1。
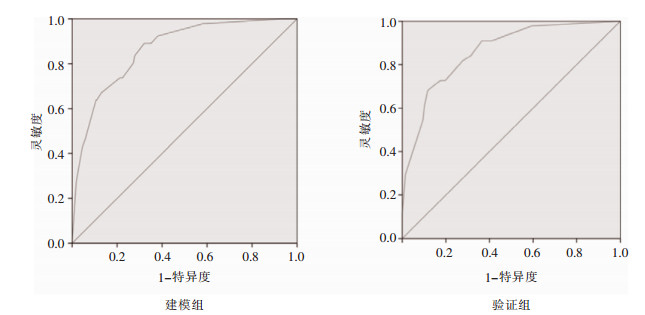 |
| 图 1 ROC曲线评价风险评分模型的区分度 Figure 1 Discriminatory validity of risk scoring model evaluated by ROC curve |
利用构建的肺部感染风险预测评分模型对验证组患者进行评分,同时计算各风险层所对应的感染率,结果显示低风险组为4.55%,中风险组为21.28%,高风险组为65.22%,各风险等级之间感染率的差异有统计学意义(P<0.05)。见表 5。
| 表 5 验证组患者风险等级与肺部感染情况比较 Table 5 Comparison of risk level and PI in patients in validation group |

|
本组研究目的主要是建立一个简单的、有效的、方便临床应用的风险评分工具,评估脑出血手术患者发生肺部感染的风险。脑出血患者常伴有脑组织的损伤,随后出现的机体免疫抑制状态使患者极易受到病原菌的侵袭[11]。本研究发现脑出血手术患者肺部感染发生率为22.39%,高于一项Meta分析结果中的10%[12]。医院感染的发生不仅可以影响患者临床预后,增加患者经济负担,同时还会增加医疗机构的经济损失[13]。因此,构建脑出血手术患者肺部感染风险预测评分模型,及早识别感染的高风险人群,采取相应地有效预防措施,对降低患者及医疗机构的经济负担有重要的临床意义。
本研究中多因素logistic回归分析结果显示,气管插管、留置胃管、静脉血栓和ASA分级是脑出血手术患者肺部感染的独立危险因素。以往研究显示,气管插管、留置胃管等侵入性操作与脑卒中患者发生肺部感染密切相关[4, 14-15]。留置胃管的患者容易发生胃内容物反流,导致误吸,引发吸入性肺炎[14]。气管插管患者呼吸道内的分泌物不易排出,加之患者口腔清洁不便,导致病原菌下移以及下呼吸道长期暴露于外界环境中,患者更容易发生肺部感染[15]。研究[16]发现,患者并发静脉血栓与肺部感染之间具有正相关性,二者互为危险因素,对影响患者预后有协同作用。ASA分级是根据患者术前体质状况和对手术危险性进行分类,ASA等级越高,患者对外科手术的耐受性越低,发生医院感染的风险越高[17]。研究证实高ASA等级是肺部感染的独立危险因素[18]。考虑到以上各变量与脑出血手术患者并发肺部感染的强关联性,本研究采用β×4(四舍五入取整数)对变量进行赋值,构建风险预测评分模型。根据各风险评分所对应的患者肺部感染发生率,将患者分为高、中、低三个风险等级,总分为0~6分的患者是低感染风险组,7~12分为中风险组,13~21分为高风险组,不同风险等级患者间肺部感染率比较,差异有统计学意义(P<0.05)。临床上医务人员可借助风险预测评分模型,定时评估患者发生肺部感染风险评分值,从而判断脑出血手术患者发生肺部感染的风险等级,以此制定针对性的预防与控制措施,尽早降低感染风险,实现医疗资源的合理分配。
研究采用ROC曲线和H-L检验(P>0.05)评价风险评分模型的区分度和校准度。一般来说,曲线下面积(AUC)大于0.7,即可认为预测效果佳,AUC越大,风险预测能力越好[19]。本研究结果显示,评分模型在建模组和验证组患者中的ROC AUC分别为0.864(95%CI:0.825~0.904,P<0.001)和0.861(95%CI:0.800~0.921,P<0.001),H-L检验结果均为P>0.05,说明建立的风险评分模型对脑出血手术患者发生肺部感染具有良好的预测能力,且模型中的评估指标在临床上比较容易获取,在识别肺部感染高危人群方面具有较好的临床应用价值,可以准确监测、及时预警,使感染防控的关口前移,优化医院感染监测模式。
本研究的局限性在于研究对象仅来自于一所三甲医院,且该模型尚未在其他医院进行过验证,后期还需开展多中心、大样本的研究对模型进行验证,进一步修改和完善模型,使模型真正适用于临床脑出血手术患者肺部感染高风险人群的筛查。
| [1] |
丛蓓, 罗金维, 韩世杰, 等. 脑出血患者临床流行病学调查[J]. 临床医学进展, 2019, 9(6): 751-755. |
| [2] |
邢海波, 牛焕江, 王长亮. 脑出血合并肺部感染患者病原菌检测、耐药性及预后探讨[J]. 中国卫生检验杂志, 2018, 28(12): 1454-1456, 1459. |
| [3] |
李美英, 马春. 脑出血病人发生医院感染的相关因素及其防控护理[J]. 护理研究, 2019, 33(4): 724-726. |
| [4] |
Lord AS, Langefeld CD, Sekar P, et al. Infection after intracerebral hemorrhage: risk factors and association with outcomes in the ethnic/racial variations of intracerebral hemorrhage study[J]. Stroke, 2014, 45(12): 3535-3542. DOI:10.1161/STROKEAHA.114.006435 |
| [5] |
Walter U, Knoblich R, Steinhagen V, et al. Predictors of pneumonia in acute stroke patients admitted to a neurological intensive care unit[J]. J Neurol, 2007, 254(10): 1323-1329. DOI:10.1007/s00415-007-0520-0 |
| [6] |
Divani AA, Hevesi M, Pulivarthi S, et al. Predictors of nosocomial pneumonia in intracerebral hemorrhage patients: a multi-center observational study[J]. Neurocrit Care, 2015, 22(2): 234-242. DOI:10.1007/s12028-014-0065-x |
| [7] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [8] |
Wu Z, Zeng M, Li C, et al. Time-dependence of NIHSS in predicting functional outcome of patients with acute ischemic stroke treated with intravenous thrombolysis[J]. Postgrad Med J, 2019, 95(1122): 181-186. DOI:10.1136/postgradmedj-2019-136398 |
| [9] |
Hoffmann S, Malzahn U, Harms H, et al. Development of a clinical score (A2DS2) to predict pneumonia in acute ischemic stroke[J]. Stroke, 2012, 43(10): 2617-2623. DOI:10.1161/STROKEAHA.112.653055 |
| [10] |
王力红, 魏楠, 赵霞, 等. 老年患者中央导管相关血流感染风险预测评分模型构建与验证[J]. 中国感染控制杂志, 2019, 18(3): 225-231. |
| [11] |
Urra X, Laredo C, Zhao Y, et al. Neuroanatomical correlates of stroke-associated infection and stroke-induced immunodepression[J]. Brain Behav Immun, 2017, 60: 142-150. DOI:10.1016/j.bbi.2016.10.004 |
| [12] |
Westendorp WF, Nederkoorn PJ, Vermeij JD, et al. Post-stroke infection: a systematic review and Meta-analysis[J]. BMC Neurol, 2011, 11: 110. DOI:10.1186/1471-2377-11-110 |
| [13] |
Kim CJ, Kim HB, Oh MD, et al. The burden of nosocomial Staphylococcus aureus bloodstream infection in South Korea: a prospective hospital-based nationwide study[J]. BMC Infect Dis, 2014, 14: 590. DOI:10.1186/s12879-014-0590-4 |
| [14] |
Hinduja A, Dibu J, Achi E, et al. Nosocomial infections in patients with spontaneous intracerebral hemorrhage[J]. Am J Crit Care, 2015, 24(3): 227-231. DOI:10.4037/ajcc2015422 |
| [15] |
中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [16] |
马利中, 董玲婉, 朱靖, 等. 老年脑卒中患者肺部感染、深静脉血栓发生率及相关性研究[J]. 中华全科医学, 2016, 14(12): 2034-2036. |
| [17] |
李亚婷, 宋甜田, 孟葳, 等. 脑卒中患者耐碳青霉烯类鲍氏不动杆菌肺部感染的影响因素与经济负担分析[J]. 中华医院感染学杂志, 2019, 29(20): 3101-3105. |
| [18] |
丁丽娜, 程琳芝, 吴晓英. 外科手术后肺部感染的危险因素分析[J]. 现代预防医学, 2018, 45(1): 178-182. |
| [19] |
魏楠, 王力红, 赵霞, 等. 老年患者导尿管相关尿路感染风险预测评分模型构建与验证[J]. 中国感染控制杂志, 2018, 17(10): 907-912. |



