2. 南昌大学眼视光学院, 江西 南昌 330000;
3. 华中科技大学同济医学院附属同济医院检验科, 湖北 武汉 430030
2. Nanchang University School of Ophthalmology and Optometry, Nanchang 330000, China;
3. Department of Laboratory Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
控制多重耐药菌医院内传播是一项重大的公共卫生挑战,物体表面作为多重耐药菌的储菌库,其清洁消毒受到高度重视。研究[1]证实,污染的物体表面可以导致多种病原菌在医院内的传播。其中,耐甲氧西林金黄色葡萄球菌(MRSA)和耐碳青霉烯类鲍曼不动杆菌(CRAB)是最常见的导致医院感染的多重耐药菌[2],且持续存活,不动杆菌在干燥物体表面存活可达3 d~5个月,金黄色葡萄球菌存活时间可达3 d~7个月[3]。多重耐药菌在物体表面的存活可引起医院感染的传播。成人重症监护病房(ICU)内医院感染暴发是由于污染环境表面引起细菌传播所导致[4-5]。因此,对重点部门进行有效的物体表面清洁消毒对降低患者的医院感染风险有重要意义。本研究通过对某院医院感染管理重点科室进行多重耐药菌管理常规环境筛查,及时反馈给相关科室,针对薄弱环节进行培训,降低了病房物体表面多重耐药菌的定植,从而有效降低医院感染风险,保障患者安全。
1 对象与方法 1.1 研究对象2018年9月—2019年8月对某院综合ICU Ⅰ病区和Ⅱ病区、器官移植科ICU、神经内科ICU、呼吸内科ICU、创伤外科ICU、儿童重症ICU(PICU)、胸外科ICU、儿外科ICU、新生儿ICU(NICU)、心外科ICU、神经外科ICU、心内科ICU、肝外科ICU、胆胰外科ICU共14个ICU(15个病区)进行物体表面的MRSA、CRAB检出情况调查。
1.2 方法 1.2.1 调查时间采取前后对照设计,分为两个阶段:第一阶段,基线调查期,2018年9—11月。第二阶段,干预期,2018年12月—2019年8月。
1.2.2 采样方法对床单元及周围环境的高频接触物体表面进行随机采样,每个ICU采集32个部位,一个部位需采两份标样,共64份标本。操作者进行手卫生后,戴口罩、帽子,使用无菌棉拭子,生理盐水充分浸润,往返涂擦采样点表面数次,采样面积为10 cm×10 cm,不规则物体表面全部采集。采用两根棉签对同一部位同时采样,然后将64份标本分成两份(每份各32份),分别涂布于MRSA显色鉴定培养基和CRAB显色鉴定培养基上,立即送至(36±1)℃恒温箱培养,48 h后观察菌落形成情况。
1.2.3 质控及结果判定MRSA显色鉴定培养基采用法国科玛嘉显色培养基干粉配制,恒温箱培养48 h后,判断是否有显色菌落形成。CRAB显色鉴定培养基采用国产显色培养基干粉配制,恒温箱培养48 h后,判断是否有显色菌落形成。如果有可疑菌落无法判定,则采用质谱仪进行鉴定。计算物体表面MRSA及CRAB的检出率。
1.2.4 干预措施2018年12月—2019年8月每季度进行ICU环境物体表面筛查,将检测结果反馈至病房,并进行清洁消毒相关培训。
1.2.4.1 多重耐药菌筛查策略基线调查时:未对物体表面进行常规采样,仅在流行暴发时进行环境物体表面采样。干预后:每季度对重点ICU物体表面进行MRSA和CRAB的筛查,采取飞行检查模式,在病房不知晓采样时间的情况下,进行全病房的多个部位采样,包括床单元周围环境的高频接触部位(床头柜、床栏、头部垫巾、引流袋、输液泵面板、呼吸机面板、监护仪面板、治疗车等),公共区域(大门门把手、洗手间门把手、洗手池水龙头、电源开关等)。每个ICU病区每季度采32个部位,每个部位分别接种MRSA培养基和CRAB培养基。
1.2.4.2 结果反馈建立多重耐药菌环境筛查反馈微信群,监测数据及时在群内反馈公开。督导相关科室做好整改,筛查前按工作常规进行清洁消毒,筛查后特别强调对污染高风险部位进行消毒清洁,如床周地面、头部垫巾、键盘、鼠标、引流袋、听诊器等。
1.2.4.3 增加消毒频次干预前:床单元、仪器设备、地面及桌面使用含有效氯500 mg/L的消毒剂清洁消毒2次/d;干预后:增加消毒频次为3次/d(时间8:00、12:00、16:00),同时增加床帘的清洗,由1次/季度改为1次/月。
1.2.4.4 针对性进行培训针对采样结果,对MRSA、CRAB检出率较高科室进行集中培训。培训内容包括:“84”含氯消毒剂的配制方法,清洁前配制含有效氯500 mg/L的消毒剂,将10 mL的“84”消毒剂倒入1 000 mL水中,混合搅匀;统一在医院库房领取消毒烘干好的干抹布,将干抹布统一浸入消毒剂中,拧干后对物体表面进行擦拭消毒,每个床单元使用2块抹布,每个床单元仪器设备使用2块抹布,使用后的抹布严格分区,扔至污染桶,不得再放入盛消毒剂的桶中;使用完的抹布不得自行消毒晾晒,直接送库房统一消毒烘干。
1.2.5 统计学方法应用Excel表录入资料,SPSS 19.0软件进行数据统计分析。计数资料采用χ2检验进行比较,P≤0.05为差异具有统计学意义。
2 结果 2.1 ICU物体表面MRSA、CRAB检出情况本研究基线调查共采集标本896份,干预后共采集标本2 880份,其中MRSA检出率由18.08%下降至0,CRAB检出率由4.46%下降至0.83%,差异均有统计学意义(均P < 0.05),每季度呈逐渐下降的趋势。见表 1。
| 表 1 干预前后ICU物体表面MRSA、CRAB检出情况 Table 1 Isolation of MRSA and CRAB on object surface in ICU before and after intervention |
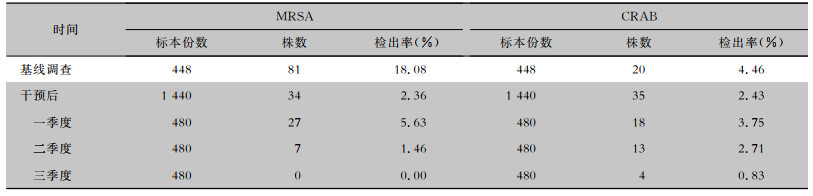
|
检出MRSA、CRAB最常见的位置分别为:床周地面(20.24%)、头部垫巾(11.31%)、呼吸机面板(7.74%)、床头柜(7.14%)、吊塔(7.14%)。见表 2。
| 表 2 ICU物体表面MRSA、CRAB常见检出位置分布 Table 2 Common sites of isolation of MRSA and CRAB on object surface in ICU |
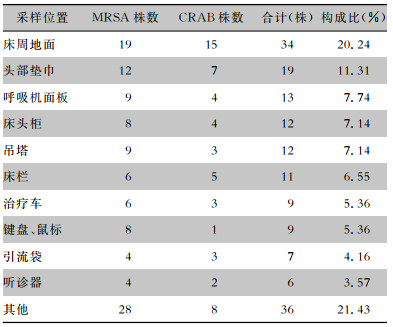
|
基线调查时呼吸内科ICU MRSA检出率最高(75.00%,24/32),干预后未检出,其次为创伤外科ICU(25.00%,8/32)、胸外科ICU(21.88%,7/32),见图 1。基线调查时呼吸内科ICU CRAB检出率最高(25.00%,8/32),干预后为3.13%(3/96);ICU Ⅰ病区基线调查时未检出CRAB,但干预后CRAB检出率最高(15.63%,15/96)。见图 2。
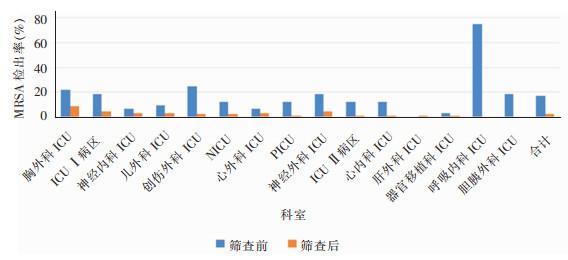 |
| 图 1 干预前后不同科室物体表面MRSA检出率柱状图 Figure 1 Histogram of isolation rates of MRSA on object surface in different departments before and after intervention |
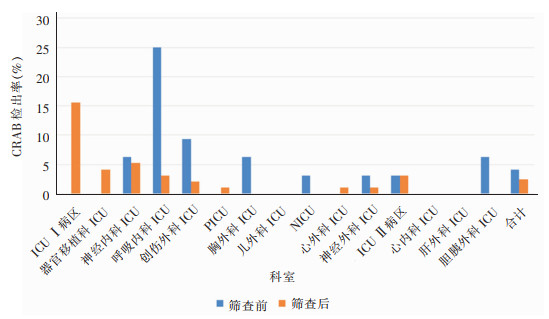 |
| 图 2 干预前后不同科室物体表面CRAB检出率柱状图 Figure 2 Histogram of isolation rates of CRAB on object surface in different departments before and after intervention |
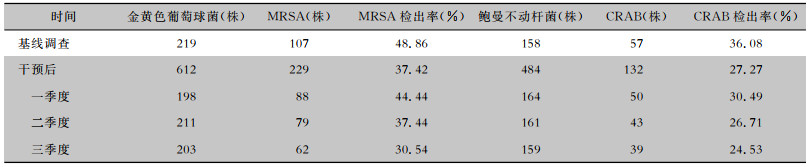
基线调查时住院患者MRSA、CRAB检出率分别为48.86%、36.08%;干预后住院患者MRSA、CRAB检出率分别为37.42%、27.27%;干预后住院患者MRSA、CRAB检出率均低于干预前,差异有统计学意义(均P < 0.05);并且每季度呈逐渐下降的趋势。见表 3。
| 表 3 干预前后住院患者MRSA、CRAB检出情况 Table 3 Isolation of MRSA and CRAB in hospitalized patients before and after intervention |
|
MRSA和CRAB引起的多重耐药菌感染治疗困难,住院花费高,常常导致罹患率和病死率高[6],成为医院感染的主要病原菌[7-9]。多项研究[10-13]表明,医院感染暴发与环境中多重耐药菌存在同源性,物体表面MRSA和CRBA是传播的重要环节。因此,做好医院物体表面清洁、消毒极其重要,其清洁效果直接影响医院感染的发生[14]。研究[15]表明,2014年该院库房统一向临床科室换发消毒干燥抹布后,多重耐药菌检出率较前均降低。有研究[16]指出,尽管物体表面环境清洁对减少多重耐药菌传播非常重要,但是目前的清洁消毒措施并未完全执行到位,消毒效果不佳。Shams等[17]对11所医疗机构多重耐药菌隔离病房进行了长达2.5年的前瞻性研究,发现进行常规清洁后的房间物体表面多重耐药菌载量明显高于已经进行终末消毒的房间,本研究与此结果一致。通过增加多重耐药菌环境物体表面筛查,增加清洁消毒频次,加强培训等措施可降低多重耐药菌在物体表面的定植率。本研究通过每季度一次的随机筛查,物体表面MRSA检出率由18.08%下降至0,CRAB检出率由4.46%下降0.83%。通过持续筛查,每季度MRSA、CRAB的检出率均持续下降,表明坚持常规的环境筛查可以有效减少多重耐药菌的定植。分析环境筛查前后同期住院患者MRSA、CRAB检出率,发现MRSA检出率由48.86%下降至37.42%,CRAB检出率由36.08%下降至27.27%,与环境检出率较一致。因此,做好环境清洁消毒对阻断多重耐药菌的传播有很重要的作用,本文研究结果与其他文献[18]结果相符。
物体表面既是接触传播中重要的一环,也是多重耐药菌的储菌库,尤其是生物膜形成后更难以清除。因此,建立完善的清洁消毒制度,按照标准化操作流程进行清洁消毒,选择合适的消毒产品,加强消毒频次,有利于降低多重耐药菌在物体表面的定植。本研究发现,最常检出多重耐药菌的位置分别是床周地面、头部垫巾、呼吸机面板、床头柜、吊塔,均为患者床单元周边位置。另外,键盘鼠标、听诊器也是常检出的位置,与其他研究[19-20]类似,表明医务人员手在传染源与物体表面之间起传播作用。本研究也发现,以往容易被忽视的引流袋检出MRSA和CRBA,进一步说明手高频接触部位是多重耐药菌定植的高风险区,应当高度重视这些关键部位的清洁消毒,从而降低物体表面多重耐药菌的定植。
本研究共对该院ICU及各内外科专科ICU共15个病区进行了多重耐药菌环境筛查,通过筛查前后各科室物体表面MRSA和CRBA检出率的变化趋势看,MRSA检出率在所有科室都有明显下降,CRBA检出率在大部分科室有明显下降,但是在ICU Ⅰ病区和器官移植科ICU有所上升。通过调查发现,这两个病区在收治CRBA患者期间,保洁员由于个人原因换岗,考察新上岗的保洁员“84”消毒剂的配制方法,回答不熟练,或回答熟练但现场配液不正确,清洁消毒不到位,需要加强督导培训。保洁员由于普遍文化程度较低,且流动性大,在培训时应当多采用图示来进行培训,同时将流程制度张贴便于查阅。
本研究结果提示,对重点部门进行常规的多重耐药菌环境筛查可以有效降低ICU物体表面多重耐药菌的定植,从而减少患者感染的风险,保障患者安全。本研究亦有局限,为单中心研究,需要多中心研究进一步证实。
| [1] |
Otter JA, Yezli S, French GL. The role played by contaminated surfaces in the transmission of nosocomial pathogens[J]. Infect Control Hosp Epidemiol, 2011, 32(7): 687-699. DOI:10.1086/660363 |
| [2] |
郑少微, 李萍, 张正良, 等. 2005-2017年中国CHINET常见革兰阴性菌对碳青霉烯类抗生素耐药的监测结果[J]. 临床急诊杂志, 2019, 20(1): 40-44. |
| [3] |
Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review[J]. BMC Infect Dis, 2006, 6: 130. DOI:10.1186/1471-2334-6-130 |
| [4] |
Al-Dorzi HM, Arabi YM. Outbreaks in the adult ICUs[J]. Curr Opin Infect Dis, 2017, 30(4): 432-439. DOI:10.1097/QCO.0000000000000387 |
| [5] |
Lei J, Han SS, Wu WJ, et al. Extensively drug-resistant Acinetobacter baumannii outbreak cross-transmitted in an intensive care unit and respiratory intensive care unit[J]. Am J Infect Control, 2016, 44(11): 1280-1284. DOI:10.1016/j.ajic.2016.03.041 |
| [6] |
Gastmeier P, Geffers C, Herrmann M, et al. Nosocomial infections and infections with multidrug-resistant pathogens-frequency and mortality[J]. Dtsch Med Wochenschr, 2016, 141(6): 421-426. DOI:10.1055/s-0041-106299 |
| [7] |
Wang LC, Zhou KH, Chen W, et al. Epidemiology and risk factors for nosocomial infection in the respiratory intensive care unit of a teaching hospital in China: a prospective surveillance during 2013 and 2015[J]. BMC Infect Dis, 2019, 19(1): 145. DOI:10.1186/s12879-019-3772-2 |
| [8] |
Teerawattanapong N, Panich P, Kulpokin D, et al. A systematic review of the burden of multidrug-resistant healthcare-associa-ted infections among intensive care unit patients in Southeast Asia: the rise of multidrug-resistant Acinetobacter baumannii[J]. Infect Control Hosp Epidemiol, 2018, 39(5): 525-533. DOI:10.1017/ice.2018.58 |
| [9] |
Koulenti D, Tsigou E, Rello J. Nosocomial pneumonia in 27 ICUs in Europe: perspectives from the EU-VAP/CAP study[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(11): 1999-2006. DOI:10.1007/s10096-016-2703-z |
| [10] |
秦瑾, 闻海丰. 医院环境中物体表面碳青霉烯耐药鲍曼不动杆菌污染及同源性分析[J]. 中国感染控制杂志, 2015, 14(6): 366-369. DOI:10.3969/j.issn.1671-9638.2015.06.002 |
| [11] |
周春妹, 胡必杰, 陈洪友, 等. SICU环境与临床标本耐甲氧西林金黄色葡萄球菌的基因分型[J]. 中华医院感染学杂志, 2014, 24(10): 2360-2362. |
| [12] |
Madigan T, Cunningham SA, Patel R, et al. Whole-genome sequencing for methicillin-resistant Staphylococcus aureus (MRSA) outbreak investigation in a neonatal intensive care unit[J]. Infect Control Hosp Epidemiol, 2018, 39(12): 1412-1418. DOI:10.1017/ice.2018.239 |
| [13] |
刘国艳, 杨利生, 许梅, 等. 危重患者多药耐药鲍氏不动杆菌医院感染暴发的临床研究[J]. 中华医院感染学杂志, 2019, 29(9): 1306-1310. |
| [14] |
Anderson DJ, Chen LF, Weber DJ, et al. Enhanced terminal room disinfection and acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile (the Benefits of Enhanced Terminal Room Disinfection study): a cluster-randomised, multicentre, crossover study[J]. Lancet, 2017, 389(10071): 805-814. DOI:10.1016/S0140-6736(16)31588-4 |
| [15] |
徐敏, 许川, 王振玲, 等. 不同清洁消毒方法对ICU物体表面多重耐药菌定植率的影响[J]. 护理研究, 2016, 30(8): 977-979. DOI:10.3969/j.issn.1009-6493.2016.08.029 |
| [16] |
Mitchell BG, Dancer SJ, Anderson M, et al. Risk of organism acquisition from prior room occupants: a systematic review and Meta-analysis[J]. J Hosp Infect, 2015, 91(3): 211-217. DOI:10.1016/j.jhin.2015.08.005 |
| [17] |
Shams AM, Rose LJ, Edwards JR, et al. Assessment of the overall and multidrug-resistant organism bioburden on environmental surfaces in healthcare facilities[J]. Infect Control Hosp Epidemiol, 2016, 37(12): 1426-1432. DOI:10.1017/ice.2016.198 |
| [18] |
Vonberg RP, Gastmeier P. Hospital-acquired infections rela-ted to contaminated substances[J]. J Hosp Infect, 2007, 65(1): 15-23. DOI:10.1016/j.jhin.2006.09.018 |
| [19] |
Tschopp C, Schneider A, Longtin Y, et al. Predictors of heavy stethoscope contamination following a physical examination[J]. Infect Control Hosp Epidemiol, 2016, 37(6): 673-679. DOI:10.1017/ice.2016.40 |
| [20] |
Nazeri M, Salmani Arani J, Ziloochi N, et al. Microbial contamination of keyboards and electronic equipment of ICU (intensive care units) in Kashan University of medical sciences and health service hospitals[J]. MethodsX, 2019, 6: 666-671. DOI:10.1016/j.mex.2019.03.022 |



