2. 温州医科大学附属眼视光医院消毒供应中心, 浙江 温州 325000;
3. 温州医科大学附属眼视光医院护理部, 浙江 温州 325000
2. Central Sterile Supply Department, Eye Hospital, Wenzhou Medical University, Wenzhou 325000, China;
3. Nursing Department, Eye Hospital, Wenzhou Medical University, Wenzhou 325000, China
白内障为全球首位致盲性眼病[1],手术为其最有效的治疗方式。2020年我国白内障手术覆盖率达70%左右[2],由于医疗资源分配不均,贫困地区的白内障手术率较低[3]。为提高贫困地区白内障手术率,国家卫生健康委设立“健康快车”扶贫项目,“健康快车”是我国唯一流动的慈善眼科火车医院,专门用于开展眼科白内障手术,截至2019年12月28日,其累计为211 203例贫困患者免费实施了手术。与医院相比,“健康快车”内病房和手术室设施较为简陋,例如在手术器械再处理过程中无流动水清洗设备[3],给白内障手术后感染防控提出挑战,预防手术后眼内炎和眼前节毒性反应综合征的发生是手术后感染防控的关键[4]。而保证复用手术器械再处理质量合格是预防眼内炎和眼前节毒性反应综合征的重要措施之一。美国医疗仪器促进协会(AAMI)强调合理漂洗是保证手术器械再处理质量的关键要素。我国指南[5]规定标准化器械清洗流程为冲洗-洗涤-漂洗-终末漂洗,其中冲洗、漂洗、终末漂洗步骤均需在流动水下进行。然而,“健康快车”条件下无流动水清洗设备[3],这对冲洗和漂洗手术器械造成挑战。有研究[6]报道器械护士通过在矿泉水瓶盖上钻孔,通过挤压瓶身模拟流动水下漂洗手术器械,然而此种漂洗方式操作繁琐。在临床实践中,器械护士多经验性选择漂洗水量,将其置于适宜的容器中漂洗手术器械。然而并未有相关研究证明上述方法漂洗手术器械的安全性与有效性。因此,需要探索在“健康快车”无流动水清洗设备的特殊条件下,复用眼科手术器械便捷、安全、有效的漂洗方法。
漂洗手术器械的目的为去除黏附于手术器械上的化学物质与污染物,在白内障手术器械漂洗过程中涉及的化学物质主要为多酶清洗剂[7],污染物包括人体血液、眼部组织液等。为保证手术器械的清洗质量,需完全清除黏附于手术器械表面的多酶清洗剂与血液、组织液等。在使用非流动水漂洗的特殊情况下,漂洗水量与漂洗方式是影响漂洗效果的关键因素。因此,本研究预探索在非流动水下复用眼科手术器械最适宜的漂洗水量与漂洗方式,以达到能有效清除黏附于眼科手术器械表面的多酶清洗剂与污染物的目的,保证复用手术器械合格的再处理质量。
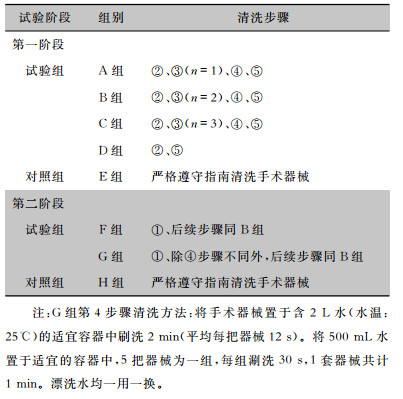
1 对象与方法 1.1 研究对象本研究分为两个阶段进行,第一阶段为探索不同漂洗方法对多酶清洗剂清除效果的影响,第二阶段为探索不同漂洗方法对清洗质量的影响。第一阶段试验:选择经过灭菌的白内障显微器械1 300件,采用随机数字表法将其随机分为A、B、C、D、E共5组,A、B、C、D 4组为试验组,E组为对照组。
第二阶段试验:选择经过灭菌的白内障显微器械150件。使用新鲜猪眼污染手术器械,模拟临床手术情况。将每把手术器械头端插入猪眼内部组织保持30 s,试验员的手(带有无菌手套)在接触猪眼组织后充分接触整把手术器械,静置1 h(温度20℃,湿度46%),使手术器械达到高污染水平。采用随机数字表法将手术器械随机分为F、G、H共3组。F、G 2组为试验组,H组为对照组。
1.2 研究方法 1.2.1 清洗方法试验组模拟“健康快车”条件下使用非流动水漂洗手术器械,对照组遵守指南使用流动水漂洗手术器械。以1套(10把)白内障手术器械为单位进行清洗。
试验组清洗步骤如下:①涮洗代替冲洗:将500 mL水置于适宜的容器中,5把器械为一组,每组涮洗30 s,1套器械共计1 min。②洗涤:根据使用说明书以1∶270的浓度配置多酶清洗液(水温40℃)。充分打开手术器械轴节,浸没于多酶清洗液中3 min后,刷洗2 min(平均每把器械12 s)。③漂洗:将手术器械置于含n L水(水温25℃,水量:n根据组别不同设置不同的水量。A、B、C组的漂洗水量分别为1、2、3 L,D组不漂洗,G、F组漂洗水量同B组)的适宜容器中刷洗2 min(平均每把器械12 s),漂洗水一用一换。④终末漂洗:除G组外,其他组同漂洗。G组在B组的基础上增加“0.5 L水结合涮洗”的步骤。⑤干燥(温度35℃)后检测多酶清洗剂残留。①②③步骤使用的水均为软水,④步骤使用的水为纯化水。
对照组清洗步骤如下:严格遵守指南[5, 8]规定对手术器械进行冲洗、洗涤、漂洗、终末漂洗。干燥(温度35℃)后检测多酶清洗剂残留。
第一阶段试验:探索不同漂洗方法对多酶清洗剂清除效果的影响。因第一阶段试验中所有手术器械均无污染,所以试验组省略①步骤,对照组省略冲洗步骤。具体清洗步骤见表 1。第二阶段试验:在第一阶段试验结果的基础上开展第二阶段试验,验证第一阶段推荐选用的漂洗水量能否有效清除黏附于手术器械表面的污染物,探索不同漂洗方法对清洗质量的影响。具体清洗步骤见表 1。
| 表 1 不同组别手术器械清洗方法 Table 1 Cleaning methods for different groups of surgical instruments |
|
多酶清洗剂残留的定量检测方法:多酶清洗剂的主要成分为各种酶和表面活性剂,酶的本质即为蛋白质。本试验使用“安易测”蛋白定量检测仪:其包含BionovaMiniPro(“安易测”蛋白残留培养阅读器,B083A2,阿根廷特安洁感染控制有限公司制造)以及ChemdyePRO1 Micro(“安易测”蛋白残留测试棒,B082C12,阿根廷特安洁感染控制有限公司制造),检测手术器械表面蛋白残留量,间接反映多酶清洗剂残留量。经预试验,选择20把手术器械为一组测量多酶清洗剂残留量。使用配套测试棒擦拭整把手术器械采样,共计采样20把后使测试棒与反应液充分反应,立即放入仪器,培养10 min后,记录检测结果。
清洗质量检测方法:采用ATP生物荧光法。使用ATP生物荧光检测仪(LB-QM6,青岛路博环保科技有限公司)专用采样棒,取出采样棉签涂抹整把手术器械表面,边涂抹边旋转棉签,使棉签各表面与手术器械表面充分接触,将棉签插入采样棒测试管震荡摇匀,使采样棉签与裂解液充分反应,将采样棒放入ATP生物荧光检测仪检测仓内,读取相对光单位(relative light unit, RLU)值,RLU≤45为清洗合格。
1.3 统计分析应用SPSS 26.0软件对数据进行分析。多酶清洗剂残留量与ATP生物荧光检测结果为计量资料,以均数±标准差表示。多酶清洗剂残留量组间比较采用Welch方差分析,进一步两两比较采用Games-Howell方法,生物荧光检测结果组间比较采用单因素方差分析,进一步两两比较采用LSD检验方法。清洗合格率为计数资料,以百分率表示,组间比较采用Fisher确切概率法。P≤0.05为差异具有统计学意义。
2 结果 2.1 不同漂洗方法的多酶清洗剂残留结果比较试验组(A、B、C、D组)手术器械的多酶清洗剂残留结果分别为(5.25±0.84)、(1.90±0.23)、(1.92±0.18)、(8.37±0.66)μg/20把,对照组(E组)为(3.45±0.46)μg/20把,5组选取的手术器械均为260把,不同漂洗方法下手术器械的多酶清洗剂残留结果比较,差异有统计学意义(F=25.547,P<0.001)。两两比较结果表明,D组手术器械的多酶清洗剂残留量高于B、C、E组,差异均有统计学意义(均P<0.05);A组手术器械的多酶清洗剂残留量高于B、C组,差异均有统计学意义(均P<0.05);E组手术器械的多酶清洗剂残留量高于C组,差异有统计学意义(P=0.048)。B组与E组比较,差异无统计学意义(P=0.053)。见图 1。
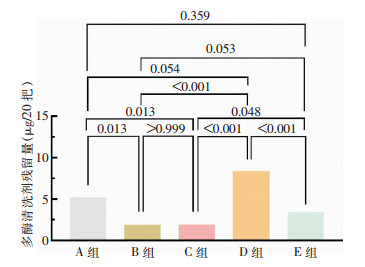 |
| 图 1 不同漂洗方法下手术器械的多酶清洗剂残留量组间比较结果 Figure 1 Comparison of multi-enzyme detergent residue of surgical instruments under different rinsing me-thods |
3组漂洗方法下ATP生物荧光检测结果比较,差异有统计学意义(P=0.004)。3组漂洗方法的清洗合格率比较,差异无统计学意义(P=0.731),见表 2。两两比较结果表明,F组手术器械ATP生物荧光检测法结果高于G、H组,差异均有统计学意义(均P<0.05);G、H组比较,差异无统计学意义(P=0.339)。见图 2。
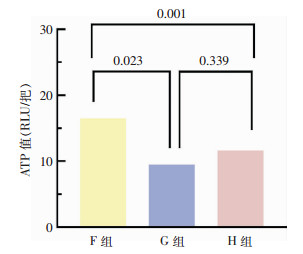 |
| 图 2 不同漂洗方法下ATP生物荧光检测法组间比较结果 Figure 2 Comparison of ATP bioluminescence detection results under different rinsing methods |
| 表 2 不同漂洗方法下手术器械的清洗质量结果比较 Table 2 Comparison of cleaning quality results of surgical instruments under different rinsing methods |

|
有效清除黏附于手术器械上的多酶清洗剂,对减少手术后并发症的发生十分重要[9-13]。第一阶段试验为探索不同漂洗方法对多酶清洗剂清除效果的影响。研究[14-15]表明在流动水下漂洗手术器械,多酶清洗剂残留浓度极低。本研究结果显示,B组漂洗方法与对照组相比,多酶清洗剂残留量不存在差异,且显著低于不漂洗组。因此,B组漂洗方法与在流动水下漂洗相比,两者对多酶清洗剂的清除效果相同,多酶清洗剂的残留浓度极低。为确保有效清除黏附于手术器械表面的多酶清洗剂,建议选择B组漂洗方法(4 L水结合刷洗)。
手术器械清洗是通过化学因素(水、清洗剂)与物理因素(机械力、温度和时间)的作用将黏附于器械上的各种物质去除。使用非流动水漂洗手术器械,漂洗水量及漂洗过程中使用的机械力是影响多酶清洗剂清除效果的关键因素,漂洗水量不同代表对多酶清洗剂稀释水平不同;漂洗中毛刷刷洗产生的摩擦力属于机械力的一种。在B组漂洗水量下,残留多酶清洗剂浓度与对照组不存在差异,说明在此水量下多酶清洗剂被充分稀释,其浓度极低。本研究漂洗过程中使用软毛刷刷洗手术器械,通过刷洗产生的摩擦力代替流动水下水流的冲击力,清除黏附于手术器械上的多酶清洗剂。
为保证最终结果的特异性与准确性,避免来自于血液、组织液中的蛋白质干扰,选择使用经过灭菌后无污染的手术器械而非经过组织污染的手术器械。此时所测得的蛋白残留量仅为多酶清洗剂残留量。研究[9]表明可以使用光谱仪检测多酶清洗剂溶液的吸光度,反映其含量,此种方法可以检测到稀释5 000倍的多酶清洗剂溶液。BCA蛋白检测法即通过使用光谱仪检测溶液的吸光度反映蛋白含量,是一种被广泛应用的蛋白定量检测方法,其具有高灵敏度、高稳定性。“安易测”蛋白残留检测仪的检测原理为BCA蛋白检测法,手术器械表面残留的多酶清洗剂(蛋白)与反应液中的BCA试剂(二辛可酸)形成紫色的化合物,此化合物的颜色变化和多酶清洗剂(蛋白)残留数值呈线性关系,通过机器内置的光谱仪测定装置,可测定变色化合物在562 nm光谱处的吸收值,从而精确得到残留多酶清洗剂(蛋白)数值。因眼科显微手术器械体积较小,所以选择对整把手术器械进行采样。
手术器械合格的清洗质量是其消毒、灭菌成功的前提条件[16-19],未被去除的污染物会包裹细菌、病毒,对致病微生物形成保护作用,阻止消毒、灭菌因子的穿透。使用消毒、灭菌失败的手术器械会严重危害患者安全。所以需确保每一件手术器械合格的清洗质量,进而保证手术器械的使用安全性。在第一阶段试验结果的基础上进行第二阶段研究,验证不同漂洗方法对清洗质量的影响。F组漂洗方法同B组,G组漂洗方法在B组的基础上增加“0.5 L水结合涮洗”的步骤。试验结果表明,虽然F、G组与对照组的清洗合格率比较,差异无统计学意义,但是F组ATP生物荧光检测结果高于对照组,G组ATP生物荧光检测结果低于对照组,F组的清洗质量劣于对照组,G组的清洗质量优于对照组。因此,为保证手术器械合格的清洗质量,推荐采用G组漂洗方法(4 L水结合刷洗+0.5 L水结合涮洗)。
美国AAMI和我国指南[5]均规定,终末漂洗应使用高纯度水,以求最大限度地减少水中杂质,减少杂质可能携带的致病物质[20];其次,这些杂质还会在漂洗过程中黏附于手术器械表面,形成干涸的痕迹,腐蚀手术器械,缩短手术器械使用寿命[15]。使用非流动水漂洗手术器械,手术器械上的残留物经过刷洗掉落后会沉积于漂洗水中,从而增加漂洗水中所含杂质。在终末漂洗中增加0.5 L水涮洗能在有限的条件下最大程度地减少水中残留的杂质,这既能保证手术器械合格的清洗质量,又能适当延长手术器械使用寿命。
B组漂洗方法(4 L水结合刷洗)能有效清除黏附于手术器械上的多酶清洗剂,G组漂洗方法(4 L水结合刷洗+0.5 L水结合涮洗)能保证手术器械合格的清洗质量。结合两阶段的试验结果,在“健康快车”无流动水清洗设备的特殊条件下,推荐选用G组漂洗方法,其既能有效清除黏附于眼科手术器械表面的多酶清洗剂,又能保证手术器械合格的清洗质量。
| [1] |
高华, 陈秀念, 史伟云. 我国盲的患病率及主要致盲性疾病状况分析[J]. 中华眼科杂志, 2019, 55(8): 625-628. Gao H, Chen XN, Shi WY. Analysis of the prevalence of blindness and major blinding diseases in China[J]. Chinese Journal of Ophthalmology, 2019, 55(8): 625-628. DOI:10.3760/cma.j.issn.0412-4081.2019.08.016 |
| [2] |
玛依努尔·于苏甫, 王宁利. "视觉2020": 中国防盲治盲与眼健康工作进展[J]. 中华医学杂志, 2020, 100(48): 3831-3834. Mayinuer YSF, Wang NL. Vision 2020:the progress of blindness prevention and eye health in China[J]. National Medical Journal of China, 2020, 100(48): 3831-3834. DOI:10.3760/cma.j.cn112137-20200825-02468 |
| [3] |
Cao XG, Hou XR, Bao YZ. The ocular biometry of adult cata-ract patients on lifeline express hospital eye-train in rural China[J]. J Ophthalmol, 2015, 2015: 171564. |
| [4] |
Sengillo JD, Chen Y, Perez Garcia D, et al. Postoperative endophthalmitis and toxic anterior segment syndrome prophyla-xis: 2020 update[J]. Ann Transl Med, 2020, 8(22): 1548. DOI:10.21037/atm-2019-rcs-02 |
| [5] |
中华人民共和国国家卫生和计划生育委员会. 医院消毒供应中心第2部分: 清洗消毒及灭菌技术操作规范: WS 310.2-2016[S]. 北京: 中国标准出版社, 2017. National Health Commission of the People's Republic of China. Central sterile supply department(CSSD)-part 2: stan-dard for operating procedure of cleaning, disinfection and sterilization: WS 310.2-2016[S]. Beijing: Standards Press of China, 2017. |
| [6] |
褚文娟, 任永霞. "健康快车"复明工程手术室护理管理[J]. 天津护理, 2014, 22(5): 436-437. Chu WJ, Ren YX. Nursing management of operating room of "Health Express" fuming project[J]. Tianjin Journal of Nur-sing, 2014, 22(5): 436-437. DOI:10.3969/j.issn.1006-9143.2014.05.034 |
| [7] |
秦蕾, 常笑, 梁优萍, 等. 170所医院眼科显微手术器械清洗及灭菌包装的现状调查[J]. 中华护理杂志, 2019, 54(4): 554-557. Qin L, Chang X, Liang YP, et al. Current status of ophthalmic microsurgical instruments cleaning and sterile packaging in 170 hospitals in China[J]. Chinese Journal of Nursing, 2019, 54(4): 554-557. DOI:10.3761/j.issn.0254-1769.2019.04.015 |
| [8] |
中国医师协会眼科医师分会, 中华预防医学会医院感染专业委员会, 中华预防医学会消毒分会, 等. 我国眼科手术管理、感染控制、消毒灭菌指南(二)[J]. 中华眼科杂志, 2016, 52(4): 244-252. Ophthalmologist Branch of Chinese Medical Doctor Association, Hospital Infection Professional Committee of Chinese Preventive Medicine Association, Disinfection Branch of Chinese Preventive Medicine Association, et al. Guidelines for management, infection control, disinfection and sterilization of ophthalmic surgery in China (2)[J]. Chinese Journal of Ophthalmology, 2016, 52(4): 244-252. DOI:10.3760/cma.j.issn.0412-4081.2016.04.002 |
| [9] |
Sandoval HP, Crosson CE, Holzer MP, et al. Residual clea-ner after normal cleaning of laser in situ keratomileusis instruments[J]. J Cataract Refract Surg, 2003, 29(9): 1727-1732. DOI:10.1016/S0886-3350(03)00513-3 |
| [10] |
Mamalis N. Toxic anterior segment syndrome: role of enzymatic detergents used in the cleaning of intraocular surgical instruments[J]. J Cataract Refract Surg, 2016, 42(9): 1249-1250. DOI:10.1016/j.jcrs.2016.08.011 |
| [11] |
Nuyts RM, Edelhauser HF, Pels E, et al. Toxic effects of detergents on the corneal endothelium[J]. Arch Ophthalmol, 1990, 108(8): 1158-1162. DOI:10.1001/archopht.1990.01070100114045 |
| [12] |
Parikh C, Sippy BD, Martin DF, et al. Effects of enzymatic sterilization detergents on the corneal endothelium[J]. Arch Ophthalmol, 2002, 120(2): 165-172. DOI:10.1001/archopht.120.2.165 |
| [13] |
Anand A, Parkes L, Smith C, et al. Residual cleaner as a cause of intraocular lens slippage[J]. J Cataract Refract Surg, 2005, 31(10): 2032. DOI:10.1016/j.jcrs.2005.07.013 |
| [14] |
Tamashiro NSM, Souza RQ, Gonçalves CR, et al. Cytotoxicity of cannulas for ophthalmic surgery after cleaning and sterilization: evaluation of the use of enzymatic detergent to remove residual ophthalmic viscosurgical device material[J]. J Cataract Refract Surg, 2013, 39(6): 937-941. DOI:10.1016/j.jcrs.2012.12.039 |
| [15] |
Souza RQD, Gonçalves CR, Ikeda TI, et al. The impact of the final rinse on the cytoxicity of critical products submitted for processing[J]. Rev Esc Enferm USP, 2015, 49 Spec No: 87-92.
|
| [16] |
Smith K, Araoye I, Gilbert S, et al. Is retained bone debris in cannulated orthopedic instruments sterile after autoclaving?[J]. Am J Infect Control, 2018, 46(9): 1009-1013. DOI:10.1016/j.ajic.2018.02.024 |
| [17] |
Gonzalez JA, Vanzieleghem T, Dumazy A, et al. On-site comparison of an enzymatic detergent and a non-enzymatic detergent-disinfectant for routine manual cleaning of flexible endoscopes[J]. Endosc Int Open, 2019, 7(4): E412-E420. DOI:10.1055/a-0838-4995 |
| [18] |
Neves MS, da Silva MG, Ventura GM, et al. Effectiveness of current disinfection procedures against biofilm on contaminated GI endoscopes[J]. Gastrointest Endosc, 2016, 83(5): 944-953. DOI:10.1016/j.gie.2015.09.016 |
| [19] |
Akinbobola AB, Sherry L, Mckay WG, et al. Tolerance of Pseudomonas aeruginosa in in-vitro biofilms to high-level peracetic acid disinfection[J]. J Hosp Infect, 2017, 97(2): 162-168. DOI:10.1016/j.jhin.2017.06.024 |
| [20] |
Sarobe Carricas M, Segrelles Bellmunt G, Jiménez Lasanta L, et al. Toxic anterior segment syndrome (TASS): studying an outbreak[J]. Farm Hosp, 2008, 32(6): 339-343. DOI:10.1016/S1130-6343(08)76282-2 |



