2. 聊城市人民医院重症监护室, 山东 聊城 252000
2. Department of Critical Care Medicine, Liaocheng People's Hospital, Liaocheng 252000, China
医院感染是一个全球性的问题,尤其是对于免疫缺陷、病情危重的患者,导致住院时间延长,住院费用增加,病死率升高[1]。在我国,显著增加的鲍曼不动杆菌(Acinetobacter baumannii,AB)感染对医院感染预防与控制是一个严峻的挑战,其对抗菌药物普遍耐药,难以治疗和控制[2-3],已被列为人类红色警报病原体。尤其在重症监护病房(ICU)内,AB已成为医院感染的主要病原菌[4]。研究[5]表明,多重耐药鲍曼不动杆菌(MDR-AB)引起的医院感染平均每例花费超过3万美元。积极落实多重耐药菌感染防控措施,做好接触隔离、手卫生,加强病区环境的清洁与消毒,对预防AB感染暴发流行非常重要。目前,相关规范、指南与共识等提及的多重耐药菌防控措施,由于医疗条件限制和医务人员理念不足等因素,导致部分防控措施依从性低下,从而使防控形势非常严峻。防控措施的执行力度,对控制AB的传播至关重要。此外,AB能在环境中长时间存活,从而增强其在医院内的传播能力,现行措施对其防控效果仍有不确定性。本研究通过在某三甲医院综合ICU内实施基于依从性监测的加强干预措施,观察对AB的防控效果,现将研究结果报告如下。
1 资料与方法 1.1 研究对象本研究选取某三甲医院综合ICU 2019年1月—2020年12月住院患者及医务人员为研究对象。该ICU共24张床位,其中4个单间、4个双人间、4个三人间病房。记录患者的病历资料,包括姓名、性别、年龄、出入ICU日期、有创机械通气、留置导尿管、中心静脉置管、检出病原菌情况、多重耐药菌防控措施依从性等。医院感染管理专职人员根据2001年版《医院感染诊断标准(试行)》《多重耐药菌医院感染预防与控制中国专家共识》[6]将检出的AB感染病例分为医院感染、社区感染或定植,疑难病例需结合临床医生的意见。使用杏林感染实时监测系统对病例信息进行监测,细菌耐药数据从微生物检验系统中提取。每周三次通过病室监控录像进行手卫生依从性调查,通过荧光标记法计算环境清洁消毒后荧光标记清除水平,评价消毒程度。
1.2 研究方法2019年1—12月为干预前期,参照《多重耐药菌医院感染预防与控制中国专家共识》[6]采取接触隔离、手卫生、环境清洁消毒等常规防控措施,进行基线调查掌握入住患者的AB定植、感染基线数据。2020年1—12月为干预后期,在干预前实施的防控措施基础上,成立多部门协作管理小组,制定、实施加强的干预防控策略,对核心措施的依从性进行监测。
1.2.1 成立多部门协作管理小组,加强多学科协作该小组由ICU主任、护士长负责,由感染监控医生、感染监控护士、医院感染管理专职人员、医务处、护理部、临床药师、微生物技术人员构成。召开会议讨论制定加强干预措施,每月举行一次座谈会,对存在问题进行讨论,制定应对措施,做到防控工作持续改进。医院感染管理专职人员采用统一方法开展监测,每月在ICU内进行医院感染防控知识培训,确保培训覆盖所有工作人员。医务处、护理部对医护人员防控措施掌握情况进行考核。微生物技术人员指导临床人员正确留取标本并进行标本检验。临床药师参与每日交班查房,针对感染患者给出用药品种、使用时间、剂量等建议。疑难、危重感染病例由小组成员联合会诊,强化抗菌药物使用监管。
1.2.2 制定加强综合干预措施,并实施依从性监测包括:(1)及时进行病原学检测,感染患者在入院24 h内留取标本细菌培养,患者出现感染加重或更换抗菌药物前应再次送检;(2)对多重耐药菌患者实施单间隔离或同种病原体同室隔离,悬挂接触隔离标识,用物专人专用,将多重耐药菌列入交班内容向全科通报,确保人人知晓;(3)近距离接触患者时采取穿隔离衣、戴手套等接触隔离措施;(4)床边备快速手消毒剂,医务人员严格按照规范要求做好手卫生;(5)制定清洁消毒标准化操作规程,每班对病区环境,重点对高频接触的物体表面进行清洁消毒。患者出院或转科时实施严格的终末消毒,在病情允许情况下每月一次将患者转至备用病房,逐间腾空原病房进行彻底清洁消毒;(6)AB感染患者每日用4%葡萄糖酸氯已定擦浴一次;(7)ICU感染监控医生、感染监控护士、医院感染管理专职人员对以上防控措施进行监督检查。
1.3 观察指标观察指标包括医院感染发病率、耐碳青霉烯类鲍曼不动杆菌(CRAB)医院感染日发病率、AB检出构成比、AB耐药率等。
1.4 统计学方法应用SPSS 20.0统计软件对数据进行分析,计量资料采用均数±标准差、计数资料采用率或构成比进行描述,组间比较采用t检验、χ2检验,P≤0.05为差异具有统计学意义。
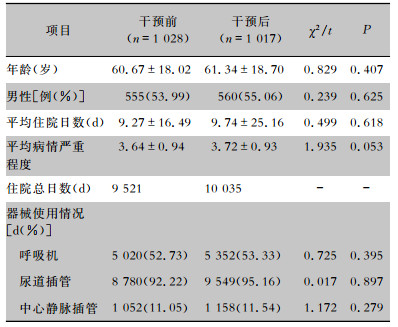
2 结果 2.1 患者基本情况本次研究共监测患者2 045例(干预前1 028例,干预后1 017例),其中男性1 115例、女性930例,平均年龄(61.02±18.36)岁,两组患者在性别、年龄、平均住院日数、平均病情严重程度、呼吸机使用率、尿道插管使用率、中心静脉插管使用率比较,差异均无统计学意义(均P>0.05),表明资料具有可比性。见表 1。
| 表 1 干预前后患者基本临床资料 Table 1 Basic clinical data of patients before and after intervention |
|
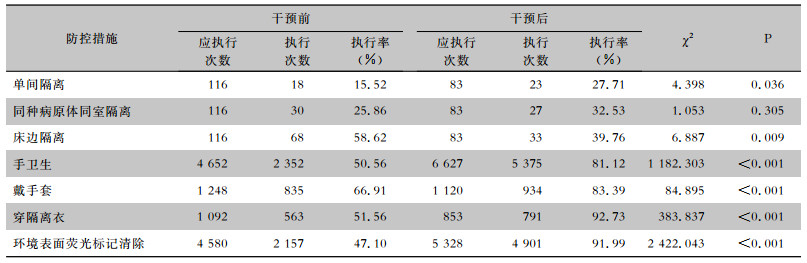
干预后防控措施的依从性有所提高,单间隔离执行率由干预前15.52%提高至干预后27.71%,医务人员手卫生、戴手套、穿隔离衣的依从率、环境表面荧光标记清除率均有不同程度提高,差异有统计学意义(均P<0.001)。见表 2。
| 表 2 干预前后感染防控措施依从情况 Table 2 Compliance to infection prevention and control measures before and after intervention |
|
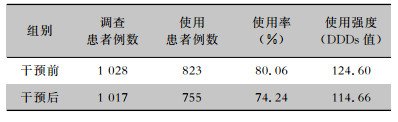
抗菌药物使用率和使用强度是抗菌药物使用的质控指标,干预后抗菌药物使用率(74.24%)低于干预前(80.06%),差异有统计学意义(χ2=9.829,P=0.002)。干预后抗菌药物使用强度DDDs值低于干预前。见表 3。
| 表 3 干预前后患者抗菌药物使用情况 Table 3 Antimicrobial use in patients before and after intervention |
|
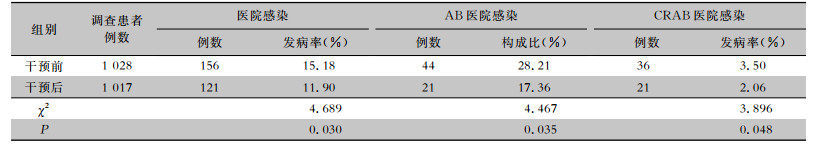
干预后患者的医院感染发病率、AB医院感染构成比、CRAB医院感染发病率均降低,差异均有统计学意义(均P<0.05)。见表 4。
| 表 4 干预前后患者医院感染及CRAB医院感染发生情况 Table 4 Occurrence of healthcare-associated infection and CRAB healthcare-associated infection before and after intervention |
|
干预前患者共检出病原菌494株,主要为AB,共152株,占30.77%;干预后患者共检出病原菌645株,AB仍为首位检出菌,共137株,占21.24%;干预后AB检出构成比低于干预前,差异有统计学意义(χ2= 13.855,P<0.05)。
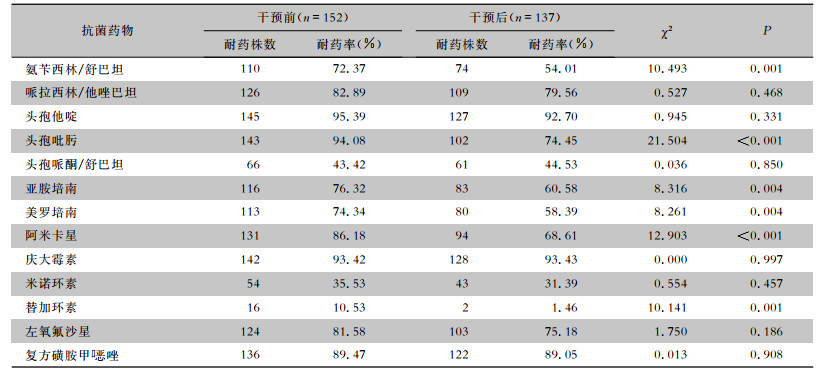
2.6 AB耐药性分析AB除对氨苄西林/舒巴坦、头孢哌酮/舒巴坦、碳青霉烯类、米诺环素、替加环素相对敏感外,对其他抗菌药物均表现出较高的耐药性。AB对头孢吡肟、亚胺培南、美罗培南、阿米卡星的耐药率分别由干预前的94.08%、76.32%、74.34%、86.18%下降至干预后的74.45%、60.58%、58.39%、68.61%,对替加环素的耐药率由干预前的10.53%下降至干预后的1.46%,差异均有统计学意义(均P<0.05)。见表 5。
| 表 5 干预前后患者检出AB对常用抗菌药物的耐药情况 Table 5 Antimicrobial resistance of AB isolated from patients before and after intervention |
|
近年来国内外均有不少关于CRAB引起医院感染暴发的案例报道[7-9],多集中于ICU,是下呼吸道、血液、手术部位感染的常见病原菌。AB易在呼吸道、皮肤、泌尿道等部位定植,其感染诊断存在一定困难,需综合考虑患者有无感染症状和体征、标本采集部位及方法是否正确、对抗菌药物治疗反应等信息进行全面分析。体液标本采集时应严格消毒,避免污染。呼吸道标本培养出AB时,需区分是定植还是致病菌,如果患者在治疗过程中出现病情反复,临床或影像上出现新的或加重的病变,时间上正好与AB检出相符或者高质量的呼吸道标本有2次及以上AB生长,表明有临床诊断意义。研究[10]表明,在防控AB传播方面综合措施与单一措施相比更为有效。目前针对多重耐药菌的感染防控措施、循证依据多来自于国外的研究数据。我国医疗资源紧缺,空间相对局限,部分防控措施如单间隔离、主动筛查很难广泛实施。常规的多重耐药菌防控措施缺少个性化、针对性措施,缺乏对落实情况的监督,对CRAB感染的防控效果仍存在不确定性[11]。
手卫生、穿隔离衣、戴手套、环境清洁消毒是防止多重耐药菌传播的重要措施。多部门协作是近年来推广的一种新型医学模式,在细菌耐药问题上,通过加强不同科室、不同专业医务人员之间的沟通与合作,取得了显著效果。本研究通过多部门协作、不断的培训教育及防控措施的依从性监测,逐步转变医务人员的防控理念,与干预前相比,干预后各项防控措施的依从性均有不同程度提高,抗菌药物使用率及使用强度DDDs值明显改善,且干预后患者的医院感染发病率、CRAB医院感染发病率以及AB对碳青霉烯类抗生素的耐药率均有不同程度的下降。抗菌药物使用不当可诱导细菌耐药产生,近年来抗菌药物合理应用管理对抑制细菌耐药起到了至关重要的作用。
AB在外界环境中具有超强的生存能力,在医疗环境表面存活可超过5个月[12],研究[13-14]证实环境污染在AB传播中起重要作用,病房高频接触物体表面是病原体传播的主要媒介。高频接触物体表面包含床栏杆、床头桌、输液泵按钮、呼吸机按钮、电脑键盘鼠标等,环境清洁消毒是一项基本的感染防控策略。将病房腾空才能对环境进行全方位、彻底的清洁消毒,本研究结果表明这一措施可取得满意效果。虽然荧光标记不能直接评价消毒效果,但仍是一种很好的监测环境清洁质量的方法[12, 15]。在我国,医疗机构保洁人员的流动性较大,且大多文化程度相对偏低,保洁员的环境清洁消毒工作是医院感染防控工作中的薄弱点。通过加强教育培训与监督能提升保洁员对环境清洁消毒工作的重视程度和执行力度。ICU是医院感染的重点部门,保持ICU内保洁人员稳定尤为重要。
AB常在人体皮肤上广泛定植,气管切开部位、开放性伤口、泌尿生殖道中均可检出,是感染的主要危险因素和来源[16-17],因此皮肤去定植是一项重要的预防措施。洗必泰(CHG)是一种广谱的局部抗菌剂,具有良好的安全性。采用CHG擦浴与传统肥皂相比,可以持续减少患者皮肤的细菌定植,降低手术部位感染发病率[18]。CHG沐浴亦被证明有利于防止导管定植和导管相关血流感染[19]。ICU患者每日CHG沐浴可减少耐药革兰阳性球菌医院感染,如耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌的效果已在多中心试验中得到证实[20]。吕春梅等[21]研究表明CHG擦浴可减少ICU多重耐药菌医院感染的发生。目前,仅少数研究报道CHG沐浴可以减少AB定植,且大多都是在不同医院环境下的单中心试验,具体效果还需要更多的试验证实。多数研究中CHG沐浴的频次为每日1次,尽管CHG对人体皮肤的抗菌活性至少有48 h,迄今为止,还没有研究直接比较不同的CHG沐浴频率对预防医院感染的影响。此外,尽管目前为止还没有出现耐消毒剂的菌株,亦应考虑细菌间断或持续暴露于CHG会不会出现消毒剂抗性的问题。
本研究的局限性:首先,本研究采取综合的加强防控策略,因为单一的干预措施不能成功地控制AB定植或感染的流行,由于受多重因素的影响,很难评估各个干预措施的相对贡献。第二,不能控制混杂因素的影响,2020年1月起因新型冠状病毒肺炎疫情暴发,该院取消了ICU家属对患者的探视,可能对AB传播的控制起一定作用。第三,由于医保资金限制,未进行主动筛查。如能进行主动筛查,有利于发现AB定植和感染患者,及时采取接触隔离措施,或许能取得更好的效果。
综上所述,基于依从性监测的加强防控措施对降低ICU内AB感染和耐药具有良好的效果。环境清洁消毒、手卫生及接触隔离的有效落实对感染发病率的降低起到关键作用。
| [1] |
Ling ML, Apisarnthanarak A, Madriaga G. The burden of healthcare-associated infections in Southeast Asia: a systema-tic literature review and Meta-analysis[J]. Clin Infect Dis, 2015, 60(11): 1690-1699. DOI:10.1093/cid/civ095 |
| [2] |
Liu C, Chang YW, Xu Y, et al. Distribution of virulence-associated genes and antimicrobial susceptibility in clinical Acinetobacter baumannii isolates[J]. Oncotarget, 2018, 9(31): 21663-21673. DOI:10.18632/oncotarget.24651 |
| [3] |
Geisinger E, Huo WW, Hernandez-Bird J, et al. Acinetobac-ter baumannii: envelope determinants that control drug resis-tance, virulence, and surface variability[J]. Annu Rev Microbiol, 2019, 73: 481-506. DOI:10.1146/annurev-micro-020518-115714 |
| [4] |
Zhao YX, Hu KW, Zhang JS, et al. Outbreak of carbapenem-resistant Acinetobacter baumannii carrying the carbapenemase OXA-23 in ICU of the eastern Heilongjiang Province, China[J]. BMC Infect Dis, 2019, 19(1): 452. DOI:10.1186/s12879-019-4073-5 |
| [5] |
Nelson RE, Schweizer ML, Perencevich EN, et al. Costs and mortality associated with multidrug-resistant healthcare-associa-ted Acinetobacter infections[J]. Infect Control Hosp Epide-miol, 2016, 37(10): 1212-1218. DOI:10.1017/ice.2016.145 |
| [6] |
黄勋, 邓子德, 倪语星, 等. 多重耐药菌医院感染预防与控制中国专家共识[J]. 中国感染控制杂志, 2015, 14(1): 1-9. Huang X, Deng ZD, Ni YX, et al. Chinese experts' consensus on prevention and control of multidrug resistance organism healthcare-associated infection[J]. Chinese Journal of Infection Control, 2015, 14(1): 1-9. DOI:10.3969/j.issn.1671-9638.2015.01.001 |
| [7] |
Wieland K, Chhatwal P, Vonberg RP. Nosocomial outbreaks caused by Acinetobacter baumannii and Pseudomonas aeruginosa: results of a systematic review[J]. Am J Infect Control, 2018, 46(6): 643-648. DOI:10.1016/j.ajic.2017.12.014 |
| [8] |
刘迪, 赵晓宇, 刘佳微, 等. 某医院重症监护病房泛耐药鲍曼不动杆菌疑似感染暴发的调查与处置[J]. 中国消毒学杂志, 2021, 38(1): 58-62. Liu D, Zhao XY, Liu JW, et al. Investigation and treatment of a suspected outbreak of extensively drug-resistent Acinetobacter baumannii infection in ICU of a hospital[J]. Chinese Journal of Disinfection, 2021, 38(1): 58-62. |
| [9] |
张丽伟, 张玲, 戴玉芳, 等. 一起ICU耐碳青霉烯类鲍曼不动杆菌疑似医院感染暴发的调查与处置[J]. 中国消毒学杂志, 2018, 35(4): 301-303. Zhang LW, Zhang L, Dai YF, et al. Investigation and mana-gement of a suspected nosocomial infection outbreak of carba-penems resistant Acinetobacter baumannii in ICU[J]. Chinese Journal of Disinfection, 2018, 35(4): 301-303. |
| [10] |
Teerawattanapong N, Kengkla K, Dilokthornsakul P, et al. Prevention and control of multidrug-resistant Gram-negative bacteria in adult intensive care units: a systematic review and network Meta-analysis[J]. Clin Infect Dis, 2017, 64(suppl_2): S51-S60. DOI:10.1093/cid/cix112 |
| [11] |
Garnacho-Montero J, Dimopoulos G, Poulakou G, et al. Task force on management and prevention of Acinetobacter baumannii infections in the ICU[J]. Intensive Care Med, 2015, 41(12): 2057-2075. DOI:10.1007/s00134-015-4079-4 |
| [12] |
Li Y, Ge H, Zhou H, et al. Impact of environmental cleaning on the colonization and infection rates of multidrug-resistant Acinetobacter baumannii in patients within the intensive care unit in a tertiary hospital[J]. Antimicrob Resist Infect Control, 2021, 10(1): 4. DOI:10.1186/s13756-020-00870-y |
| [13] |
Doan TN, Kong DCM, Marshall C, et al. Characterising the transmission dynamics of Acinetobacter baumannii in intensive care units using hidden Markov models[J]. PLoS One, 2015, 10(7): e0132037. DOI:10.1371/journal.pone.0132037 |
| [14] |
Dadon Z, Ben-Chetrit E, Benjaminov O, et al. The role of the computerized tomography scanner in the cross-transmission of carbapenem-resistant Acinetobacter baumannii between hospitalized patients[J]. Clin Microbiol Infect, 2021, 27(4): 635. |
| [15] |
李玉森, 杜慧, 李宁, 等. 荧光标记法在综合重症监护室物体表面清洁质量监测中的应用[J]. 中国消毒学杂志, 2019, 36(3): 212-214. Li YS, Du H, Li N, et al. Application of fluorescent labeling method in monitoring surface cleaning quality of objects in integrated intensive care unit[J]. Chinese Journal of Disinfection, 2019, 36(3): 212-214. |
| [16] |
McConville TH, Sullivan SB, Gomez-Simmonds A, et al. Carbapenem-resistant Enterobacteriaceae colonization (CRE) and subsequent risk of infection and 90-day mortality in critically ill patients, an observational study[J]. PLoS One, 2017, 12(10): e0186195. DOI:10.1371/journal.pone.0186195 |
| [17] |
Tschudin-Sutter S, Carroll KC, Tamma PD, et al. Impact of toxigenic Clostridium difficile colonization on the risk of subsequent C. difficile infection in intensive care unit patients[J]. Infect Control Hosp Epidemiol, 2015, 36(11): 1324-1329. DOI:10.1017/ice.2015.177 |
| [18] |
李诗雨, 黄文治, 李莉, 等. 术前洗必泰擦浴对降低椎管术后患者手术部位感染发生率的效果[J]. 中国感染控制杂志, 2016, 15(8): 583-586. Li SY, Huang WZ, Li L, et al. Evaluation of preoperative chlorhexidine bath for reducing the incidence of surgical site infection in patients undergoing spinal surgery[J]. Chinese Journal of Infection Control, 2016, 15(8): 583-586. DOI:10.3969/j.issn.1671-9638.2016.08.011 |
| [19] |
Montecalvo MA, McKenna D, Yarrish R, et al. Chlorhexidine bathing to reduce central venous catheter-associated bloodstream infection: impact and sustainability[J]. Am J Med, 2012, 125(5): 505-511. DOI:10.1016/j.amjmed.2011.10.032 |
| [20] |
Climo MW, Sepkowitz KA, Zuccotti G, et al. The effect of daily bathing with chlorhexidine on the acquisition of methicillin-resistant Staphylococcus aureus, vancomycin-resistant Enterococcus, and healthcare-associated bloodstream infections: results of a quasi-experimental multicenter trial[J]. Crit Care Med, 2009, 37(6): 1858-1865. DOI:10.1097/CCM.0b013e31819ffe6d |
| [21] |
吕春梅, 凌冬兰, 王桂英, 等. 洗必泰擦浴对ICU患者多重耐药菌感染的影响[J]. 中国感染控制杂志, 2018, 17(6): 531-534. Lv CM, Ling DL, Wang GY, et al. Effect of chlorhexidine bathing on multidrug-resistant orgnism infection in patients in intensive care unit[J]. Chinese Journal of Infection Control, 2018, 17(6): 531-534. DOI:10.3969/j.issn.1671-9638.2018.06.014 |



